
rúčka a ďalšie príznaky podobné chrípke. Uvedené účinky sú veľmi časté (môžu postihovať viac ako 1 z 10 osôb). Ďalšie príznaky v súvislosti s podaním infúzie sú: nevoľnosť (nauzea), vracanie, bolesť, zvýšené svalové napätie a tras, bolesť hlavy, závraty, poruchy dýchania, sipot (ťažké dýchanie), zvýšenie alebo zníženie krvného tlaku, poruchy srdcového rytmu (palpitácie, búšenie srdca alebo nepravidelný tep), opuch tváre a pier, vyrážka a pocit únavy. Niektoré z týchto príznakov môžu byť závažné, u niekoľkých pacientov došlo i k úmrtiu (pozri časť 2 „Upozornenia a opatrenia“).
K uvedeným účinkom dochádza prevažne pri prvej intravenóznej infúzii („kvapkaní” do žily) a v priebehu prvých pár hodín od začiatku podávania infúzie. Prejavy sú zvyčajne prechodné. Počas infúzie a najmenej 6 hodín od začiatku prvej infúzie a 2 hodiny od začiatku nasledujúcich infúzií budete pod dohľadom lekára alebo zdravotnej sestry. Ak dôjde k niektorej reakcii, lekár alebo sestra spomalí alebo ukončí podávanie infúzie a môže vám podať lieky na potlačenie vedľajších účinkov. Po úprave príznakov je možné v podávaní infúzie pokračovať.
Občas sa stáva, že príznaky sa začnú prejavovať neskôr ako po 6 hodinách od začiatku podávania infúzie. Ak sa vám to stane, ihneď vyhľadajte lekára. Niekedy sa príznaky zmiernia a neskôr opäť zhoršia.
Ďalšie vedľajšie účinky, ktoré priamo nesúvisia s infúziou, sa môžu objaviť kedykoľvek v priebehu liečby Herceptinom. Niekedy sa vyskytujú závažné srdcové ťažkosti počas liečby a príležitostne po skončení liečby. Medzi ne patrí oslabenie srdcového svalu, ktoré môže viesť k zlyhaniu srdca, zápal (opuchnutie, sčervenanie a bolestivosť) výstelky okolo srdca a poruchy srdcového rytmu. Môže to vyvolávať také príznaky ako:
• dýchacie ťažkosti (vrátane ťažkostí, objavujúcich sa v noci),
• kašeľ,
• zadržiavanie tekutín (opuchy) v nohách alebo rukách,
• palpitácie (búšenie srdca alebo nepravidelný tep).
Lekár vám bude počas liečby pravidelne kontrolovať srdcovú činnosť, avšak ak si všimnete niektorý z vyššie spomínaných príznakov, mali by ste mu to hneď oznámiť.
Ak budete mať niektorý z vyššie uvedených príznakov keď ukončíte liečbu Herceptinom, navštívte svojho lekára a povedzte mu, že ste boli predtým liečený Herceptinom.
Veľmi časté vedľajšie účinky Herceptinu: môžu postihovať viac ako 1 z 10 osôb:
• infekcie
• hnačka
• zápcha
• pálenie záhy (dyspepsia)
• slabosť
• kožná vyrážka
• bolesť na hrudi
• bolesť brucha
• bolesť kĺbov
• nízky počet červených a bielych krviniek (ktoré pomáhajú bojovať s infekciou) občas s horúčkou
• bolesť svalov
• konjunktivitída (zápal očných spojoviek)
• slzenie očí
• krvácanie z nosa
• výtok z nosa
• vypadávanie vlasov
• triaška
• návaly horúčavy
• závrat
• ochorenie nechtov
• úbytok telesnej hmotnosti
• nechutenstvo
• nespavosť (insomnia)
• zmenené vnímanie chuti
• nízky počet krvných doštičiek
• necitlivosť alebo mravčenie v prstoch na rukách a nohách
• začervenanie, opuch alebo ranky v ústach a/alebo v hrdle
• bolesť, opuch, začervenanie alebo mravčenie v prstoch na rukách a nohách
Časté vedľajšie účinky Herceptinu: môžu postihovať menej ako 1 z 10 osôb
• alergické reakcie • sucho v ústach a suchá koža
• infekcie hrdla • znížená tvorba sĺz
• infekcie močového mechúra a kože • potenie
• pásový opar • pocit slabosti a choroby
• zápal prsníka • úzkosť
• zápal podžalúdkovej žľazy alebo pečene • depresia
• poruchy obličiek • poruchy myslenia
• zvýšené svalové napätie alebo tenzia
(hypertónia)
• bolesť v rukách a/alebo v nohách
• vyrážka (svrbivá)
• ospanlivosť (somnolencia)
• astma
• poruchy funkcie pľúc
• modriny • bolesť chrbta
• hemoroidy • bolesť šije
• svrbenie kože • bolesť kostí
• akné
• kŕče v nohách.
Menej časté vedľajšie účinky Herceptinu: môžu postihovať menej ako 1 zo 100 osôb
• hluchota
• hrboľatá vyrážka
Zriedkavé vedľajšie účinky Herceptinu: môžu postihovať menej ako 1 z 1 000 osôb
• slabosť
• žltačka
• zápal alebo zjazvenie pľúc
Ďalšie vedľajšie účinky, ktoré boli hlásené pri použití Herceptinu: častosť sa nedá odhadnúť
z dostupných údajov
• nezvyčajná alebo zhoršená zrážanlivosť krvi
• anafylaktické reakcie
• vysoké hladiny draslíka
• opuch mozgu
• opuch alebo krvácanie očného pozadia
• šok
• opuch výstelky srdca
• pomalý pulz
• nepravidelnosti srdcového rytmu
• dychová tieseň
• zlyhávanie dýchania
• náhle hromadenie tekutiny v pľúcach
• náhle zúženie dýchacích ciest
• veľmi nízka hladina kyslíka v krvi
• opuch hrdla
• ťažkosti s dýchaním vo vodorovnej polohe
• porucha/zlyhávanie funkcie pečene
• opuch tváre, pier a hrdla
• zlyhávanie funkcie obličiek
• nezvyčajne nízka hladina tekutiny okolo plodu v maternici
• nedostatočný vývoj pľúc v maternici
• nedostatočný vývoj obličky v maternici
Niektoré z týchto účinkov môžu byť spôsobené nádorom prsníka. Ak dostávate Herceptin v kombinácii s chemoterapiou, niektoré môže vyvolávať chemoterapia.
Ak sa u vás vyskytne akýkoľvek vedľajší účinok obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
Hlásenie vedľajších účinkov
Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Vedľajšie účinky môžete hlásiť aj priamo prostredníctvom národného systému hlásenia uvedeného v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu
ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať HerceptinTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na označení vonkajšieho obalu a na označení štítku injekčnej liekovky po skratke EXP. Dátum exspirácie sa vzťahuje na posledný deň
v danom mesiaci.
Uchovávajte v chladničke pri teplote (2°C – 8°C).
Infúzne roztoky sa majú použiť hneď po nariedení. Herceptin nepoužite, ak pred podaním v roztoku spozorujete nejaké čiastočky alebo zmenu jeho zafarbenia.
Lieky sa nesmú likvidovať odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Čo Herceptin obsahuje
• Liečivo je trastuzumab. Každá injekčná liekovka obsahuje 150 mg trastuzumabu, ktorý sa má rozpustiť v 7,2 ml vody na injekciu. Výsledný roztok obsahuje približne 21 mg/ml trastuzumabu.
• Ďalšie zložky sú L-histidíniumchlorid, L-histidín, dihydrát α,α-trehalózy, polysorbát 20.
Ako vyzerá Herceptin a obsah balenia
Herceptin je prášok na koncentrát na intravenózny infúzny roztok, ktorý sa dodáva v sklenených injekčných liekovkách s gumovou zátkou s obsahom 150 mg trastuzumabu. Prášok je v peletách bielej až svetložltej farby sušených za mrazu. Jedna škatuľka obsahuje jednu injekčnú liekovku s práškom.
Držiteľ rozhodnutia o registrácii
Roche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
Výrobca
Roche Pharma AG Emil-Barell-Strasse 1
D-79639 Grenzach-Wyhlen
Nemecko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa rozhodnutia o registrácii:
België/Belgique/Belgien
N.V. Roche S.A.
Tél/Tel: +32 (0) 2 525 82 11
Lietuva
UAB “Roche Lietuva” Tel: +370 5 2546799
България
Рош България ЕООД Тел: +359 2 818 44 44
Luxembourg/Luxemburg
(Voir/siehe Belgique/Belgien)
Česká republika
Roche s. r. o.
Tel: +420 - 2 20382111
Magyarország
Roche (Magyarország) Kft. Tel: +36 - 23 446 800
Danmark
Roche a/s
Tlf: +45 - 36 39 99 99
Malta
(See United Kingdom)
Deutschland
Roche Pharma AG Tel: +49 (0) 7624 140
Nederland
Roche Nederland B.V. Tel: +31 (0) 348 438050
Eesti
Roche Eesti OÜ
Tel: + 372 - 6 177 380
Norge
Roche Norge AS
Tlf: +47 - 22 78 90 00
Ελλάδα
Roche (Hellas) A.E.
Τηλ: +30 210 61 66 100
Österreich
Roche Austria GmbH Tel: +43 (0) 1 27739
España
Roche Farma S.A.
Tel: +34 - 91 324 81 00
Polska
Roche Polska Sp.z o.o. Tel: +48 - 22 345 18 88
France
Roche
Tél: +33 (0)1 47 61 40 00
Portugal
Roche Farmacêutica Química, Lda
Tel: +351 - 21 425 70 00
Hrvatska
Roche d.o.o.
Tel: + 385 1 47 22 333
România
Roche România S.R.L. Tel: +40 21 206 47 01
Ireland
Roche Products (Ireland) Ltd. Tel: +353 (0) 1 469 0700
Slovenija
Roche farmacevtska družba d.o.o. Tel: +386 - 1 360 26 00
Ísland
Roche a/s
c/o Icepharma hf
Sími: +354 540 8000
Slovenská republika
Roche Slovensko, s.r.o. Tel: +421 - 2 52638201
Italia
Roche S.p.A.
Tel: +39 - 039 2471
Suomi/Finland
Roche Oy
Puh/Tel: +358 (0) 10 554 500
Kύπρος
Γ.Α.Σταμάτης & Σια Λτδ.
Τηλ: +357 - 22 76 62 76
Sverige
Roche AB
Tel: +46 (0) 8 726 1200
Latvija
Roche Latvija SIA
Tel: +371 - 6 7039831
United Kingdom
Roche Products Ltd.
Tel: +44 (0) 1707 366000
Táto písomná informácia pre používateľa bola naposledy aktualizovaná v
Ďalšie zdroje informácií
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.Táto informácia pre používateľa je k dispozícii vo všetkých jazykoch EÚ/EHP na webovej stránke
Európskej agentúry pre lieky.
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov
Tento liek sa vždy musí uchovávať v uzavretom pôvodnom balení a v chladničke pri teplote 2 °C - 8
°C. Injekčná liekovka Herceptinu nariedeného sterilnou vodou na injekciu (nie je súčasťou balenia) si pri teplote 2 °C - 8 °C uchováva stabilitu počas 48 hodín od nariedenia, pričom sa nesmie zmrazovať.
Za príslušných aseptických podmienok sa každá injekčná liekovka Herceptinu nariedi s 7,2 ml sterilnej vody na injekciu (ktorá nie je súčasťou balenia). Na nariedenie lieku sa nesmú použiť iné rozpúšťadlá. Po nariedení získame 7,4 ml roztoku, ktorý je určený na jednorazové podanie. V 1 ml nariedeného roztoku sa nachádza približne 21 mg trastuzumabu. 4 %-ná rezerva objemu umožňuje natiahnuť vyznačenú dávku 150 mg z každej injekčnej liekovky.
Počas narieďovania sa má s Herceptinom manipulovať opatrne. Nadmerné spenenie počas nariedenia alebo trasenie nariedeného roztoku Herceptinu môže spôsobiť ťažkosti s natiahnutím potrebného množstva lieku z injekčnej liekovky.
Návod na nariedenie:
1) Pomocou sterilnej injekčnej striekačky pomaly vstreknite 7,2 ml sterilnej vody na injekciu do injekčnej liekovky obsahujúcej lyofilizovaný prášok Herceptinu. Prúd sterilnej vody na injekciu nasmerujte na lyofilizovanú hrudku v injekčnej liekovke.
2) Pri nariedení si môžete pomôcť jemným krúživým pohybom injekčnej liekovky. LIEKOVKOU NETRASTE!
Často dochádza po nariedení lieku k jeho miernemu speneniu. Injekčnú liekovku nechajte voľne stáť približne 5 minút. Nariedený roztok Herceptinu má číru až svetložltú farbu a nesmie obsahovať žiadne viditeľné čiastočky.
Potrebný objem roztoku sa vypočíta:
• na základe úvodnej dávky 4 mg trastuzumabu/kg telesnej hmotnosti, alebo následnej týždennej dávky 2 mg trastuzumabu/kg telesnej hmotnosti pomocou nasledujúceho vzorca:
Objem (ml) = telesná hmotnosť(kg) x dávka (4 mg/kg – úvodná alebo 2 mg/kg - udržiavacia)
21 (mg/ml, koncentrácia rekonštituovaného roztoku)
• na základe úvodnej dávky 8 mg trastuzumabu/kg telesnej hmotnosti, alebo následnej dávky
6 mg/kg telesnej hmotnosti podanej každé tri týždne pomocou nasledujúceho vzorca:
Objem (ml) = telesná hmotnosť(kg) x dávka (8 mg/kg – úvodná alebo 6 mg/kg - udržiavacia)
21 (mg/ml, koncentrácia rekonštituovaného roztoku)
Príslušné množstvo roztoku je potrebné natiahnuť z injekčnej liekovky a pridať do infúzneho vaku z polyvinylchloridu, polyetylénu alebo polypropylénu obsahujúceho 250 ml 0,9 % roztoku chloridu sodného. Nepoužívajte roztoky obsahujúce glukózu. Kvôli premiešaniu je potrebné vak jemne prevracať, aby nedošlo k speneniu jeho obsahu. Pred podaním sa parenterálne roztoky majú vizuálne skontrolovať, či neobsahujú žiadne viditeľné čiastočky a či nedošlo k zmene ich sfarbenia. Po príprave sa má infúzia okamžite podať. Ak sa liek zriedi za aseptických podmienok, môže sa uchovávať
24 hodín (pri teplote neprevyšujúcej 30 °C).
Písomná informácia pre používateľa Herceptin 600 mg injekčný roztok v liekovke Trastuzumab
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.
• Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
• Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
• Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Pozri časť 4.
V tejto písomnej informácii pre používateľa sa dozviete:
1. Čo je Herceptin a na čo sa používa
2. Čo potrebujete vedieť predtým, ako vám podajú Herceptin
3. Ako sa Herceptin podáva
4. Možné vedľajšie účinky
5. Ako uchovávať Herceptin
6. Obsah balenia a ďalšie informácie
1. Čo je Herceptin a na čo sa používa
Herceptin obsahuje liečivo trastuzumab, čo je monoklonálna protilátka. Monoklonálne protilátky sa prichytávajú na určité bielkoviny alebo na antigény. Trastuzumab je vyvinutý tak, aby sa viazal selektívne na antigén, ktorý sa nazýva receptor ľudského epidermálneho rastového faktora 2 (HER2). HER2 sa nachádza vo veľkom množstve na povrchu niektorých rakovinových buniek, kde stimuluje ich rast. Keď sa Herceptin naviaže na HER2, zastavuje rast nádorových buniek a spôsobuje ich odumieranie.
Lekár vám môže predpísať Herceptin na liečbu karcinómu prsníka a žalúdka v prípade, že:
• máte včasný karcinóm prsníka s vysokou hladinou proteínu nazývaného HER2.
• máte metastatický karcinóm prsníka ( rakovinu prsníka, ktorá sa rozšírila mimo pôvodného ložiska nádoru) s vysokou hladinou HER2. Herceptin je možné predpísať v kombinácii s chemoterapeutickými liečivami paklitaxel alebo docetaxel ako prvú liečbu metastatického karcinómu prsníka alebo ho možno predpísať samostatne, ak sa iné druhy liečby ukázali neúčinné. Používa sa aj v kombinácii s liekmi, ktoré sa volajú inhibítory aromatázy u pacientov s vysokou hladinou HER2 a s pozitivitou hormonálneho receptora pri metastatickom karcinóme prsníka ( karcinóme, ktorý je citlivý na prítomnosť ženských pohlavných hormónov).
2. Čo potrebuje vedieť predtým, ako vám podajú Herceptin
Nepoužívajte Herceptin ak:
• ste alergický na trastuzumab (liečivo Herceptinu), myšie bielkoviny alebo na ktorúkoľvek z ďalších zložiek tohto lieku (uvedených v časti 6).
• máte vážne ťažkosti s dýchaním v pokoji z dôvodu nádorového ochorenia alebo ak potrebujete podpornú kyslíkovú liečbu.
Upozornenia a opatrenia
Lekár bude starostlivo dozerať na vašu liečbu.
Kontrola srdca
Liečba Herceptinom samotným alebo s taxánmi môže ovplyvniť činnosť srdca, hlavne ak ste niekedy užívali antracyklín (taxány a antracyklíny sú dva ďalšie druhy liekov používaných na liečbu rakoviny).
Účinky môžu byť stredne závažné až závažné a môžu spôsobiť úmrtie. Preto vám pred liečbou, počas
liečby (každé tri mesiace) a po liečbe (počas dvoch až piatich rokov) Herceptinom budú kontrolovať funkciu srdca. Ak sa u vás vyvinú nejaké znaky srdcového zlyhania (t.j. nedostatočné prečerpávanie krvi srdcom), možno vám budú funkciu srdca kontrolovať častejšie (každých šesť až osem týždňov), možno vám predpíšu liečbu na srdcové zlyhávanie alebo budete musieť ukončiť liečbu Herceptinom.
Povedzte lekárovi, lekárnikovi alebo zdravotnej sestre predtým, ako vám podajú Herceptin ak:
• ste mali zlyhanie srdca, ochorenie koronárnych tepien, poškodenie srdcových chlopní (srdcový šelest), vysoký krvný tlak, užívali ste nejaký liek na vysoký krvný tlak alebo práve užívate nejaký liek na vysoký krvný tlak.
• ste používali alebo v súčasnosti používate liek nazývaný doxorubicín alebo epirubicín (lieky používané na liečbu nádoru). Tieto lieky (alebo všetky ďalšie antracyklíny) môžu pri liečbe Herceptinom poškodiť srdcový sval a zvýšiť riziko srdcových komplikácií.
• trpíte dýchavičnosťou, zvlášť ak v súčasnosti užívate taxány. Herceptin môže spôsobiť ťažkosti s dýchaním, najmä pri prvom podaní. Stav môže byť závažnejší, ak sa vám už teraz zle dýcha. Vo veľmi zriedkavých prípadoch došlo k úmrtiu pacientov, ktorí už pred začiatkom liečby Herceptinom trpeli vážnymi problémami s dýchaním.
• ste sa niekedy liečili na iný druh rakoviny.
Ak dostávate Herceptin spolu s inými liekmi na liečbu nádoru ako napríklad paklitaxel, docetaxel, inhibítor aromatázy, karboplatinu alebo cisplatinu, prečítajte si aj písomné informácie pre používateľa pre tieto lieky.
Deti a dospievajúci
Liečba Herceptinom sa u osôb mladších ako 18 rokov neodporúča. v
Iné lieky a Herceptin
Ak užívate alebo ste v poslednom čase užívali, resp. budete užívať ďalšie lieky, povedzte to svojmu lekárovi, lekárnikovi alebo zdravotnej sestre.
Môže trvať až 7 mesiacov, kým sa Herceptin vylúči z organizmu. Preto ak začnete nejakú novú liečbu
, upozornite svojho lekára, lekárnika alebo zdravotnú sestru, že ste sa liečili Herceptinom ak začnete liečbu akýmkoľvek novým liekom 7 mesiacov po ukončení liečby.
Tehotenstvo
• Ak ste tehotná, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom, lekárnikom alebo zdravotnou sestrou predtým, ako začnete užívať tento liek.
• Počas liečby Herceptinom a ešte 7 mesiacov po ukončení liečby by ste mali používať účinnú antikoncepciu.
• Váš lekár vás bude informovať o rizikách a prínosoch užívania Herceptinu v priebehu tehotenstva. V zriedkavých prípadoch došlo u tehotných žien liečených Herceptinom k úbytku tekutiny, ktorá v maternici obklopuje nenarodené dieťa. Táto situácia môže byť škodlivá pre vaše dieťa v maternici a je spojená s poruchou zrenia pľúc, čo môže viesť k úmrtiu plodu.
Dojčenie
Počas liečby Herceptinom a ešte 7 mesiacov po poslednej dávke Herceptinu nedojčite dieťa lebo
Herceptin a môže preniesť na vaše dieťa prostredníctvom materského mlieka.
Skôr ako začnete užívať akýkoľvek liek, poraďte sa so svojím lekárom, lekárnikom alebo zdravotnou sestrou.
Vedenie vozidiel a obsluha strojov
Nie je známe, či Herceptin môže ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje. Ak sa u vás počas liečby Herceptinom vyskytnú príznaky, ako napríklad triaška alebo horúčka, nesmiete
viesť vozidlá ani obsluhovať stroje, kým tieto príznaky nevymiznú.
3. Ako sa Herceptin podáva
Pred začiatkom liečby lekár v nádore stanoví množstvo HER2. Len pacienti s vysokými hodnotami
HER2 budú dostávať liečbu Herceptinom. Herceptin môže podávať len lekár alebo zdravotná sestra.
Existujú dva rôzne typy (podľa spôsobu podania) Herceptinu :
• jeden sa podáva ako infúzia do žily (intravenózna infúzia)
• druhý sa podáva ako podkožná injekcia (subkutánna injekcia).
Je dôležité skontrolovať označenie na lieku a uistiť sa, že sa bude podávať správny liek, tak ako je predpísané. Fixná dávka Herceptinu na subkutánne použitie nie je určená na intravenózne podanie a môže sa podať iba ako subkutánna injekcia.
Aby sa predišlo chybám v medikácii, je dôležité skontrolovať označenie na injekčných liekovkách, aby sa zabezpečilo, že liek, ktorý sa pripravuje a podáva je Herceptin (trastuzumab) a nie trastuzumab emtansin.
Odporúčaná dávka je 600 mg. Herceptin sa podáva ako subkutánna injekcia (pod kožu) po dobu 2-5
minút každé tri týždne.
Miesto podania injekcie sa má striedať medzi ľavým a pravým stehnom. Ďalšie injekcie sa majú aplikovať najmenej 2,5 cm ďalej od predchádzajúceho miesta podania. Žiadna injekcia sa nemá podávať do oblastí, kde je koža červená, citlivá, tvrdá alebo s podliatinami.
Ak sa podávajú iné lieky na podkožné použitie v priebehu liečby Herceptinom, má sa použiť odlišné miesto na podanie injekcie .
Herceptin sa nemá miešať ani riediť s inými liekmi.
Ak prestanete používať Herceptin
Neprestaňte používať tento liek bez predchádzajúcej konzultácie so svojím lekárom. Všetky dávky sa majú užívať v správnom čase každé tri týždne. Tak bude liek pôsobiť čo najúčinnejšie.
Môže trvať až 7 mesiacov, kým sa Herceptin vylúči z vášho tela. Preto sa váš lekár môže rozhodnúť, že vám bude naďalej kontrolovať funkciu srdca aj po ukončení liečby.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára, lekárnika alebo zdravotnej sestry.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. Niektoré z nich môžu byť závažné a môžu viesť k hospitalizácii pacienta.
Počas liečby Herceptinom sa môže objaviť triaška, horúčka a ďalšie príznaky podobné chrípke. Uvedené účinky sú veľmi časté (môže postihovať viac ako 1 z 10 osôb). Ďalšie príznaky sú: nevoľnosť (nauzea), vracanie, bolesť, zvýšené svalové napätie a tras, bolesť hlavy, závraty, poruchy dýchania, sipot (ťažké dýchanie), zvýšenie alebo zníženie krvného tlaku, poruchy srdcového rytmu (palpitácie, búšenie srdca alebo nepravidelný tep), opuch tváre a pier, vyrážka a pocit únavy. Niektoré z týchto príznakov môžu byť závažné, u niekoľkých pacientov došlo i k úmrtiu (pozri časť
„Upozornenia a opatrenia“).
Počas podávania a najmenej počas šiestich hodín od začiatku prvého podania a počas dvoch hodín od začiatku ďalších podaní vás bude zdravotnícky pracovník sledovať.
Niekedy sa môžu objaviť srdcové ťažkosti, a to v priebehu liečby a občas aj po ukončení liečby a môžu byť závažné. Niekedy sa vyskytujú závažné srdcové ťažkosti počas liečby a príležitostne po skončení liečby. Medzi ne patrí oslabenie srdcového svalu, ktoré môže viesť k zlyhaniu srdca, zápal (opuchnutie, sčervenanie a bolestivosť) výstelky okolo srdca a poruchy srdcového rytmu. Môže to vyvolávať také príznaky ako:
• dýchacie ťažkosti (vrátane ťažkostí, objavujúcich sa v noci)
• kašeľ
• zadržiavanie tekutín (opuchy) v nohách alebo rukách
• palpitácie (búšenie srdca alebo nepravidelný tep).
Lekár vám bude počas liečby pravidelne kontrolovať srdcovú činnosť, avšak ak si všimnete niektorý z vyššie spomínaných príznakov, mali by ste mu to hneď oznámiť.
Ak budete mať niektorý z vyššie uvedených príznakov keď ukončíte liečbu Herceptinom, navštívte svojho lekára a povedzte mu, že ste predtým boli liečený Herceptinom.
Existujú dva rôzne typy (podľa spôsobu podania) Herceptinu :
• jeden sa podáva ako infúzia do žily počas 30 až 90 minút
• druhý sa podáva ako podkožná injekcia počas 2-5 minút.
V klinickej štúdii porovnávajúcej tieto dve formy, sa častejšie vyskytli infekcie a srdcové príhody, ktoré viedli k hospitalizácii pri podkožnom podaní. Boli zaznamenané častejšie lokálne reakcie v mieste vpichu injekcie a vyššie zvýšenie krvného tlaku. Ďalšie vedľajšie účinky boli podobné.
Veľmi časté vedľajšie účinky Herceptinu: môže postihovať viac ako 1 z 10 osôb
• infekcie
• hnačka
• zápcha
• pálenie záhy (dyspepsia)
• slabosť
• kožná vyrážka
• bolesť na hrudi
• bolesť brucha
• bolesť kĺbov
• nízky počet červených krviniek a bielych krviniek (ktoré pomáhajú bojovať s infekciou), občas s horúčkou
• bolesť svalov
• konjunktivitída (zápal očných spojoviek)
• slzenie očí
• krvácanie z nosa
• výtok z nosa
• vypadávanie vlasov
• triaška
• návaly horúčavy
• závrat
• ochorenie nechtov
• úbytok telesnej hmotnosti
• nechutenstvo
• nespavosť (insomnia)
• zmenené vnímanie chuti
• nízky počet krvných doštičiek
• necitlivosť alebo mravčenie v prstoch na rukách a nohách
• začervenanie, opuch alebo ranky v ústach a/alebo v hrdle
• bolesť, opuch, začervenanie alebo mravčenie v prstoch na rukách a nohách
Časté vedľajšie účinky Herceptinu: môžu postihovať menej ako 1 z 10 osôb
• alergické reakcie • znížená tvorba sĺz
• infekcie hrdla • potenie
• infekcie močového mechúra a kože • pocit slabosti a choroby
• pásový opar • úzkosť
• zápal prsníka • depresia
• zápal podžalúdkovej žľazy alebo pečene • poruchy myslenia
• poruchy obličiek • astma
• zvýšené svalové napätie alebo tenzia
(hypertónia)
• bolesť v rukách a /alebo v nohách
• poruchy funkcie pľúc
• bolesť chrbta
• vyrážka (svrbivá) • bolesť šije
• ospanlivosť (somnolencia) • bolesť kostí
• modriny • akné
• hemoroidy • kŕče v nohách
• svrbenie kože
• sucho v ústach a suchá koža
Menej časté vedľajšie účinky Herceptinu: môžu postihovať menej ako 1 zo 100 osôb
• hluchota
• hrboľatá vyrážka
Zriedkavé vedľajšie účinky Herceptinu: môžu postihovať menej ako 1 z 1 000 osôb
• slabosť
• žltačka
• zápal alebo zjazvenie pľúc
Ďalšie vedľajšie účinky, ktoré boli hlásené pri použití Herceptinu: častosť sa nedá odhadnúť
z dostupných údajov
• nezvyčajná alebo zhoršená zrážanlivosť krvi
• anafylaktické reakcie
• vysoké hladiny draslíka
• opuch mozgu
• opuch alebo krvácanie očného pozadia
• šok
• opuch výstelky srdca
• pomalý pulz
• nepravidelnosti srdcového rytmu
• dychová tieseň
• zlyhávanie dýchania
• náhle hromadenie tekutiny v pľúcach
• náhle zúženie dýchacích ciest
• veľmi nízka hladina kyslíka v krvi
• ťažkosti s dýchaním vo vodorovnej polohe
• porucha/zlyhávanie funkcie pečene
• opuch tváre, pier a hrdla
• zlyhávanie funkcie obličiek
• nezvyčajne nízka hladina tekutiny okolo plodu v maternici
• opuch hrdla
• nedostatočný vývoj pľúc v maternici
• nedostatočný vývoj obličky v maternici
Niektoré z týchto účinkov môžu byť spôsobené nádorom prsníka. Ak dostávate Herceptin v kombinácii s chemoterapiou, niektoré môže vyvolávať chemoterapia.
Ak sa u vás vyskytne akýkoľvek vedľajší účinok obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
Hlásenie vedľajších účinkovAk sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej

informácii pre používateľa. Vedľajšie účinky môžete hlásiť aj priamo prostredníctvom národného systému hlásenia uvedeného v
Prílohe V*. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať HerceptinTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na označení škatuľky a na označení injekčnej liekovky po EXP. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Uchovávajte v chladničke pri teplote (2°C – 8°C).
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom. Neuchovávajte v mrazničke.
Po otvorení injekčnej liekovky sa má roztok použiť okamžite.
Nepoužívajte tento liek, ak spozorujete akékoľvek čiastočky alebo sfarbenie pred podaním. Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne.
Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo Herceptin obsahuje• Liečivo je trastuzumab. Jedna 5 ml injekčná liekovka obsahuje 600 mg trastuzumabu.
• Ďalšie zložky sú ľudská rekombinantná hyaluronidáza (rHuPH20), L-histidín , L- histidíniumchlorid monohydrát, α,α-dihydrát trehalózy, L-metionín, polysorbát 20, voda na injekciu
Ako vyzerá Herceptin a obsah baleniaHerceptin je roztok na injekciu, ktorý sa dodáva v sklenej injekčnej liekovke s gumovou zátkou, obsahujúca 5 ml (600 mg) trastuzumabu. Roztok je číry až opaleskujúci a bezfarebný až nažtlý
Každá škatuľka obsahuje jednu injekčnú liekovku.
Držiteľ rozhodnutia o registrácii
Roche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
Výrobca
Roche Pharma AG Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Nemecko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa rozhodnutia o registrácii:
België/Belgique/Belgien
N.V. Roche S.A.
Tél/Tel: +32 (0) 2 525 82 11
Lietuva
UAB “Roche Lietuva” Tel: +370 5 2546799
България
Рош България ЕООД Тел: +359 2 818 44 44
Luxembourg/Luxemburg
(Voir/siehe Belgique/Belgien)
Česká republika
Roche s. r. o.
Tel: +420 - 2 20382111
Magyarország
Roche (Magyarország) Kft. Tel: +36 - 23 446 800
Danmark
Roche a/s
Tlf: +45 - 36 39 99 99
Malta
(See United Kingdom)
Deutschland
Roche Pharma AG Tel: +49 (0) 7624 140
Nederland
Roche Nederland B.V. Tel: +31 (0) 348 438050
Eesti
Roche Eesti OÜ
Tel: + 372 - 6 177 380
Norge
Roche Norge AS
Tlf: +47 - 22 78 90 00
Ελλάδα
Roche (Hellas) A.E.
Τηλ: +30 210 61 66 100
Österreich
Roche Austria GmbH Tel: +43 (0) 1 27739
España
Roche Farma S.A.
Tel: +34 - 91 324 81 00
Polska
Roche Polska Sp.z o.o. Tel: +48 - 22 345 18 88
France
Roche
Tél: +33 (0)1 47 61 40 00
Portugal
Roche Farmacêutica Química, Lda
Tel: +351 - 21 425 70 00
Hrvatska
Roche d.o.o.
Tel: + 385 1 47 22 333
România
Roche România S.R.L. Tel: +40 21 206 47 01
Ireland
Roche Products (Ireland) Ltd. Tel: +353 (0) 1 469 0700
Slovenija
Roche farmacevtska družba d.o.o. Tel: +386 - 1 360 26 00
Ísland
Roche a/s
c/o Icepharma hf
Sími: +354 540 8000
Slovenská republika
Roche Slovensko, s.r.o. Tel: +421 - 2 52638201
Italia
Roche S.p.A.
Tel: +39 - 039 2471
Suomi/Finland
Roche Oy
Puh/Tel: +358 (0) 10 554 500
Kύπρος
Γ.Α.Σταμάτης & Σια Λτδ.
Τηλ: +357 - 22 76 62 76
Sverige
Roche AB
Tel: +46 (0) 8 726 1200
Latvija
Roche Latvija SIA
Tel: +371 - 67 039831
United Kingdom
Roche Products Ltd.
Tel: +44 (0) 1707 366000
Táto písomná informácia pre používateľa bola naposledy aktualizovaná v
Ďalšie zdroje informácií
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.Táto informácia pre používateľa je k dispozícii vo všetkých jazykoch EÚ/EHP na webovej stránke
Európskej agentúry pre lieky.
Písomná informácia pre používateľa
Herceptin 600 mg injekčný roztok v aplikačnom systéme
Trastuzumab
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.
• Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
• Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
• Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Pozri časť 4.
V tejto písomnej informácii pre používateľa sa dozviete:
1. Čo je Herceptin a na čo sa používa
2. Čo potrebujete vedieť predtým, ako vám podajú Herceptin
3. Ako sa Herceptin podáva
4. Možné vedľajšie účinky
5. Ako uchovávať Herceptin
6. Obsah balenia a ďalšie informácie
7. Pokyny na podanie injekcie Herceptinu pomocou aplikačného systému
1. Čo je Herceptin a na čo sa používa
Herceptin obsahuje liečivo trastuzumab, čo je monoklonálna protilátka. Monoklonálne protilátky sa prichytávajú na určité bielkoviny alebo na antigény. Trastuzumab je vyvinutý tak, aby sa viazal selektívne na antigén, ktorý sa nazýva receptor ľudského epidermálneho rastového faktora 2 (HER2). HER2 sa nachádza vo veľkom množstve na povrchu niektorých rakovinových buniek, kde stimuluje ich rast. Keď sa Herceptin naviaže na HER2, zastavuje rast nádorových buniek a spôsobuje ich odumieranie.
Lekár vám môže predpísať Herceptin na liečbu karcinómu prsníka a žalúdka v prípade, že:
• máte včasný karcinóm prsníka s vysokou hladinou proteínu nazývaného HER2.
• máte metastatický karcinóm prsníka ( rakovinu prsníka, ktorá sa rozšírila mimo pôvodného ložiska nádoru) s vysokou hladinou HER2. Herceptin je možné predpísať v kombinácii s chemoterapeutickými liečivami paklitaxel alebo docetaxel ako prvú liečbu metastatického karcinómu prsníka alebo ho možno predpísať samostatne, ak sa iné druhy liečby ukázali neúčinné. Používa sa aj v kombinácii s liekmi, ktoré sa volajú inhibítory aromatázy u pacientov s vysokou hladinou HER2 a s pozitivitou hormonálneho receptora pri metastatickom karcinóme prsníka (karcinóme, ktorý je citlivý na prítomnosť ženských pohlavných hormónov).
2. Čo potrebuje vedieť predtým, ako vám podajú Herceptin
Nepoužívajte Herceptin ak:
• ste alergický na trastuzumab (liečivo Herceptinu), myšie bielkoviny alebo na ktorúkoľvek z ďalších zložiek tohto lieku (uvedených v časti 6).
• máte vážne ťažkosti s dýchaním v pokoji z dôvodu nádorového ochorenia alebo ak potrebujete podpornú kyslíkovú liečbu.
Upozornenia a opatrenia
Lekár bude starostlivo dozerať na vašu liečbu.
Kontrola srdca
Liečba Herceptinom samotným alebo s taxánmi môže ovplyvniť činnosť srdca, hlavne ak ste niekedy užívali antracyklín (taxány a antracyklíny sú dva ďalšie druhy liekov používaných na liečbu rakoviny).
Účinky môžu byť stredne závažné až závažné a môžu spôsobiť úmrtie. Preto vám pred liečbou, počas
liečby (každé tri mesiace) a po liečbe (počas dvoch až piatich rokov) Herceptinom budú kontrolovať funkciu srdca. Ak sa u vás vyvinú nejaké znaky srdcového zlyhania (t.j. nedostatočné prečerpávanie krvi srdcom), možno vám budú funkciu srdca kontrolovať častejšie (každých šesť až osem týždňov), možno vám predpíšu liečbu na srdcové zlyhávanie alebo budete musieť ukončiť liečbu Herceptinom.
Povedzte lekárovi, lekárnikovi alebo zdravotnej sestre predtým, ako vám podajú Herceptin ak:
• ste mali zlyhanie srdca, ochorenie koronárnych tepien, poškodenie srdcových chlopní (srdcový šelest), vysoký krvný tlak, užívali ste nejaký liek na vysoký krvný tlak alebo práve užívate nejaký liek na vysoký krvný tlak.
• ste používali alebo v súčasnosti používate liek nazývaný doxorubicín alebo epirubicín (lieky používané na liečbu nádoru). Tieto lieky (alebo všetky ďalšie antracyklíny) môžu pri liečbe Herceptinom poškodiť srdcový sval a zvýšiť riziko srdcových komplikácií.
• trpíte dýchavičnosťou, zvlášť ak v súčasnosti užívate taxány. Herceptin môže spôsobiť ťažkosti s dýchaním, najmä pri prvom podaní. Stav môže byť závažnejší, ak sa vám už teraz zle dýcha. Vo veľmi zriedkavých prípadoch došlo k úmrtiu pacientov, ktorí už pred začiatkom liečby Herceptinom trpeli vážnymi problémami s dýchaním.
• ste sa niekedy liečili na iný druh rakoviny.
• ste alergický na lepidlo (akrylového typu 562).
Ak dostávate Herceptin spolu s inými liekmi na liečbu nádoru ako napríklad paklitaxel, docetaxel, inhibítor aromatázy, karboplatinu alebo cisplatinu, prečítajte si aj písomné informácie pre používateľa pre tieto lieky.
Deti a dospievajúci
Liečba Herceptinom sa u osôb mladších ako 18 rokov neodporúča.
Iné lieky a Herceptin
Ak teraz užívate, alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky, povedzte to svojmu lekárovi, lekárnikovi alebo zdravotnej sestre.
Môže trvať až 7 mesiacov, kým sa Herceptin vylúči z organizmu. Preto ak začnete nejakú novú liečbu do 7 mesiacov po ukončení liečby Herceptinom, upozornite svojho lekára, lekárnika alebo zdravotnú sestru, že ste sa liečili Herceptinom.
Tehotenstvo
• Ak ste tehotná, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom, lekárnikom alebo zdravotnou sestrou predtým, ako začnete užívať tento liek.
• Počas liečby Herceptinom a ešte 7 mesiacov po ukončení liečby by ste mali používať účinnú antikoncepciu.
Váš lekár vás bude informovať o rizikách a prínosoch užívania Herceptinu v priebehu tehotenstva. V zriedkavých prípadoch došlo u tehotných žien liečených Herceptinom k úbytku tekutiny, ktorá v maternici obklopuje nenarodené dieťa. Táto situácia môže byť škodlivá pre vaše dieťa v maternici a je spojená s poruchou zrenia pľúc, čo môže viesť k úmrtiu plodu.
Dojčenie
Počas liečby Herceptinom a ešte 7 mesiacov po poslednej dávke Herceptinu nedojčite dieťa, lebo
Herceptin sa môže preniesť na vaše dieťa prostredníctvom materského mlieka.
Skôr ako začnete užívať akýkoľvek liek, poraďte sa so svojím lekárom, lekárnikom alebo zdravotnou sestrou.
Vedenie vozidiel a obsluha strojov
Nie je známe, či Herceptin môže ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje. Ak sa u vás počas liečby Herceptinom vyskytnú príznaky, ako napríklad triaška alebo horúčka, nesmiete
viesť vozidlá ani obsluhovať stroje, kým tieto príznaky nevymiznú.
3. Ako sa Herceptin podáva
Pred začiatkom liečby lekár v nádore stanoví množstvo HER2. Len pacienti s vysokými hodnotami HER2 budú dostávať liečbu Herceptinom. Herceptin v aplikačnom systéme môže podávať len lekár alebo zdravotná sestra.
Existujú dva rôzne typy (podľa spôsobu podania) Herceptinu :
• jeden sa podáva ako infúzia do žily (intravenózna infúzia)
• druhý sa podáva ako podkožná injekcia (subkutánna injekcia) pomocou manuálnej injekčnej striekačky alebo aplikačného systému.
Použite manuál na naplnenej striekačke alebo aplikačnom systéme.
Herceptin injekčný roztok v aplikačnom systéme nie je určený na intravenózne podanie a môže sa podať iba ako subkutánna injekcia.
Odporúčaná dávka Herceptinu injekčného roztoku v aplikačnom systéme je 600 mg. Herceptin sa podáva ako subkutánna injekcia (pod kožu) každé tri týždne.
Dĺžka podávania je približne 5 minút.
Miesto podania injekcie sa má striedať medzi ľavým a pravým stehnom. Ďalšie injekcie sa majú aplikovať najmenej 2,5 cm ďalej od predchádzajúceho miesta podania. Žiadna injekcia sa nemá podávať do oblastí, kde je koža červená, citlivá, tvrdá alebo s podliatinami.
Na vhodných miestach podania injekcie nesmú byť prítomné:
• kožné záhyby
• bolestivosť
• lézie (ranky)
• podliatiny
• jazvy
• strie
• začervenaná koža
• vyvýšené alebo drsné škvrny na koži
Pred podaním injekcie môže byť potrebné miesto podania injekcie vyholiť, aby sa uľahčilo
pripevnenie a odstránenie priľnavej podložky a aby sa zaistilo, že sa aplikačný systém pevne prilepí na stehno.
Podrobné informácie sú uvedené na konci tejto písomnej informácie pre používateľa (pozri „Pokyny na podanie injekcie Herceptinu pomocou aplikačného systému“).
Ak sa nepodá žiadna dávka kvôli nesprávnemu zaobchádzaniu s aplikačným systémom alebo kvôli jeho zlyhaniu, potom sa odporúča podať dávku novým aplikačným systémom. Ak sa vyskytnú opakované prípady nesprávneho zaobchádzania s aplikačným systémom alebo jeho zlyhania,
na podanie zvyšných dávok sa má použiť Herceptin 600 mg injekčný roztok v liekovke.
Ak sa podá len časť dávky kvôli nesprávnemu zaobchádzaniu s aplikačným systémom alebo kvôli jeho zlyhaniu, nasledujúca úplná dávka sa má podať na ďalšej plánovanej návšteve o 3 týždne. Ak sa vyskytnú opakované prípady nesprávneho zaobchádzania s aplikačným systémom alebo jeho zlyhania, na podanie zvyšných dávok sa má použiť Herceptin 600 mg injekčný roztok v liekovke.
Ak sa podávajú iné lieky na podkožné použitie v priebehu liečby Herceptinom, má sa použiť odlišné miesto na podanie injekcie.
Ak prestanete používať Herceptin
Neprestaňte používať tento liek bez predchádzajúcej konzultácie so svojím lekárom. Všetky dávky sa majú užívať v správnom čase každé tri týždne. Tak bude liek pôsobiť čo najúčinnejšie.
Môže trvať až 7 mesiacov, kým sa Herceptin vylúči z vášho tela. Preto sa váš lekár môže rozhodnúť, že vám bude naďalej kontrolovať funkciu srdca aj po ukončení liečby.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára, lekárnika alebo zdravotnej sestry.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. Niektoré z nich môžu byť závažné a môžu viesť k hospitalizácii pacienta.
Počas liečby Herceptinom sa môže objaviť triaška, horúčka a ďalšie príznaky podobné chrípke. Uvedené účinky sú veľmi časté (môže postihovať viac ako 1 z 10 osôb). Ďalšie príznaky sú: nevoľnosť (nauzea), vracanie, bolesť, zvýšené svalové napätie a tras, bolesť hlavy, závraty, poruchy dýchania, sipot (ťažké dýchanie), zvýšenie alebo zníženie krvného tlaku, poruchy srdcového rytmu (palpitácie, búšenie srdca alebo nepravidelný tep), opuch tváre a pier, vyrážka a pocit únavy. Niektoré z týchto príznakov môžu byť závažné, u niekoľkých pacientov došlo i k úmrtiu (pozri časť
„Upozornenia a opatrenia“).
Počas podávania a najmenej počas šiestich hodín od začiatku prvého podania a počas dvoch hodín od začiatku ďalších podaní vás bude zdravotnícky pracovník sledovať.
Niekedy sa môžu objaviť srdcové ťažkosti, a to v priebehu liečby a občas aj po ukončení liečby a
môžu byť závažné. Medzi ne patrí oslabenie srdcového svalu, ktoré môže viesť k zlyhaniu srdca, zápal (opuchnutie, sčervenanie a bolestivosť) výstelky okolo srdca a poruchy srdcového rytmu. Môže to vyvolávať také príznaky ako:
• dýchacie ťažkosti (vrátane ťažkostí, objavujúcich sa v noci)
• kašeľ
• zadržiavanie tekutín (opuchy) v nohách alebo rukách
• palpitácie (búšenie srdca alebo nepravidelný tep).
Lekár vám bude počas liečby pravidelne kontrolovať srdcovú činnosť, avšak ak si všimnete niektorý z vyššie spomínaných príznakov, mali by ste mu to hneď oznámiť.
Ak budete mať niektorý z vyššie uvedených príznakov, keď ukončíte liečbu Herceptinom, navštívte svojho lekára a povedzte mu, že ste predtým boli liečený Herceptinom.
Existujú dva rôzne typy (podľa spôsobu podania) Herceptinu :
• jeden sa podáva ako infúzia do žily počas 30 až 90 minút
• druhý sa podáva ako podkožná injekcia počas 5 minút.
V klinickej štúdii porovnávajúcej tieto dve formy, sa častejšie vyskytli infekcie a srdcové príhody, ktoré viedli k hospitalizácii pri podkožnom podaní. Boli zaznamenané častejšie lokálne reakcie v mieste vpichu injekcie a vyššie zvýšenie krvného tlaku. Ďalšie vedľajšie účinky boli podobné.
Veľmi časté vedľajšie účinky Herceptinu: môže postihovať viac ako 1 z 10 osôb
• infekcie
• hnačka
• zápcha
• pálenie záhy (dyspepsia)
• slabosť
• kožná vyrážka
• bolesť na hrudi
• bolesť brucha
• bolesť kĺbov
• nízky počet červených krviniek a bielych krviniek (ktoré pomáhajú bojovať s infekciou), občas s horúčkou
• bolesť svalov
• konjunktivitída (zápal očných spojoviek)
• slzenie očí
• krvácanie z nosa
• výtok z nosa
• vypadávanie vlasov
• triaška
• návaly horúčavy
• závrat
• ochorenie nechtov
• úbytok telesnej hmotnosti
• nechutenstvo
• nespavosť (insomnia)
• zmenené vnímanie chuti
• nízky počet krvných doštičiek
• necitlivosť alebo mravčenie v prstoch na rukách a nohách
• začervenanie, opuch alebo ranky v ústach a/alebo v hrdle
• bolesť, opuch, začervenanie alebo mravčenie v prstoch na rukách a nohách
Časté vedľajšie účinky Herceptinu: môžu postihovať menej ako 1 z 10 osôb
• alergické reakcie • sucho v ústach a suchá koža
• infekcie hrdla • znížená tvorba sĺz
• infekcie močového mechúra a kože • potenie
• pásový opar • pocit slabosti a choroby
• zápal prsníka • úzkosť
• zápal podžalúdkovej žľazy alebo pečene • depresia
• poruchy obličiek • poruchy myslenia
• zvýšené svalové napätie alebo tenzia •
(hypertónia)
• bolesť v rukách a/alebo v nohách
•
• astma
• vyrážka (svrbivá) • poruchy funkcie pľúc
• • bolesť chrbta
• ospanlivosť (somnolencia)
• modriny
• hemoroidy
• svrbenie kože
• bolesť šije
• bolesť kostí
• akné
• kŕče v nohách.
Menej časté vedľajšie účinky Herceptinu: môžu postihovať menej ako 1 zo 100 osôb
• hluchota
• hrboľatá vyrážka.
Zriedkavé vedľajšie účinky Herceptinu: môžu postihovať menej ako 1 z 1 000 osôb
• slabosť
• žltačka
• zápal alebo zjazvenie pľúc.
Ďalšie vedľajšie účinky, ktoré boli hlásené pri použití Herceptinu: častosť sa nedá odhadnúť
z dostupných údajov
• nezvyčajná alebo zhoršená zrážanlivosť krvi
• anafylaktické reakcie
• vysoké hladiny draslíka
• opuch mozgu
• opuch alebo krvácanie očného pozadia
• šok
• opuch výstelky srdca
• pomalý pulz
• nepravidelnosti srdcového rytmu
• dychová tieseň
• zlyhávanie dýchania
• náhle hromadenie tekutiny v pľúcach
• náhle zúženie dýchacích ciest
• veľmi nízka hladina kyslíka v krvi
• ťažkosti s dýchaním vo vodorovnej polohe
• porucha/zlyhávanie funkcie pečene
• opuch tváre, pier a hrdla
• zlyhávanie funkcie obličiek
• nezvyčajne nízka hladina tekutiny okolo plodu v maternici
• opuch hrdla
• nedostatočný vývoj pľúc v maternici
• nedostatočný vývoj obličky v maternici
Niektoré z týchto účinkov môžu byť spôsobené nádorom prsníka. Ak dostávate Herceptin v kombinácii s chemoterapiou, niektoré môže vyvolávať chemoterapia.
Ak sa u vás vyskytne akýkoľvek vedľajší účinok obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
Hlásenie vedľajších účinkov
Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Vedľajšie účinky môžete hlásiť aj priamo prostredníctvom národného
systému hlásenia uvedeného v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu
ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať HerceptinTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na označení škatuľky a na označení aplikačného systému po EXP. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Uchovávajte v chladničke (2°C – 8°C). Neuchovávajte v mrazničke.
Aplikačný systém uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Aplikačný systém sa po vybratí z chladničky musí podať v priebehu 6 hodín a nemá sa uchovávať
pri teplote prevyšujúcej 30°C.
Nepoužívajte tento liek, ak spozorujete akékoľvek čiastočky alebo sfarbenie pred podaním.
Prítomnosť malých vzduchových bubliniek je prijateľná. Aplikačný systém sa nemá použiť, ak spadol alebo ak je viditeľne poškodený.
Aplikačný systém a batéria musia byť zlikvidované v súlade s miestnymi požiadavkami. Ak po aplikácii ihla stále vyčnieva z aplikačného systému, musí byť produkt vložený do vonkajšieho obalu, ktorý sa musí zatvoriť a zalepiť lepiacou páskou, aby sa predišlo poraneniu spôsobenému ihlou. Použitý aplikačný systém a batéria v uzavretom vonkajšom obale sa následne zlikvidujú v súlade
s miestnymi požiadavkami.. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Čo Herceptin obsahuje
• Liečivo je trastuzumab. Jeden aplikačný systém obsahuje 600 mg . trastuzumabu v 5ml.
• Ďalšie zložky sú ľudská rekombinantná hyaluronidáza (rHuPH20), L-histidín ,
L-histidíniumchlorid monohydrát, α,α-dihydrát trehalózy, L-metionín, polysorbát 20, voda na injekciu.
Ako vyzerá Herceptin a obsah balenia
Herceptin je injekčný roztok, ktorý sa dodáva v aplikačnom systéme . Aplikačný systém obsahuje
600 mg trastuzumabu v 5ml. Roztok je číry až opaleskujúci a bezfarebný až nažtlý
Každá škatuľka obsahuje jeden aplikačný systém. Aplikačný systéme je učený na jednorazové použitie.
Držiteľ rozhodnutia o registrácii
Roche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
Výrobca
Roche Pharma AG Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Nemecko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa rozhodnutia o registrácii:
België/Belgique/Belgien
N.V. Roche S.A.
Tél/Tel: +32 (0) 2 525 82 11
Lietuva
UAB “Roche Lietuva” Tel: +370 5 2546799
България
Рош България ЕООД Тел: +359 2 818 44 44
Luxembourg/Luxemburg
(Voir/siehe Belgique/Belgien)
Česká republika
Roche s. r. o.
Tel: +420 - 2 20382111
Magyarország
Roche (Magyarország) Kft. Tel: +36 - 23 446 800
Danmark
Roche a/s
Tlf: +45 - 36 39 99 99
Malta
(See United Kingdom)
Deutschland
Roche Pharma AG Tel: +49 (0) 7624 140
Nederland
Roche Nederland B.V. Tel: +31 (0) 348 438050
Eesti
Roche Eesti OÜ
Tel: + 372 - 6 177 380
Norge
Roche Norge AS
Tlf: +47 - 22 78 90 00
'
Ελλάδα
Roche (Hellas) A.E.
Τηλ: +30 210 61 66 100
Österreich
Roche Austria GmbH Tel: +43 (0) 1 27739
España
Roche Farma S.A.
Tel: +34 - 91 324 81 00
Polska
Roche Polska Sp.z o.o. Tel: +48 - 22 345 18 88
France
Roche
Tél: +33 (0)1 47 61 40 00
Portugal
Roche Farmacêutica Química, Lda
Tel: +351 - 21 425 70 00
Hrvatska
Roche d.o.o.
Tel: + 385 1 47 22 333
România
Roche România S.R.L. Tel: +40 21 206 47 01
Ireland
Roche Products (Ireland) Ltd. Tel: +353 (0) 1 469 0700
Slovenija
Roche farmacevtska družba d.o.o. Tel: +386 - 1 360 26 00
Ísland
Roche a/s
c/o Icepharma hf
Sími: +354 540 8000
Slovenská republika
Roche Slovensko, s.r.o. Tel: +421 - 2 52638201
Italia
Roche S.p.A.
Tel: +39 - 039 2471
Suomi/Finland
Roche Oy
Puh/Tel: +358 (0) 10 554 500
Kύπρος
Γ.Α.Σταμάτης & Σια Λτδ.
Τηλ: +357 - 22 76 62 76
Sverige
Roche AB
Tel: +46 (0) 8 726 1200
Latvija
Roche Latvija SIA
Tel: +371 - 67 039831
United Kingdom
Roche Products Ltd.
Tel: +44 (0) 1707 366000
Táto písomná informácia pre používateľa bola naposledy aktualizovaná v
Ďalšie zdroje informácií
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.Táto informácia pre používateľa je k dispozícii vo všetkých jazykoch EÚ/EHP na webovej stránke
Európskej agentúry pre lieky.
7. Pokyny na podanie injekcie Herceptinu pomocou aplikačného systému
Táto časť obsahuje informácie o tom, ako podať injekciu Herceptinu.
Predtým ako aplikačný systém použijete po prvýkrát, prečítajte si celú kapitolu “Pokyny na podanie injekcie Herceptinu pomocou aplikačného systému“. Po prečítaní a pochopení tejto kapitoly vykonajte všetky manipulačné kroky podľa uvedených pokynov.
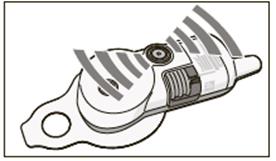
7.1 Popis aplikačného systému
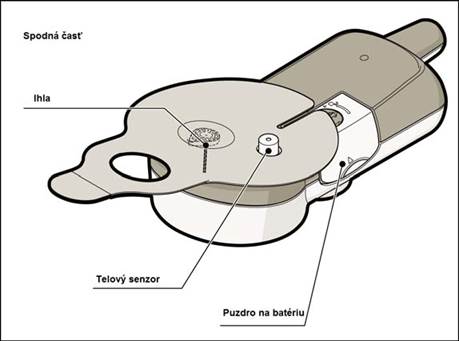 Dôležité: Nedovoľte, aby aplikačný systém prišiel do styku s vodou. Nepoužívajte ho, ak je viditeľne poškodený. Nikdy sa nepokúšajte aplikačný systém otvoriť.7.2 Ďalšie potrebné pomôcky
Dôležité: Nedovoľte, aby aplikačný systém prišiel do styku s vodou. Nepoužívajte ho, ak je viditeľne poškodený. Nikdy sa nepokúšajte aplikačný systém otvoriť.7.2 Ďalšie potrebné pomôckyPred použitím aplikačného systému budete potrebovať alkoholom napustený tampón na dezinfekciu kože v mieste podania injekcie.
7.3 Použitie aplikačného systému
7.3.1 Príprava na podanie injekcie
• Vyberte aplikačný systém z chladničky aspoň 1 hodinu pred plánovanou injekciou, aby mohol aplikačný systém dosiahnuť izbovú teplotu (18°C – 30°C). Uchovávajte ho pri teplote neprevyšujúcej 30 ºC. Keď nenecháte aplikačný systém dosiahnuť izbovú teplotu, môže to
mať za následok nepríjemnú injekciu.
Dôležité: Neuchovávajte aplikačný systém mimo chladničky dlhšie ako 6 hodín. Nevystavujte ho priamemu slnečnému žiareniu, ani ho žiadnym iným spôsobom neohrievajte (napr. vystavenie zdrojom tepla), keďže to môže znehodnotiť liek.• Dôkladne si umyte ruky mydlom a teplou vodou alebo dezinfekčným prostriedkom na ruky.
• Uistite sa, že pacient sedí v pohodlnej polohe, keďže podanie injekcie trvá asi 5 minút.
• Otvorte vonkajšiu škatuľku a vyberte aplikačný systém.
• Aplikačný systém, alkoholom napustený tampón a túto písomnú informáciu pre používateľa si položte na dosah.
7.3.2 Podanie injekcie HerceptinuPoznáma: Ak vznikne neočakávaná situácia alebo problém, prečítajte si časť 7.4.
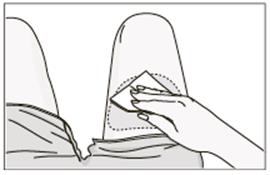
Umiestnenie aplikačného systému na stehno• Vydezinfikujte miesto podania injekcie na (prednej strane) stehna pomocou alkoholom napusteného tampónu, ako je zobrazené nižšie. Nechajte alkohol vyschnúť na koži predtým, ako aplikačný systém pripevníte na miesto. Nedotýkajte sa miesta podania injekcie po jeho vydezinfikovaní.
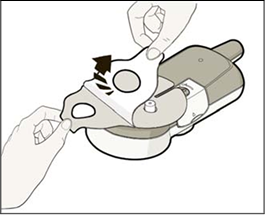
• Stiahnite podkladovú fóliu, aby ste ju oddelili od priľnavej podložky.
• Umiestnite aplikačný systém na pripravené miesto na stehne, ako je zobrazené.

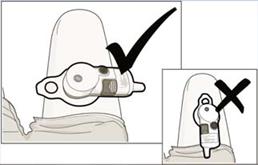
• Dôležité: Umiestnite aplikačný systém vodorovne naprieč stehnom, ako je zobrazené,
NEUMIESTNITE aplikačný systém pozdĺž stehna.
• Aplikačný systém pevne pritlačte na kožu.
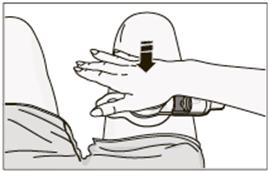
• Prejdite prstom po priľnavej podložke, aby ste sa uistili, že je dobre prilepená.
 Dôležité: Ak priľnavá podložka nie je riadne prilepená na kožu, podávanie injekcie sa nemôže začať.Injekčné podanie Herceptinu
Dôležité: Ak priľnavá podložka nie je riadne prilepená na kožu, podávanie injekcie sa nemôže začať.Injekčné podanie Herceptinu
• Stlačte modré spúšťacie tlačidlo aspoň na 5 sekúnd. Svetlo sa zmení zo zeleného na pomaly blikajúce oranžové, čo znamená, že podávanie injekcie sa začalo.

• Ihla sa vysunie s počuteľným kliknutím, po ktorom budete počuť zvuk bežiaceho motorčeka.

• Kontrolka podávania zostane oranžová a bude stále pomaly blikať počas celej doby podávania injekcie Herceptinu (približne 5 minút). Môžete kontrolovať priebeh podávania injekcie sledovaním pomalého pohybu piesta vo vnútri zásobníka.
 Dôležité: Po začatí podávania injekcie sa pacient musí vyhnúť náhlym pohybom a zaistiť, aby aplikačný systém zostal prilepený na koži. Sledujte kontrolku podávania v priebehu podávania injekcie. Ak kontrolka bliká striedavo na zeleno a na oranžovo, namiesto iba na oranžovo, ihneď si prečítajte, prosím, časť 7.4.
Dôležité: Po začatí podávania injekcie sa pacient musí vyhnúť náhlym pohybom a zaistiť, aby aplikačný systém zostal prilepený na koži. Sledujte kontrolku podávania v priebehu podávania injekcie. Ak kontrolka bliká striedavo na zeleno a na oranžovo, namiesto iba na oranžovo, ihneď si prečítajte, prosím, časť 7.4.• Zvuk motorčeka utíchne, keď bude injekcia Herceptinu úplne podaná. Ihla sa automaticky vtiahne s počuteľným kliknutím.
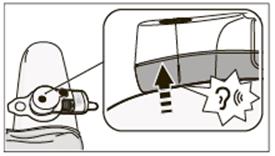
• Počkajte, kým sa kontrolka okolo spúšťacieho tlačidla nezmení na zelenú a neprestane blikať.
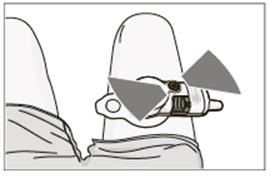
• Skontrolujte, či sa piest v zásobníku posunul úplne dopredu. Ak sa tak nestalo, prečítajte si,
prosím, časť 7.4 Možné problémy.
 Odstránenie aplikačného systému z tela
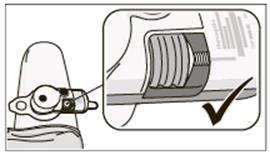
Odstránenie aplikačného systému z tela• Keď kontrolka zostane zelená a bez blikania, odstráňte aplikačný systém vložením prsta do pútka a jemným ťahom dohora.

• Keď odstránite aplikačný systém z tela, zelené svetlo začne blikať, čo znamená, že podanie injekcie bolo úspešné. Kontrolka zostane zelená a bude stále blikať, kým sa batéria nevybije alebo kým ju nevyberiete. To je normálne.
 Dôležité: Skontrolujte, či sa ihla úplne vtiahla. Ak sa tak nestalo, prečítajte si časť 7.4.7.3.3 Vybratie puzdra na batériu z použitého aplikačného systému (ak je to potrebné na likvidáciu aplikačného systému)
Dôležité: Skontrolujte, či sa ihla úplne vtiahla. Ak sa tak nestalo, prečítajte si časť 7.4.7.3.3 Vybratie puzdra na batériu z použitého aplikačného systému (ak je to potrebné na likvidáciu aplikačného systému)Ak nie je potrebné batériu vybrať, preskočte tento krok a a pokračujte časťou 7.3.4.
• Odblokujte puzdro na batériu vložením hrany mince do drážky. Otočte v smere označenom šípkou do odblokovanej polohy.
• Vyberte puzdro na batériu tak, že pritlačíte bočnú časť a posuniete ju dohora.
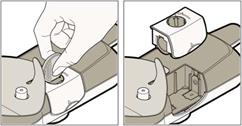
• Zlikvidujte puzdro na batériu (vrátane batérie) v súlade s miestnymi požiadavkami.
Dôležité: Nevyberajte batériu z puzdra na batériu.7.3.4 Likvidácia aplikačného systémuKeďže aplikačný systém obsahuje elektromechanické súčiastky a použitú ihlu, aplikačný systém sa nesmie likvidovať domovým odpadom. Zlikvidujte použitý aplikačný systém a batériu v súlade
s miestnymi požiadavkami.
7.4 Možné problémyAk ktorýkoľvek z problémov uvedených nižšie spôsobí podanie čiastočnej dávky alebo nepodanie dávky, ďalšie pokyny si prečítajte, prosím, v časti 3.•
Pri pokuse o začatie podávania injekcie: Po umiestnení aplikačného systému na kožu kontrolka striedavo bliká na zeleno a na oranžovo (žiaden kontakt s telom) namiesto toho, aby zostalo zelené.Aplikačný systém znovu pevne pritlačte na miesto podania injekcie. Aplikačný systém nepoužívajte, ak kontrolka naďalej striedavo bliká na zeleno a na oranžovo. Odstráňte aplikačný systém z tela tak, ako je opísané vyššie v časti 7.3.2, nelikvidujte ho a zatelefonujte miestnemu zástupcovi uvedenému v časti 6 kvôli ďalším pokynom.
•
Počas podávania injekcie: kontrolka striedavo bliká na zeleno a na oranžovo.Ak aplikačný systém nie je pevne prilepený na kožu, zvuk motorčeka utíchne, podávanie injekcie sa preruší a kontrolka bude striedavo blikať na zeleno a na oranžovo.
Aplikačný systém znovu pritlačte na kožu v priebehu 10 sekúnd a držte ho pritlačený, pokým
kontrolka nezačne pomaly blikať na oranžovo.
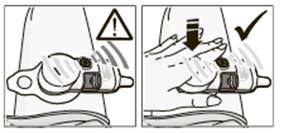
Ak aplikačný systém v priebehu 10 sekúnd znovu nepritlačíte na kožu, ihla sa vtiahne a nebudete môcť znovu spustiť aplikačný systém. Rýchlo blikajúce oranžové svetlo na kontrolke znamená, že sa vyskytla chyba. Odstráňte aplikačný systém z tela tak, ako je opísané vyššie v časti 7.3.2, nelikvidujte ho a zatelefonujte miestnemu zástupcovi uvedenému v časti 6 kvôli ďalším pokynom.
•
Počas podávania injekcie alebo po jej podaní: Kontrolka rýchlo bliká na oranžovo a aplikačný systém sa zastavil (zvuk motora stíchol).Ak sa vyskytla chyba, aplikačný systém nie je možné znovu spustiť. Odstráňte aplikačný systém
z tela tak, ako je opísané vyššie v časti 7.3.2, nelikvidujte ho a zatelefonujte miestnemu zástupcovi uvedenému v časti 6 kvôli ďalším pokynom.
•
Po podaní injekcie: Podávanie injekcie sa skončilo, ale v zásobníku stále vidíte liek, alebo sa piest v zásobníku neposunul úplne dopredu.Keď sa vyskytne táto chyba, aplikačný systém nie je možné znovu spustiť. Odstráňte aplikačný
systém z tela tak, ako je opísané vyššie v časti 7.3.2, nelikvidujte ho a zatelefonujte miestnemu zástupcovi uvedenému v časti 6 kvôli ďalším pokynom.
•
Počas podávania injekcie alebo po jej podaní: Koža je mokrá. Vidíte, že určité množstvoHerceptinu nebolo podané.Odstráňte aplikačný systém z tela tak, ako je opísané vyššie v časti 7.3.2, nelikvidujte ho a zatelefonujte miestnemu zástupcovi uvedenému v časti 6 kvôli ďalším pokynom.
•
Po ukončení podávania injekcie: Vidíte, že ihla stále vyčnieva z aplikačného systému.Aplikačný systém vložte do vonkajšieho obalu a vonkajší obal zalepte páskou, aby sa predišlo poraneniu spôsobenému ihlou, nelikvidujte ho a zatelefonujte miestnemu zástupcovi uvedenému
v časti 6 kvôli ďalším pokynom.
7.5 Vysvetlenie symbolov

 7.5.1 Symboly vytlačené na aplikačnom systéme
7.5.1 Symboly vytlačené na aplikačnom systéme Symbol
| Význam
|
| Typ modelu aplikačného systému
|
| Dodržiavajte pokyny v písomnej informácii pre používateľa uvedené v časti 7
|
| Označenie zhody so smernicou o EMC
2004/108/EC
|
| Typ batérie
|
| Trieda ochrany: odolný voči vniknutiu
pevných telies väčších ako 1 mm, ale nie vodeodolný.
|
| Použitá súčiastka typu BF (elektricky
izolovaná).
|
| Spúšťacie tlačidlo
|
7.6 Technické parametre
Usmernenie a vyhlásenie výrobcu - elektromagnetické emisie
|
Aplikačný systém je určený na použitie v elektromagnetickom prostredí špecifikovanom nižšie. Zákazník alebo používateľ aplikačného systému musí zaistiť, aby sa používal v takomto prostredí.
|
Emisný test
|
Z
hoda
|
Elektromagnetické prostredie - usmernenie
|
Rádiofrekvenčné
(RF) emisie
CISPR 11
|
Skupina 1
|
Aplikačný systém používa RF energiu len na svoje vnútorné fungovanie. Preto sú jeho RF emisie veľmi nízke a je nepravdepodobné, že by spôsobili akékoľvek rušenie elektronických zariadení nachádzajúcich sa v blízkosti.
|
RF emisie
CISPR 11
|
Trieda B
|
Aplikačný systém je vhodný na použitie
vo všetkých zariadeniach vrátane domácností.
|
Usmernenie a vyhlásenie výrobcu - elektromagnetická odolnosť
|
Aplikačný systém je určený na použitie v elektromagnetickom prostredí špecifikovanom nižšie. Zákazník alebo používateľ aplikačného systému musí zaistiť, aby sa používal v takomto prostredí.
|
Test odolnosti, štandardný
|
Úroveň testu* IEC 60601
|
Úroveň
z
hody
|
Elektromagnetické prostredie - usmernenie
|
Elektrostatický výboj (ESD)
IEC 61000-4-2
|
±6 kV kontakt
±8 kV vzduch
|
±8 kV kontakt
±15 kV vzduch
|
Podlahy by mali byť z dreva, betónu alebo keramických dlaždíc. Ak sú podlahy pokryté syntetickým materiálom, relatívna vlhkosť by mala byť aspoň 30 %.
|
Poznámka: UT je striedavé (a.c.) sieťové napätie pred aplikáciu úrovne testu.
|
Magnetické pole sieťovej frekvencie (50/60 Hz)
IEC 61000-4-8
|
3 A/m
|
400 A/m
|
Magnetické polia sieťovej frekvencie by mali byť na úrovniach charakteristických pre typické miesto v typickom komerčnom alebo nemocničnom prostredí.
|

Usmernenie a vyhlásenie výrobcu - elektromagnetická odolnosť
|
Aplikačný systém je určený na použitie v elektromagnetickom prostredí špecifikovanom nižšie. Zákazník alebo používateľ aplikačného systému musí zaistiť, aby sa používal v takomto prostredí.
|
Elektromagnetické prostredie - usmernenie
|
Prenosné a mobilné RF komunikačné zariadenia sa nesmú používať v menšej vzdialenosti od akejkoľvek súčasti aplikačného systému, vrátane káblov, ako je odporúčaná vzdialenosť odstupu vypočítaná na základe rovnice platnej pre frekvenciu vysielača.
|
Test odolnosti, štandardný
|
Úroveň testu
IEC 60601
|
Úroveň
z
hody
|
Odporúčaná vzdialenosť odstupuc
|
RF šírená vedením
IEC 61000-4-6
|
3 Vrms
150 kHz až 80 MHz
|
Neaplikovateľné
|
d = 1,2 P 150 kHz až 80 MHz
|
Vyžarovaná RF
IEC 61000-4-3
|
3 V/m
80 MHz až 800 MHz
|
E1 = 3 V/m
80 MHz až 800 MHz
|
d = 1,2 P 80 MHz až 800 MHz
|
Vyžarovaná RF
IEC 61000-4-3
|
3 V/m
800 MHz až 2,5 GHz
|
E2 = 3 V/m
800 MHz až 2,7 GHz
|
d = 2,3 P 800 MHz až 2,7 GHz
|
Kde P je hodnota maximálneho výstupného výkonu vysielača vo wattoch (W) udávaná výrobcom vysielača a d je odporúčaná vzdialenosť odstupu v metroch (m).
Intenzita poľa pevných RF vysielačov, určená pomocou elektromagnetického prieskumu lokality, a
by mala byť v každom frekvenčnom rozsahu nižšia ako úroveň zhody. b
|
Rušenie sa môže vyskytnúť v blízkosti zariadenia označeného nasledujúcim symbolom:
|
Poznámka 1: Pri 80 MHz a 800 MHz platí vyšší frekvenčný rozsah.
Poznámka 2: Tieto odporúčania nemusia platiť vo všetkých situáciách. Šírenie elektromagnetických vĺn je ovplyvňované ich pohlcovaním budovami, predmetmi a osobami a ich odrazom od nich.
|
a Intenzitu poľa pevných vysielačov, akými sú napríklad základné stanice pre rádiotelefóny (mobilné/bezdrôtové) a rádiovysielačky, rádioamatérske vysielače, rozhlasové vysielanie na vlnách AM a FM a televízne vysielanie, nie je možné teoreticky presne predpovedať. Na posúdenie elektromagnetického prostredia z dôvodu prítomnosti pevných RF vysielačov sa má zvážiť elektromagnetický prieskum lokality. Ak nameraná intenzita poľa v lokalite, kde sa aplikačný systém používa, presahuje príslušnú uvedenú úroveň zhody RF, aplikačný systém treba pozorovať, aby sa
overilo, či správne funguje. Ak sa pri jeho fungovaní zaznamenajú poruchy, môžu byť potrebné ďalšie opatrenia, ako napríklad zmena orientácie alebo polohy aplikačného systému obsahujúceho tento liek.
b Pri frekvenčnom rozsahu vyššom ako 150 kHz až 80 MHz má byť intenzita poľa nižšia ako 3 V/m.
c Prípadné kratšie vzdialenosti mimo pásiem ISM (priemyselných, vedeckých a zdravotníckych zariadení)
sa nepovažujú za lepšie aplikovateľné pri tejto tabuľke.
|


Odporúčané vzdialenosti odstupu medzi prenosnými a mobilnými RF komunikačnými zariadeniami a aplikačným systémom
|
Aplikačný systém je určený na použitie v elektromagnetickom prostredí, v ktorom sú vyžarované RF rušenia udržiavané pod kontrolou. Zákazník alebo používateľ aplikačného systému môže pomôcť predísť výskytu elektromagnetického rušenia dodržiavaním minimálnej vzdialenosti medzi prenosnými a mobilnými RF komunikačnými zariadeniami (vysielačmi) a aplikačným systémom, ako je odporúčané nižšie, podľa maximálneho výstupného výkonu komunikačného zariadenia.
|
Hodnota maximálneho výstupného výkonu vysielača
W
|
Vzdialenosť odstupu podľa frekvencie vysielača
|
150 kHz až 80 MHz
d = 1,2 P
|
80 MHz až 800 MHz
d = 1,2 P
|
800 MHz až 2,5 GHz
d = 2,3 P
|
0,01
|
12 cm
|
12 cm
|
23 cm
|
0,1
|
38 cm
|
38 cm
|
73 cm
|
1
|
1,2 m
|
1,2 m
|
2,3 m
|
10
|
3,8 m
|
3,8 m
|
7,3 m
|
100
|
12 m
|
12 m
|
23 m
|
Pri vysielačoch, ktorých hodnota maximálneho výstupného výkonu nie je uvedená vyššie, sa odporúčaná vzdialenosť odstupu d v metroch (m) dá odhadnúť pomocou rovnice na výpočet frekvencie vysielača, kde P je hodnota maximálneho výstupného výkonu vysielača vo wattoch (W) udávaná výrobcom vysielača.
|
Poznámka 1: Pri 80 MHz a 800 MHz platí vzdialenosť odstupu pre vyšší frekvenčný rozsah.
Poznámka 2: Tieto odporúčania nemusia platiť vo všetkých situáciách. Šírenie elektromagnetických vĺn je ovplyvňované ich pohlcovaním budovami, predmetmi a osobami a ich odrazom od nich.
Poznámka 3: Pri výpočte odporúčanej vzdialenosti odstupu sa používa doplnkový faktor 10/3, aby sa znížila pravdepodobnosť, že mobilné/prenosné komunikačné zariadenia by mohli zapríčiniť rušenie, keby sa neúmyselne priniesli do miest starostlivosti o pacientov.
|