
a urobiť patričné klinické opatrenia a sledovanie má pokračovať až do vymiznutia symptómov. Pokiaľ je počas sledovania po podaní prvej dávky potrebná u pacienta farmakologická intervencia, je potrebné zaistiť nočné sledovanie v zdravotníckom zariadení a sledovanie ako pri prvej dávke sa má zopakovať po druhej dávke Gilenye.
Pokiaľ je hodnota srdcovej frekvencie najnižšia po 6 hodinách od podania lieku (čo môže naznačovať, že maximálny farmakodynamický účinok na srdce sa ešte neprejavil), sledovanie sa má predĺžiť aspoň o 2 hodiny a až do opätovného zvýšenia srdcovej frekvencie. Okrem toho, ak je po 6 hodinách
hodnota srdcovej frekvencie <45 bpm u dospelých, <55 bpm u pediatrických pacientov vo veku
12 rokov a starších, alebo <60 bpm u pediatrických pacientov vo veku od 10 do menej ako 12 rokov, alebo ak EKG vykazuje novovzniknutú átrioventrikulárnu blokádu druhého alebo vyššieho stupňa alebo ak vykazuje hodnotu QTc intervalu ≥500 msek, sledovanie sa má predĺžiť (aspoň cez noc), až pokiaľ sa nález neupraví. Výskyt átrioventrikulárnej blokády tretieho stupňa v ktoromkoľvek čase je tiež dôvodom na predĺžené sledovanie (aspoň cez noc).
U dospelých pacientov liečených fingolimodom boli hlásené veľmi zriedkavé prípady inverzie vlny T. V prípade inverzie vlny T sa má predpisujúci lekár uistiť, že nie sú prítomné žiadne súvisiace prejavy alebo príznaky ischémie myokardu. Pri podozrení na ischémiu myokardu sa odporúča konzultácia
s kardiológom.
Z dôvodu rizika závažných porúch rytmu alebo závažnej bradykardie sa Gilenya nemá používať
u pacientov so sinoatriálnym srdcovým blokom, anamnézou symptomatickej bradykardie, opakovanej synkopy alebo zastavenia srdca, alebo u pacientov s výrazným predĺžením QT (QTc > 470 ms
[dospelé pacientky], QTc >460 ms [pediatrické pacientky] alebo > 450 ms [dospelí a pediatrickí pacienti mužského pohlavia]), nekontrolovanou hypertenziou alebo závažným spánkovým apnoe (pozri aj časť 4.3). U týchto pacientov je možné zvážiť liečbu Gilenyou, iba ak očakávaný prínos preváži možné riziká, a pred začatím liečby je potrebná konzultácia s kardiológom na stanovenie
adekvátneho sledovania. Pri začatí liečby sa odporúča aspoň predĺžené sledovanie počas noci (pozri aj časť 4.5).
Gilenya sa neskúšala u pacientov s arytmiami vyžadujúcimi liečbu antiarytmikami triedy Ia (napr. chinidín, dizopyramid) alebo triedy III (napr. amiodarón, sotalol). Antiarytmiká triedy Ia a triedy III sa u pacientov s bradykardiou dávali do súvislosti s prípadmi torsade de pointes (pozri časť 4.3).
Skúsenosti s používaním Gilenye sú obmedzené u pacientov užívajúcich súčasne liečbu betablokátormi, blokátormi kalciového kanála, ktoré znižujú srdcovú frekvenciu (ako napr. verapamil alebo diltiazem) alebo inými liečivami, ktoré môžu znižovať srdcovú frekvenciu (napr. ivabradín, digoxín, inhibítory cholínesterázy alebo pilokarpín). Keďže začatie liečby Gilenyou je spojené aj so spomalením srdcovej frekvencie (pozri časť 4.8, Bradyarytmia), súčasná liečba týmito liekmi počas začatia liečby Gilenyou môže byť spojená so závažnou bradykardiou a blokádou srdca. U pacientov súbežne liečených týmito liekmi liečba Gilenyou sa nemá začať z dôvodu možného aditívneho účinku na srdcovú frekvenciu (pozri časť 4.5). U týchto pacientov sa má zvážiť liečba Gilenyou, iba ak očakávaný prínos preváži možné riziká. Ak sa uvažuje o začatí liečby Gilenyou, je potrebná pred začatím liečby konzultácia s kardiológom kvôli prechodu na lieky, ktoré neznižujú srdcovú frekvenciu. Pokiaľ nie je možné ukončiť podávanie liekov znižujúcich srdcovú frekvenciu, je
potrebná pre stanovenie adekvátneho sledovania po prvej dávke konzultácia s kardiológom,
prinajmenšom sa odporúča predĺžené sledovanie aj počas noci (pozri aj časť 4.5).
Účinky na srdcovú frekvenciu a átrioventrikulárne vedenie sa môžu pri opätovnom podaní Gilenye zopakovať v závislosti od toho, koľko trvá prerušenie podávania a koľko času uplynulo od začatia liečby Gilenyou. Rovnaké sledovanie pri prvej dávke ako pri začatí liečby sa odporúča, keď sa podávanie preruší na:
· 1 deň alebo viac počas prvých 2 týždňov liečby.
· viac ako 7 dní počas 3. a 4. týždňa liečby.
· viac ako 2 týždne po jednom mesiaci liečby.
Ak prerušenie liečby trvá kratšie, ako sa uvádza vyššie, v liečbe sa má pokračovať nasledujúcou
plánovanou dávkou.
Interval QT
V podrobnej štúdii preskúmania intervalu QT pri dávkach 1,25 a 2,5 mg fingolimodu v rovnovážnom
stave, keď bol ešte prítomný negatívny chronotropný účinok fingolimodu, podávanie fingolimodu spôsobilo predĺženie QTcI pri hornej hranici 90 % IS ≤13,0 ms. Pri fingolimode nie je žiadny vzťah medzi dávkou alebo expozíciou a odpoveďou vzhľadom na predĺženie QTcI. V súvislosti s liečbou fingolimodom nie je žiadny jednotný signál zvýšenej incidencie odľahlých hodnôt QTcI, buď absolútnych, alebo ako zmena oproti východiskovej hodnote.
Klinická významnosť týchto nálezov nie je známa. V štúdiách pri sclerosis multiplex sa nepozorovali klinicky významné účinky na predĺženie intervalu QTc, ale pacienti s rizikom predĺženia QT neboli zaradení do klinických štúdií.
Lieky, ktoré môžu predĺžiť interval QTc, je lepšie nepodávať pacientom s významnými rizikovými faktormi, napr. hypokaliémiou alebo vrodeným predĺžením QT.
Imunosupresívne účinky
Fingolimod má imunosupresívny účinok, ktorý predisponuje pacientov na riziko infekcie, vrátane
oportúnnych infekcií, ktoré môžu byť smrteľné a zvyšuje riziko rozvoja lymfómov a iných malignít, predovšetkým malignít kože. Lekári majú pacientov starostlivo sledovať, najmä tých, ktorí zároveň majú iné ochorenia alebo sú u nich prítomné známe faktory, ako napríklad predchádzajúca imunosupresívna liečba. Ak je podozrenie na toto riziko, lekár má v individuálnych prípadoch zvážiť ukončenie liečby (pozri časť 4.4 „Infekcie“ a „Kožné nádory“ a časť 4.8 „Lymfómy).
Infekcie
Základným farmakodynamickým účinkom Gilenye je od dávky závislé zníženie počtu periférnych
lymfocytov na 20-30 % východiskových hodnôt. Je to dôsledok reverzibilnej sekvestrácie lymfocytov v lymfatických tkanivách (pozri časť 5.1).
Pred začatím liečby Gilenyou majú byť k dispozícii nedávne (t.j. z predchádzajúcich 6 mesiacov alebo po skončení predchádzajúcej liečby) hodnoty úplného krvného obrazu (CBC). Hodnotenie CBC sa odporúča aj pravidelne počas liečby, a to po treťom mesiaci a neskôr najmenej raz za rok, a v prípade prejavov infekcie. Absolútny počet lymfocytov <0,2x109/l, ak sa potvrdí, má mať za následok prerušenie liečby až do zotavenia, pretože v klinických skúšaniach sa liečba fingolimodom prerušila
u pacientov s absolútnym počtom lymfocytov <0,2x109/l.
Začatie liečby Gilenyou sa má odložiť u pacientov so závažnou aktívnou infekciou až do jej
vymiznutia.
Pred liečbou Gilenyou je potrebné u pacientov stanoviť imunitu proti varicele (ovčím kiahňam).
U pacientov, ktorí nemajú ovčie kiahne v anamnéze potvrdené zdravotníckym pracovníkom alebo dokumentovaný úplný cyklus očkovania vakcínou proti varicele, sa pred začatím liečby Gilenyou odporúča urobiť test na protilátky proti vírusu varicella zoster (VZV). U pacientov bez protilátok sa odporúča úplný cyklus očkovania vakcínou proti varicele pred začatím liečby Gilenyou (pozri
časť 4.8). Začiatok liečby Gilenyou sa má odložiť o 1 mesiac, aby sa umožnilo dosiahnutie plného účinku vakcinácie.
Účinky Gilenye na imunitný systém môžu zvýšiť riziko infekcií, vrátane oportúnnych infekcií (pozri
časť 4.8). U pacientov so symptómami infekcie počas liečby sa majú použiť účinné diagnostické
a terapeutické postupy. Pri hodnotení stavu pacienta, u ktorého je podozrenie na infekciu, ktorá môže byť závažná, sa má zvážiť odoslanie pacienta k lekárovi so skúsenosťami s liečbou infekcií. Pacientov užívajúcich Gilenyu je potrebné poučiť, aby počas liečby okamžite hlásili symptómy infekcie svojmu lekárovi.
Ak sa u pacienta vyvinie závažná infekcia, je potrebné zvážiť prerušenie liečby Gilenyou a pred jej
opätovným začatím sa má prehodnotiť jej prínos a riziká.
Prípady kryptokokovej meningitídy (hubová infekcia), niekedy smrteľnej, boli hlásené pri používaní lieku po jeho uvedení na trh po približne 2-3 rokoch liečby, hoci presný vzťah s trvaním liečby nie je známy (pozri časť 4.8). U pacientov s príznakmi a prejavmi zodpovedajúcimi kryptokokovej meningitíde (napr. bolesťou hlavy sprevádzanou zmenami duševného stavu, ako je zmätenosť, halucinácie a/alebo zmeny osobnosti) je potrebné ihneď stanoviť diagnózu. Ak sa diagnostikuje kryptokoková meningitída, fingolimod sa musí vysadiť a má sa začať s vhodnou liečbou. Ak je opätovné začatie liečby fingolimodom odôvodnené, je potrebná multidisciplinárna konzultácia (t.j.
s odborníkom na infekčné choroby).
Progresívna multifokálna leukoencefalopatia (PML) bola hlásená počas liečby fingolimodom od zaregistrovania lieku (pozri časť 4.8). PML je oportúnna infekcia vyvolaná vírusom Johna Cunninghama (JCV), ktorá môže byť fatálna alebo môže spôsobiť závažné postihnutie. Prípady PML sa vyskytli po približne 2-3 rokoch podávania ako monoterapie bez predchádzajúcej expozície natalizumabu, hoci presný vzťah s trvaním liečby nie je známy. Ďalšie prípady PML sa vyskytli
u pacientov, ktorí sa predtým liečili natalizumabom, ktorý má známu súvislosť s PML. PML sa môže vyskytnúť len v prítomnosti infekcie JCV. Pri testovaní na JCV je potrebné vziať do úvahy, že vplyv lymfopénie na presnosť testovania na protilátky proti JCV sa neskúmal u pacientov liečených fingolimodom. Treba tiež spomenúť, že negatívny výsledok testu na protilátky proti JCV nevylučuje možnosť neskoršej infekcie JCV. Pred začatím liečby fingolimodom má byť k dispozícii referenčné východiskové MRI (zvyčajne z predošlých 3 mesiacov). Pri rutinnom MRI (v súlade s národnými
a miestnymi odporúčaniami) majú lekári venovať pozornosť léziám naznačujúcim PML. MRI možno považovať za súčasť zvýšenej ostražitosti u pacientov, u ktorých sa predpokladá zvýšené riziko PML.
Pri podozrení na PML sa má okamžite vykonať vyšetrenie MRI na diagnostické účely a liečba fingolimodom sa má prerušiť až do vylúčenia PML.
Infekcia ľudským papilomavírusom (HPV), vrátane papilómu, dysplázie, bradavíc a rakoviny súvisiacej s HPV, bola hlásená počas liečby fingolimodom po jeho uvedení na trh. Vzhľadom na imunosupresívne vlastnosti fingolimodu sa má zvážiť vakcinácia proti HPV pred začatím liečby fingolimodom, pri čom sa majú zohľadniť odporúčania pre vakcináciu. Skríning rakoviny, vrátane Pap testu, sa odporúča ako pri štandardnej starostlivosti.
Eliminácia fingolimodu po skončení liečby môže trvať až dva mesiace, preto je potrebné počas tohto obdobia naďalej venovať pozornosť infekciám. Pacientov je potrebné poučiť, aby hlásili symptómy infekcie počas 2 mesiacov od vysadenia fingolimodu.
Makulárny edém
Makulárny edém so symptómami súvisiacimi so zrakom alebo bez nich bol hlásený u 0,5 % pacientov
liečených 0,5 mg fingolimodu a vyskytoval sa prevažne počas prvých 3-4 mesiacov liečby (pozri časť 4.8). Preto sa odporúča vykonať oftalmologické vyšetrenie po 3-4 mesiacoch od začatia liečby. Ak pacienti hlásia poruchy zraku kedykoľvek v priebehu liečby, je potrebné vyšetriť očné pozadie vrátane makuly.
U pacientov s uveitídou v anamnéze a u pacientov, ktorí majú diabetes mellitus, je zvýšené riziko makulárneho edému (pozri časť 4.8). Gilenya sa neskúšala u pacientov so sclerosis multiplex, ktorí majú súčasne diabetes mellitus. U pacientov, ktorí majú sclerosis multiplex a súčasne diabetes mellitus alebo uveitídu v anamnéze, sa odporúča oftalmologické vyšetrenie pred začatím liečby
a následné vyšetrenia počas liečby.
Pokračovanie v liečbe Gilenyou u pacientov s makulárnym edémom sa nehodnotilo. Odporúča sa vysadiť Gilenyu, ak u pacienta vznikne makulárny edém. Pri rozhodovaní o tom, či sa liečba Gilenyou má alebo nemá znovu začať po ústupe makulárneho edému, je potrebné zohľadniť potenciálny prínos
a riziká u individuálneho pacienta.
Funkcia pečene
U pacientov so sclerosis multiplex liečených Gilenyou sa zaznamenali zvýšené pečeňové enzýmy,
najmä alanínaminotransferáza (ALT), ale aj gamaglutamyltransferáza (GGT)
a aspartátaminotransferáza (AST). V klinických skúšaniach sa zvýšenie ALT na 3-násobok hornej hranice normálnych hodnôt (ULN) alebo viac vyskytlo u 8,0 % dospelých pacientov liečených 0,5 mg fingolimodu v porovnaní s 1,9 % pacientov, ktorí dostávali placebo. Zvýšenie na 5-násobok ULN sa vyskytlo u 1,8 % pacientov pri fingolimode a 0,9 % pacientov pri placebe. V klinických skúšaniach sa fingolimod vysadil, ak zvýšenie prekročilo 5-násobok ULN. Zvýšenie aminotransferáz pečene sa znovu vyskytlo pri opätovnom podaní niektorým pacientom, čo potvrdzuje súvislosť s fingolimodom. V klinických skúšaniach sa zvýšenie aminotransferáz vyskytlo kedykoľvek počas liečby, hoci väčšina
prípadov sa vyskytla počas prvých 12 mesiacov. Hladiny aminotransferáz v sére sa vrátili na normálne
hodnoty približne do 2 mesiacov od vysadenia fingolimodu.
Gilenya sa neskúšala u pacientov s už prítomnou závažnou poruchou funkcie pečene (trieda C podľa
Childa-Pugha) a u týchto pacientov sa nemá používať (pozri časť 4.3).
Pre imunosupresívne vlastnosti fingolimodu sa má začiatok liečby odložiť u pacientov s aktívnou
vírusovou hepatitídou až do jej vymiznutia.
Pred začatím liečby Gilenyou majú byť k dispozícii nedávne (t.j. z predchádzajúcich 6 mesiacov) hladiny aminotransferáz a bilirubínu. Ak nie sú prítomné klinické symptómy, pečeňové aminotransferázy sa majú skontrolovať po 1., 3., 6., 9. a 12. mesiaci liečby a neskôr v pravidelných intervaloch. Ak sa pečeňové aminotransferázy zvýšia nad 5-násobok ULN, má sa začať s častejšími kontrolami vrátane stanovení sérového bilirubínu a alkalickej fosfatázy (ALP). Pri opakovanom potvrdení hodnôt pečeňových aminotransferáz vyšších ako 5-násobok ULN sa liečba Gilenyou má prerušiť a znovu začať, až keď sa pečeňové aminotransferázy vrátia na normálne hodnoty.
U pacientov, u ktorých sa objavia symptómy naznačujúce dysfunkciu pečene, napr. nevysvetlená nauzea, vracanie, bolesť brucha, únava, nechutenstvo alebo žltačka a/alebo tmavý moč, je potrebné skontrolovať pečeňové enzýmy a ak sa potvrdí významná porucha funkcie pečene (napr. hladina aminotransferáz pečene vyššia ako 5-násobok ULN a/alebo zvýšenie bilirubínu v sére), Gilenya sa má vysadiť. Opätovné začatie liečby bude závisieť od toho, či sa určí alebo neurčí iná príčina poruchy funkcie pečene a od prínosu, ktorý pre pacienta predstavuje pokračovanie liečby v porovnaní
s rizikami opakovania dysfunkcie pečene.
Hoci žiadne údaje nepotvrdzujú, že u pacientov s už prítomným ochorením pečene je zvýšené riziko výskytu zvýšených testov funkcie pečene, keď užívajú Gilenyu, pri použití Gilenye u pacientov s významným ochorením pečene v anamnéze je potrebná opatrnosť.
Interferencia so sérologickým testovaním
Keďže fingolimod znižuje počet lymfocytov v krvi redistribúciou v sekundárnych lymfatických
orgánoch, u pacientov liečených Gilenyou sa počty lymfocytov v periférnej krvi nemôžu použiť na vyhodnotenie stavu podskupín lymfocytov. Laboratórne testy, na ktorých sa podieľajú cirkulujúce mononukleárne bunky, vyžadujú pre znížený počet cirkulujúcich lymfocytov väčšie objemy krvi.
Účinky na tlakkrvi
Pacienti, ktorých hypertenziu neznížili lieky, boli vylúčení z účasti na klinických skúšaniach pred
uvedením lieku na trh a osobitná starostlivosť je potrebná, ak sa Gilenyou liečia pacienti s
nezvládnutou hypertenziou.
V klinických skúšaniach pri SM sa pacientom liečeným 0,5 mg fingolimodu v priemere zvýšil systolický tlak približne o 3 mmHg a diastolický tlak približne o 1 mmHg, čo sa prvý raz zistilo približne 1 mesiac po začatí liečby a pretrvávalo pri pokračujúcej liečbe. V štúdii kontrolovanej placebom trvajúcej 2 roky sa hypertenzia zaznamenala ako nežiaduca udalosť u 6,5 % pacientov pri
0,5 mg fingolimodu a u 3,3 % pacientov pri placebe. Krvný tlak sa má preto pravidelne kontrolovať počas liečby Gilenyou.
Účinky na dýchanie
Pri liečbe Gilenyou sa pozoroval malý, od dávky závislý pokles hodnôt úsilného výdychového objemu
(FEV1) a difúznej kapacity pre oxid uhoľnatý (DLCO), ktorý sa začal v 1. mesiaci a potom zostal stabilný. Gilenya sa má používať opatrne u pacientov so závažným ochorením dýchacej sústavy, pľúcnou fibrózou a chronickou obštrukčnou chorobou pľúc (pozri aj časť 4.8).
Syndróm reverzibilnej posteriórnej encefalopatie
Zriedkavé prípady syndrómu reverzibilnej posteriórnej encefalopatie (PRES) sa zaznamenali pri
dávke 0,5 mg v klinických skúšaniach a po uvedení lieku na trh (pozri časť 4.8). Hlásené symptómy zahŕňali náhly nástup silnej bolesti hlavy, nauzey, vracania, zmeneného duševného stavu, porúch videnia a kŕčov. Symptómy PRES sú obvykle reverzibilné, ale môžu sa vyvinúť do ischemickej mozgovej príhody alebo krvácania do mozgu. Oneskorenie stanovenia diagnózy a liečby môže viesť k trvalým neurologickým následkom. Pri podozrení na PRES sa má Gilenya vysadiť.
Predchádzajúce podanie imunosupresívnej alebo imunomodulačnejliečby
Klinické skúšania na vyhodnotenie účinnosti a bezpečnosti Gilenye pri zmene liečby pacientov z
teriflunomidu, dimetylfumarátu alebo alemtuzumabu na Gilenyu sa nevykonali. Pri prechode pacientov z inej liečby modifikujúcej ochorenie na Gilenyu sa musí vziať do úvahy polčas a spôsob účinku tejto inej liečby, aby sa zabránilo aditívnemu účinku na imunitu a súčasne sa minimalizovalo riziko reaktivácie ochorenia. Pred začatím podávania Gilenye sa odporúča CBC, aby sa overilo, že vymizli účinky predchádzajúcej liečby na imunitu (t.j. cytopénia).
Gilenyu možno spravidla začať podávať ihneď po vysadení interferónu alebo glatirameracetátu.
Pri dimetylfumaráte má byť doba vyplavenia dostatočná na zotavenie CBC pred začatím liečby
Gilenyou.
Vzhľadom na dlhý polčas natalizumabu trvá eliminácia zvyčajne až 2-3 mesiace po jeho vysadení. Teriflunomid sa eliminuje z plazmy tiež pomaly. Bez zrýchleného procesu eliminácie môže klírens teriflunomidu z plazmy trvať niekoľko mesiacov až 2 roky. Odporúča sa zrýchlený proces eliminácie teriflunomidu, ako je definovaný v jeho súhrne charakteristických vlastností lieku, alternatívou je doba vyplavenia, ktorá nemá byť kratšia ako 3,5 mesiaca. Vzhľadom na možné súbežné účinky na imunitu sa pri zmene liečby pacientov z natalizumabu alebo teriflunomidu na Gilenyu vyžaduje opatrnosť.
Alemtuzumab má silné a dlhodobé imunosupresívne účinky. Keďže skutočné trvanie týchto účinkov nie je známe, začať liečbou Gilenyou po alemtuzumabe sa neodporúča, pokiaľ prínos takejto liečby nie je jednoznačne väčší ako riziká pre jednotlivého pacienta.
Rozhodnutie podať dlhodobú súbežnú liečbu kortikosteroidmi sa má starostlivo zvážiť. Súbežnépodávanieso silnými induktormi CYP450
Kombinácia fingolimodu so silnými induktormi CYP450 sa má používať opatrne. Súbežné používanie
s ľubovníkom bodkovaným sa neodporúča (pozri časť 4.5).
Kožné nádory
U pacientov, ktorí dostávali Gilenyu, sa zaznamenal bazocelulárny karcinóm (BCC) a iné kožné
nádory, vrátane malígneho melanómu, spinocelulárneho karcinómu, Kaposiho sarkómu a karcinómu z Merkelových buniek (pozri časť 4.8). Je potrebné venovať pozornosť kožným léziám a odporúča sa vyšetrenie kože na začiatku liečby a potom každých 6 až 12 mesiacov na základe klinického zváženia. Pri zistení podozrivých lézií sa má pacient odporučiť na vyšetrenie dermatológom.
Keďže existuje potenciálne riziko rastu kožných malignít, pacientov liečených fingolimodom treba poučiť, aby sa nevystavovali slnečnému žiareniu bez ochrany. Títo pacienti sa nemajú súbežne liečiť fototerapiou UVB-žiarením ani PUVA-fotochemoterapiou.
Návrat aktivity ochorenia („rebound“)
Po uvedení lieku na trh sa zriedkavo u niektorých pacientov, ktorí ukončili liečbu fingolimodom,
vyskytlo závažné zhoršenie ochorenia. Do úvahy treba vziať možnosť rekurencie výnimočne vysokej
aktivity ochorenia (pozri nižšie „Ukončenie liečby“).
U
k
ončenie liečby
Keď sa rozhodne o ukončení liečby Gilenyou, je potrebné obdobie 6 týždňov bez liečby, aby
fingolimod vzhľadom na svoj polčas eliminoval z obehu (pozri časť 5.2). U väčšiny pacientov sa počty lymfocytov postupne vrátia do normálneho rozmedzia za 1-2 mesiace od ukončenia liečby
(pozri časť 5.1), u niektorých pacientov však môže trvať úplne zotavenie výrazne dlhšie. Začatie iných druhov liečby počas tohto obdobia bude mať za následok súbežnú expozíciu fingolimodu. Použitie imunosupresív krátko po vysadení Gilenye môže viesť k aditívnemu účinku na imunitný systém, preto je potrebná opatrnosť.
Kvôli riziku opätovného návratu ochorenia sa pri ukončení liečby fingolimodom odporúča opatrnosť (pozri „Návrat aktivity ochorenia („rebound“)“ vyššie). Ak je ukončenie liečby Gilenyou považované za nevyhnutné, pacientov je v tom čase potrebné sledovať na relevantné príznaky možného návratu ochorenia.
Pediatrická populácia
Profil bezpečnosti u pediatrických pacientov je podobný ako u dospelých a upozornenia
a bezpečnostné opatrenia pre dospelých preto platia aj pre pediatrických pacientov.
Pri predpisovaní Gilenye pediatrickým pacientom je potrebné pamätať najmä na nasledovné:
· V čase prvej dávky sa majú dodržiavať bezpečnostné opatrenia (pozri vyššie „Bradyarytmia“).
Rovnaké bezpečnostné opatrenia ako pri prvej dávke sa odporúčajú, keď sa pacientom zmení
denná dávka z 0,25 mg na 0,5 mg.
· V kontrolovanom pediatrickom klinickom skúšaní D2311 boli hlásené prípady epileptických záchvatov, úzkosti, depresívnej nálady a depresie s vyššou incidenciou u pacientov liečených fingolimodom v porovnaní s pacientmi liečenými interferónom beta-1a. U tejto podskupiny
populácie sa vyžaduje opatrnosť (pozri „Pediatrická populácia“ v časti 4.8).
· Ojedinelé mierne zvýšenia bilirubínu sa zaznamenali u pediatrických pacientov liečených
Gilenyou.
· Odporúča sa, aby sa u pediatrických pacientov pred začatím liečby Gilenyou ukončili všetky očkovania v súlade s platnými smernicami o imunizácii (pozri vyššie „Infekcie“).
· Dostupné sú veľmi obmedzené údaje u detí vo veku 10–12 rokov, s hmotnosťou nižšou ako
40 kg alebo s hodnotou <2 na stupnici podľa Tannera (pozri časti 4.8 a 5.1). Vzhľadom na veľmi obmedzené poznatky dostupné z klinickej štúdie sa u týchto podskupín vyžaduje opatrnosť.
· Údaje o dlhodobej bezpečnosti u pediatrickej populácie nie sú dostupné.
4.5 Liekové a iné interakcie
Cytostatická, imunomodulačná alebo imunosupresívna liečba
Cytostatická, imunomodulačná alebo imunosupresívna liečba sa nemá podávať súbežne pre riziko
aditívnych účinkov na imunitný systém (pozri časti 4.3 a 4.4).
Opatrne je tiež potrebné postupovať pri zmene liečby pacientov dlhodobo pôsobiacimi liekmi
s účinkom na imunitný systém, napr. natalizumabom, teriflunomidom alebo mitoxantrónom (pozri časť 4.4). V klinických štúdiách pri sclerosis multiplex sa súbežná liečba relapsov krátkym cyklom kortikosteroidov nespájala so zvýšeným výskytom infekcií.
Vakcinácia
Počas liečby Gilenyou a do dvoch mesiacov od jej ukončenia môže byť vakcinácia menej účinná.
Použitie živých oslabených vakcín môže sprevádzať riziko infekcií, preto je potrebné sa mu vyhnúť
(pozri časti 4.4 a 4.8).
Látky vyvolávajúce bradykardiu
Fingolimod sa sledoval v kombinácii s atenololom a diltiazemom. Pri podávaní fingolimodu
s atenololom v štúdii interakcií u zdravých dobrovoľníkov sa na začiatku liečby fingolimodom znížila srdcová frekvencia o ďalších 15 %, čo je účinok, ktorý sa nepozoruje pri diltiazeme. Liečba Gilenyou sa nemá začať u pacientov užívajúcich betablokátory alebo iné látky, ktoré môžu znížiť srdcovú frekvenciu, napr. antiarytmiká triedy Ia a III, blokátory kalciových kanálov (ako napr. verapamil alebo diltiazem), ivabradín, digoxín, anticholínesterázy alebo pilokarpín, z dôvodu možných aditívnych účinkov na srdcovú frekvenciu (pozri časti 4.4 a 4.8). Ak sa u takýchto pacientov uvažuje o začatí liečby Gilenyou, je potrebná konzultácia s kardiológom kvôli prechodu na lieky, ktoré neznižujú srdcovú frekvenciu alebo adekvátnemu sledovaniu pri začatí liečby, pokiaľ nie je možné ukončiť podávanie liekov znižujúcich srdcovú frekvenciu, prinajmenšom sa odporúča sledovanie aj počas
noci.
Ovplyvnenie farmakokinetiky fingolimodu inými látkami
Fingolimod sa metabolizuje najmä prostredníctvom CYP4F2. Iné enzýmy, napr. CYP3A4, sa môžu
tiež podieľať na jeho metabolizme, najmä v prípade silnej indukcie CYP3A4. Neočakáva sa vplyv silných inhibítorov transportných bielkovín na dispozíciu fingolimodu. Inhibícia CYP4F2 pri súbežnom podávaní fingolimodu s ketokonazolom spôsobila 1,7-násobné zvýšenie expozície (AUC) fingolimodu a fingolimodfosfátu. Opatrnosť je potrebná pri látkach, ktoré môžu inhibovať CYP3A4 (inhibítory proteáz, azolové antimykotiká, niektoré makrolidové zlúčeniny, napr. klaritromycín alebo telitromycín).
Súčasné podanie 600 mg karbamazepínu dvakrát denne v rovnovážnom stave a jednorazovej dávky
2 mg fingolimodu znížilo AUC fingolimodu a jeho metabolitu približne o 40 %. Iné silné induktory enzýmu CYP3A4, napr. rifampicín, fenobarbital, fenytoín, efavirenz a ľubovník bodkovaný, môžu znížiť AUC fingolimodu a jeho metabolitu minimálne v rovnakej miere. Keďže sa tým môže prípadne zhoršiť účinnosť, pri ich súbežnom podávaní je potrebná opatrnosť. Súbežné podávanie s ľubovníkom bodkovaným sa však neodporúča (pozri časť 4.4).
Ovplyvnenie farmakokinetiky iných látok fingolimodom
Fingolimod pravdepodobne neinteraguje s látkami, ktoré sa eliminujú prevažne prostredníctvom
enzýmov CYP450 alebo substrátmi hlavných transportných bielkovín.
Súbežné podávanie fingolimodu s cyklosporínom nevyvolalo žiadne zmeny expozície cyklosporínu alebo fingolimodu. Preto sa neočakáva, že by fingolimod menil farmakokinetiku liekov, ktoré sú substrátmi CYP3A4.
Súbežné podávanie fingolimodu s perorálnymi kontraceptívami (etinylestradiolom a levonorgestrelom) nevyvolalo zmeny v expozícii perorálnym kontraceptívam. Interakčné štúdie
s perorálnymi kontraceptívami obsahujúcimi iné gestagény sa nevykonali, ale neočakáva sa účinok
fingolimodu na ich expozíciu.
4.6 Fertilita, gravidita a laktácia
Ž
eny v reprodukčnom veku /Antikoncepciaužien
Pred začatím liečby u žien v reprodukčnom veku má byť k dispozícii negatívny výsledok testu na
graviditu a má sa poskytnúť poradenstvo o možnom závažnom riziku pre plod a o potrebe účinnej antikoncepcie počas liečby Gilenyou. Keďže eliminácia fingolimodu z tela trvá približne dva mesiace od ukončenia liečby (pozri časť 4.4), potenciálne riziko pre plod môže pretrvávať a počas tohto obdobia sa má antikoncepcia naďalej používať.
Gravidita
Počas liečby ženy nemajú otehotnieť a odporúča sa používať účinnú antikoncepciu. Ak žena otehotnie
počas užívania Gilenye, odporúča sa Gilenyu vysadiť.
Štúdie na zvieratách preukázali reprodukčnú toxicitu vrátane uhynutia plodov a orgánových poškodení, najmä pretrvávajúceho truncus arteriosus a defektu medzikomorovej priehradky (pozri časť 5.3). Navyše o receptore ovplyvňovanom fingolimodom (receptor sfingozín-1-fosfátu) je známe, že sa podieľa na formovaní ciev počas embryogenézy. Je iba veľmi obmedzené množstvo údajov
o použití fingolimodu u gravidných žien.
Nie sú žiadne údaje o účinkoch fingolimodu na pôrodné sťahy a pôrod.
Dojčenie
Fingolimod sa vylučuje do mlieka zvierat pri podávaní počas laktácie (pozri časť 5.3). Ženy užívajúce
Gilenyu nemajú dojčiť pre možné závažné nežiaduce reakcie na fingolimod u dojčiat.
Fertilita
Údaje z predklinických štúdií nenaznačujú, že by sa fingolimod spájal so zvýšeným rizikom zníženej
fertility (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Gilenya nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Príležitostne sa však môžu vyskytnúť závraty alebo ospalosť, keď sa začína liečba Gilenyou. Pri začatí
liečby Gilenyou sa odporúča pacientov 6 hodín pozorovať (pozri časť 4.4, Bradyarytmia).
4.8 Nežiaduce účinky
Zhrnutie bezpečnostnéhoprofilu
Populácia na vyhodnotenie bezpečnosti Gilenye pochádza z dvoch klinických skúšaní fázy III
kontrolovaných placebom a jedného klinického skúšania fázy III kontrolovaného účinným liekom u dospelých pacientov s relaps-remitujúcou sclerosis multiplex. Zahŕňa celkovo 2 431 dospelých pacientov užívajúcich Gilenyu (0,5 alebo 1,25 mg). Štúdia D2301 (FREEDOMS) bola placebom kontrolovaná 2 roky trvajúca klinická štúdia s 854 dospelými pacientami liečenými fingolimodom (placebo: 418). Štúdia D2309 (FREEDOMS II) bola placebom kontrolovaná 2 roky trvajúca klinická štúdia so 728 dospelými pacientmi so sclerosis multiplex liečenými fingolimodom (placebo: 355). Podľa zlúčených údajov z týchto dvoch štúdií boli najzávažnejšími nežiaducimi reakciami na Gilenyu
0,5 mg infekcie, makulárny edém a prechodná átrioventrikulárna blokáda na začiatku liečby. Najčastejšími nežiaduci reakciami (incidencia ≥10 %) na Gilenyu 0,5 mg boli chrípka, sínusitída, bolesť hlavy, hnačka, bolesť chrbta, zvýšenie pečeňových enzýmov a kašeľ. Najčastejšou nežiaducou reakciou hlásenou pri Gilenyi 0,5 mg, ktorá mala za následok prerušenie liečby, bolo zvýšenie ALT
(2,2 %). Nežiaduce reakcie v štúdii D2302 (TRANSFORMS), štúdii trvajúcej 1 rok u 849 dospelých pacientov liečených fingolimodom, v ktorej sa ako komparátor použil interferón beta-1a, boli pri zohľadnení rozdielov v trvaní štúdií celkovo podobné ako v štúdiách kontrolovaných placebom.
Nežiaduce reakcie hlásené pri Gilenyi 0,5 mg v štúdiách D2301 (FREEDOMS) a D2309 (FREEDOMS II) sú uvedené nižšie. Frekvencie boli definované pomocou nasledujúcej konvencie: veľmi časté (≥1/10), časté (³1/100 až <1/10), menej časté (³1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov).
Tabuľkový zoznam nežiaducich reakcií
Infekcie a nákazy
Veľmi časté: Chrípka
Sínusitída
Časté: Infekcie spôsobené herpetickými vírusmi
Bronchitída
Tinea versicolor
Menej časté: Pneumónia
Neznáme: Progresívna multifokálna leukoencefalopatia (PML)** Kryptokokové infekcie**
Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy)
Časté: Bazocelulárny karcinóm Menej časté Malígny melanóm**** Zriedkavé: Lymfóm***
Spinocelulárny karcinóm****
Veľmi zriedkavé: Kaposiho sarkóm****
Neznáme Karcinóm z Merkelových buniek***
Poruchy krvi a lymfatického systému
Časté: Lymfopénia
Leukopénia Menej časté: Trombocytopénia Neznáme: Periférny edém*** Poruchy imunitného systému
Neznáme: Reakcie z precitlivenosti vrátane exantému, urtikárie a angioedému pri
začatí liečby***
Psychické poruchy
Časté: Depresia
Menej časté: Depresívna nálada
Poruchy nervového systému
Veľmi časté: Bolesť hlavy
Časté: Závraty
Migréna
Menej časté: Epileptický záchvat
Zriedkavé: Syndróm reverzibilnej posteriórnej encefalopatie (PRES)*
Poruchy oka
Časté: Neostré videnie Menej časté: Makulárny edém Poruchy srdca a srdcovej činnosti
Časté: Bradykardia
Átrioventrikulárna blokáda Veľmi zriedkavé: Inverzia vlny T*** Poruchy ciev
Časté: Hypertenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Veľmi časté: Kašeľ
Časté: Dyspnoe
P
oruchy gastrointestinálneho traktu Veľmi časté: Hnačka Menej časté: Nauzea*** Poruchy kože a podkožného tkaniva Časté: Ekzém
Alopécia
Pruritus
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Veľmi časté: Bolesť chrbta
Časté: Myalgia
Artralgia
Celkové poruchy a reakcie v mieste podania Časté: Asténia Laboratórne a funkčné vyšetrenia
Veľmi časté: Zvýšené pečeňové enzýmy (zvýšená ALT, gamaglutamyltransferáza,
aspartátaminotransferáza) Časté: Zvýšené triacylglyceroly v krvi Menej časté: Znížený počet neutrofilov
* Nehlásené v štúdiách FREEDOMS, FREEDOMS II a TRANSFORMS. Kategória frekvencie bola založená na odhadovanej expozícii fingolimodu u približne 10 000 pacientov vo všetkých klinických skúšaniach.
** PML a kryptokokové infekcie (vrátane prípadov kryptokokovej meningitídy) boli hlásené pri
používaní lieku po jeho uvedení na trh (pozri časť 4.4).
*** Nežiaduce reakcie na liek zo spontánnych hlásení a literatúry
**** Kategória frekvencie a hodnotenie rizika sú založené na odhadovanej expozícii 0,5 mg fingolimodu u viac ako 24 000 pacientov vo všetkých klinických štúdiách.
Popis vybraných nežiaducichreakcií
Infekcie
V klinických štúdiách pri sclerosis multiplex bol celkový výskyt infekcií (65,1 %) pri dávke 0,5 mg podobný ako pri placebe. Infekcie dolných dýchacích ciest, najmä bronchitída a v menšej miere herpetická infekcia a pneumónia, boli však častejšie u pacientov liečených Gilenyou.
Niekoľko prípadov diseminovanej herpetickej infekcie, vrátane prípadov končiacich sa úmrtím, sa
zaznamenalo aj pri dávke 0,5 mg.
Pri používaní lieku po jeho uvedení na trh sa zaznamenali prípady infekcií oportúnnymi patogénmi, a to vírusmi (napr. vírus varicella zoster [VZV], vírus Johna Cunninghama [JCV] vyvolávajúci progresívnu multifokálnu leukoencefalopatiu, vírus herpes simplex [HSV]), hubami (napr. kryptokoky, vrátane kryptokokovej meningitídy) alebo baktériami (napr. atypické mykobaktérie),
z ktorých niektoré boli smrteľné (pozri časť 4.4).
Infekcia ľudským papilomavírusom (HPV), vrátane papilómu, dysplázie, bradavíc a rakoviny súvisiacej s HPV, bola hlásená počas liečby fingolimodom po jeho uvedení na trh. Vzhľadom na imunosupresívne vlastnosti fingolimodu sa má zvážiť vakcinácia proti HPV pred začatím liečby fingolimodom, pri čom sa majú zohľadniť odporúčania pre vakcináciu. Skríning rakoviny, vrátane Pap testu, sa odporúča ako pri štandardnej starostlivosti.
Makulárny edém
V klinických štúdiách pri sclerosis multiplex sa makulárny edém vyskytol u 0,5 % pacientov liečených odporúčanou dávkou 0,5 mg a u 1,1 % pacientov liečených vyššou dávkou 1,25 mg. Väčšina prípadov sa vyskytla v priebehu prvých 3-4 mesiacov liečby. U niektorých pacientov sa prejavoval zahmleným videním alebo zníženou zrakovou ostrosťou, ale iní boli asymptomatickí
a diagnostikovaní pri rutinnom oftalmologickom vyšetrení. Makulárny edém sa spravidla zlepšil alebo spontánne ustúpil po vysadení Gilenye. Riziko recidívy po opätovnom podaní liečby sa nehodnotilo.
Incidencia makulárneho edému je vyššia u pacientov so sclerosis multiplex, ktorí majú v anamnéze uveitídu (17 % s uveitídou v anamnéze oproti 0,6 % bez uveitídy v anamnéze). Gilenya sa neskúšala
u pacientov so sclerosis multiplex, ktorí mali súčasne diabetes mellitus, čo je ochorenie, ktoré sa spája so zvýšeným rizikom makulárneho edému (pozri časť 4.4). V klinických štúdiách pri transplantácii obličky, do ktorých boli zaradení aj pacienti, ktorí mali diabetes mellitus, liečba 2,5 mg a 5 mg fingolimodu mala za následok zvýšenie incidencie makulárneho edému na 2-násobok.
Bradyarytmia
Začatie liečby Gilenyou spôsobuje prechodné zníženie srdcovej frekvencie a môže byť spojené aj so spomalením átrioventrikulárneho prevodu. V klinických štúdiách pri sclerosis multiplex sa maximálny pokles srdcovej frekvencie zaznamenal do 6 hodín od začatia liečby, s poklesom priemernej srdcovej frekvencie o 12-13 úderov za minútu pri Gilenyi 0,5 mg. Srdcová frekvencia nižšia ako 40 úderov za minútu u dospelých pacientov a nižšia ako 50 úderov za minútu
u pediatrických pacientov sa zriedkavo pozorovala u pacientov užívajúcich Gilenyu 0,5 mg. Priemerná srdcová frekvencia sa vrátila k východiskovým hodnotám do 1 mesiaca pravidelnej liečby. Bradykardia bola vo všeobecnosti asymptomatická, ale u niektorých pacientov sa objavili mierne až stredne závažné symptómy vrátane hypotenzie, závratov, únavy a/alebo palpitácií, ktoré zmizli do
24 hodín od začatia liečby (pozri tiež časti 4.4 a 5.1).
V klinických štúdiách pri sclerosis multiplex sa zistila na začiatku liečby átrioventrikulárna blokáda prvého stupňa (predĺžený PR interval na EKG) u dospelých a pediatrických pacientov. V klinických skúšaniach s dospelými sa vyskytla u 4,7 % pacientov pri 0,5 mg fingolimodu, u 2,8 % pacientov pri intramuskulárnom interferóne beta-1a a u 1,6 % pacientov pri placebe. Átrioventrikulárna blokáda druhého stupňa sa zistila u menej ako 0,2 % dospelých pacientov pri Gilenyi 0,5 mg. Po uvedení lieku na trh sa zaznamenali počas šesť hodinovej pozorovacej doby po podaní prvej dávky Gilenye
ojedinelé prípady prechodnej kompletnej átrioventrikulárnej blokády, ktorá spontánne vymizla. Pacienti sa zotavili spontánne. Poruchy prevodu zaznamenané počas klinických skúšaní aj po uvedení lieku na trh boli obvykle prechodné, asymptomatické a zmizli počas prvých 24 hodín od začatia liečby. Hoci väčšina pacientov nevyžadovala lekársku intervenciu, jeden pacient užívajúci Gilenyu
0,5 mg dostal izoprenalín proti asymptomatickej átrioventrikulárnej blokáde Mobitz I druhého stupňa.
Po uvedení lieku na trh sa ojedinele zaznamenal do 24 hodín po podaní prvej dávky oneskorený nástup reakcií, vrátane prechodnej asystolie a neobjasneného úmrtia. Tieto prípady boli skreslené súčasne podávanými liekmi a/alebo už jestvujúcim ochorením. Spojitosť týchto udalostí s Gilenyou nie je známa.
Krvný tlak
V klinických štúdiách pri sclerosis multiplex sa užívanie Gilenye 0,5 mg spájalo s priemerným zvýšením systolického tlaku približne o 3 mmHg a diastolického tlaku približne o 1 mmHg, ktoré sa prejavilo asi 1 mesiac po začatí liečby. Toto zvýšenie pretrvávalo pri pokračujúcej liečbe. Hypertenzia bola hlásená u 6,5 % pacientov pri 0,5 mg fingolimodu a u 3,3 % pacientov pri placebe. Po uvedení lieku na trh boli počas prvého mesiaca po začatí liečby a aj počas prvého dňa liečby hlásené prípady hypertenzie, ktoré môžu vyžadovať antihypertenzívnu liečbu alebo ukončenie liečby Gilenyou (pozri
aj časť 4.4, Účinky na tlak krvi).
Funkcia peče ne
U dospelých a pediatrických pacientov so sclerosis multiplex liečených Gilenyou sa zaznamenali zvýšené pečeňové enzýmy. V klinických štúdiách sa u 8,0 % dospelých pacientov liečených Gilenyou
0,5 mg vyskytlo asymptomatické zvýšenie sérových hladín ALT ≥3x ULN (horná hranica normy) a u 1,8 % dospelých pacientov ≥5x ULN. Zvýšenie pečeňových aminotransferáz sa u niektorých pacientov znovu objavilo po opätovnom podaní, čo svedčí o súvislosti s liekom. V klinických skúšaniach sa zvýšenie aminotransferáz vyskytlo kedykoľvek počas liečby, hoci väčšina prípadov sa vyskytla počas prvých 12 mesiacov. Hladiny ALT sa vrátili do normálu približne do 2 mesiacov od vysadenia Gilenye. U malého počtu pacientov (N=10 pri 1,25 mg, N=2 pri 0,5 mg), u ktorých došlo
k zvýšeniu ALT ≥5x ULN a ktorí pokračovali v liečbe Gilenyou, sa hladiny ALT vrátili do normálu
približne do 5 mesiacov (pozri aj časť 4.4, Funkcia pečene).
Poruchy nervového systému
V klinických skúšaniach sa vyskytli zriedkavé udalosti postihujúce nervový systém u pacientov liečených vyššími dávkami fingolimodu (1,25 alebo 5 mg), zahŕňajúce ischemické a hemoragické mozgové príhody a neurologické atypické poruchy, napr. prípady podobné akútnej diseminovanej encefalomyelitíde (ADEM).
Prípady epileptických záchvatov vrátane status epilepticus boli hlásené pri použití Gilenye
v klinických štúdiách a po jej uvedení na trh.
Cievne poruchy
Zriedkavé prípady okluzívnej choroby periférnych tepien sa vyskytli u pacientov liečených vyššími
dávkami fingolimodu (1,25 mg).
Dýchacia sústava
Pri liečbe Gilenyou sa pozoroval mierny, od dávky závislý pokles hodnôt objemu úsilného výdychu (FEV1) a difúznej kapacity pre oxid uhoľnatý (DLCO), ktorý sa objavil v 1. mesiaci a odvtedy zostal stabilný. Po 24 mesiacoch bol pokles v percentách prediktívneho FEV1 oproti východiskovým hodnotám 2,7 % pri 0,5 mg fingolimodu a 1,2 % pri placebe, čo bol rozdiel, ktorý zmizol po ukončení liečby. Pri DLCO bol pokles po 24 mesiacoch 3,3 % pri 0,5 mg fingolimodu a 2,7 % pri placebe.
Lymfómy
V klinických skúšaniach, ako aj pri používaní lieku po jeho uvedení na trh sa vyskytli prípady lymfómov rozličných druhov, vrátane fatálneho prípadu B-bunkového lymfómu s pozitivitou na Epsteinov-Barrovej vírus (EBV). Incidencia prípadov lymfómov (B-bunkových a T-bunkových) bola vyššia v klinických skúšaniach, ako sa očakáva u všeobecnej populácie. Po uvedení lieku na trh bolo hlásených aj niekoľko prípadov T-bunkových lymfómov, vrátane prípadov kožného T-bunkového lymfómu (mycosis fungoides).
Hemofagocytový syndróm
Veľmi zriedkavé prípady hemofagocytového syndrómu (HPS) v spojení s infekciou končiace sa úmrtím boli hlásené u pacientov liečených fingolimodom. HPS je zriedkavé ochorenie, ktoré sa popísalo v súvislosti s infekciami, imunosupresiou a rôznymi autoimunitnými chorobami.
Pediatrická populácia
V kontrolovanom pediatrickom klinickom skúšaní D2311 (pozri časť 5.1) bol profil bezpečnosti
u pediatrických pacientov (vo veku od 10 do menej ako 18 rokov), ktorí dostávali fingolimod 0,25 mg alebo 0,5 mg denne, celkovo podobný, aký sa pozoroval u dospelých pacientov. V štúdii sa však zaznamenalo viac neurologických a psychických porúch. Vzhľadom na veľmi obmedzené poznatky dostupné z klinickej štúdie sa u tejto podskupiny vyžaduje opatrnosť.
V pediatrickej štúdii boli hlásené prípady epileptických záchvatov u 5,6 % pacientov liečených
fingolimodom a u 0,9 % pacientov liečených interferónom beta-1a.
Je známe, že depresia a úzkosť sa vyskytujú so zvýšenou frekvenciou u populácie so sclerosis multiplex. Depresia a úzkosť boli hlásené aj u pediatrických pacientov liečených fingolimodom.
Ojedinelé mierne zvýšenia bilirubínu sa zaznamenali u pediatrických pacientov liečených
fingolimodom.
H
l
ásenie podozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieJednorazové dávky až do 80-násobku odporúčanej dávky (0,5 mg) dobre znášali dospelí zdraví
dobrovoľníci. Pri dávke 40 mg, 5 zo 6 osôb hlásilo mierne zvieranie alebo nepríjemné pocity v hrudníku, čo klinicky zodpovedalo slabej reaktivite dýchacích ciest.
Pri začatí liečby môže fingolimod vyvolať bradykardiu. Pokles srdcovej frekvencie zvyčajne začína do jednej hodiny od podania prvej dávky a je najprudší počas prvých šiestich hodín. Negatívny chronotropný účinok Gilenye pretrváva viac ako 6 hodín a počas následných dní liečby sa postupne oslabuje (detailne, pozri časť 4.4). Hlásené boli prípady pomalého átrioventrikulárneho prevodu
s ojedinelými hláseniami prechodnej, spontánne vymiznúcej úplnej AV blokády (pozri časti 4.4 a
4.8).
Ak dôjde k predávkovaniu pri prvom podaní Gilenye, je dôležité aspoň počas prvých 6 hodín sledovať pacienta kontinuálnym monitorovaním EKG v reálnom čase a meraním srdcovej frekvencie a krvného tlaku každú hodinu (pozri časť 4.4).
Navyše, ak je hodnota srdcovej frekvencie po 6 hodinách <45 bpm u dospelých, <55 bpm
u pediatrických pacientov vo veku 12 rokov a starších, alebo <60 bpm u pediatrických pacientov vo veku od 10 rokov do menej ako 12 rokov, alebo ak EKG po 6 hodinách po prvej dávke vykazuje AV blokádu druhého alebo vyššieho stupňa alebo QTc interval ≥500 msek, monitorovanie je potrebné predĺžiť aj počas noci až do upravenia nálezu. Výskyt átrioventrikulárnej blokády tretieho stupňa
v ktoromkoľvek čase je tiež dôvodom na predĺžené sledovanie, vrátane sledovania počas noci. Dialýza ani výmena plazmy nemajú za následok odstránenie fingolimodu z tela.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Selektívne imunosupresíva, ATC kód: L04AA27
Mechanizmus účinkuFingolimod je modulátor receptora sfingozín-1-fosfátu. Fingolimod sa metabolizuje sfingozínkinázou
na aktívny metabolit fingolimodfosfát. Fingolimodfosfát sa viaže v nízkych nanomolárnych koncentráciách na receptor 1 sfingozín-1-fosfátu (S1P), ktorý sa nachádza na lymfocytoch, a ľahko prestupuje hematoencefalickú bariéru, aby sa naviazal na receptor 1 S1P nachádzajúci sa na nervových bunkách v centrálnom nervovom systéme (CNS). Svojím pôsobením ako funkčný antagonista receptorov S1P na lymfocytoch fingolimodfosfát blokuje schopnosť lymfocytov
vystupovať z lymfatických uzlín, čím spôsobuje skôr redistribúciu ako redukciu lymfocytov. Štúdie na zvieratách ukázali, že táto redistribúcia zníži infiltráciu patogénnych lymfocytov vrátane prozápalových buniek Th17 do CNS, kde by sa podieľali na zápale nervov a poškodzovaní nervového tkaniva. Štúdie na zvieratách a pokusy
in vitro naznačujú, že fingolimod môže účinkovať aj prostredníctvom interakcie s receptormi S1P na nervových bunkách.
Farmakodynamické účinky
V priebehu 4-6 hodín po prvej dávke 0,5 mg fingolimodu počet lymfocytov klesne na približne 75 %
východiskovej hodnoty v periférnej krvi. Pri pokračujúcom dennom užívaní pokračuje pokles počtu lymfocytov počas obdobia dvoch týždňov a dosiahne minimálny počet približne 500 buniek/mikroliter alebo približne 30 % východiskovej hodnoty. 18 % pacientov dosiahlo minimálny počet pod
200 buniek/mikroliter pri najmenej jednom vyšetrení. Nízky počet lymfocytov sa udržiava pri dlhodobom dennom užívaní. Väčšina T a B lymfocytov pravidelne prechádza cez lymfatické orgány a toto sú bunky, ktoré fingolimod najviac ovplyvňuje. Približne 15-20 % T lymfocytov má fenotyp efektorovej pamäte, čo sú bunky, ktoré sú dôležité pre dohľad nad periférnou imunitou. Keďže táto podskupina lymfocytov spravidla neprechádza cez lymfatické orgány, nie je fingolimodom
ovplyvnená. Nárast počtu periférnych lymfocytov je zrejmý po niekoľkých dňoch od vysadenia liečby fingolimodom a normálne počty sa obvykle dosiahnu po jednom až dvoch mesiacoch. Dlhodobé užívanie fingolimodu vedie k miernemu poklesu počtu neutrofilov na približne 80 % východiskových hodnôt. Fingolimod neovplyvňuje monocyty.
Fingolimod spôsobuje na začiatku liečby prechodný pokles srdcovej frekvencie a zníženie átrioventrikulárneho prevodu (pozri časti 4.4 a 4.8). Maximálny pokles srdcovej frekvencie sa pozoruje počas 6 hodín od užitia, pričom 70 % negatívneho chronotropného účinku sa dosahuje v prvý deň. Pri pokračujúcom podávaní sa srdcová frekvencia vráti na východiskové hodnoty do jedného mesiaca. Pokles srdcovej frekvencie vyvolaný fingolimodom môže zvrátiť parenterálne podanie atropínu alebo izoprenalínu. Zistilo sa, že aj inhalovaný salmeterol má mierny pozitívne
chronotropný účinok. Na začiatku liečby fingolimodom dochádza k nárastu predčasných kontrakcií predsiení, ale nedochádza k zvýšeniu výskytu fibrilácií/flutteru predsiení alebo komorových arytmií alebo ektopie. Liečba fingolimodom sa nespája s poklesom ejekčnej frakcie srdca. Liečba fingolimodom neovplyvňuje autonómne reakcie srdca vrátane cirkadiálnych zmien srdcovej frekvencie a reakcie na záťaž.
S1P4 mohol čiastočne prispieť k účinku, ale nebol hlavným receptorom zodpovedným za pokles lymfocytov. Mechanizmus účinku bradykardie a vazokonstrikcie sa tiež skúmali in vitro na morčatách a na izolovanej králičej aorte a koronárej artérii. Prišlo sa k záveru, že bradykardia môže byť primárne sprostredkovaná aktiváciou smerovania draslíkového kanála dovnútra alebo G-proteínom'
aktivovaného smerovania K+ kanála (IKACh/GIRK) dovnútra a že vazokonstrikcia sa zdá byť
sprostredkovaná Rho kinázou a mechanizmom závislým od vápnika.
Jednorazové alebo opakované podávanie fingolimodu v dávkach 0,5 a 1,25 mg počas dvoch týždňov sa nespája s preukázateľným zvýšením odporu dýchacích ciest, meraným ako FEV1 a úsilný exspiračný prietok (FEF) 25-75. Avšak jednorazové dávky fingolimodu ≥5 mg (10-násobok odporúčanej dávky) sa spájajú so zvýšením odporu dýchacích ciest závislým od dávky. Opakované podávanie fingolimodu v dávkach 0,5; 1,25 alebo 5 mg sa nespája so zhoršenou saturáciou alebo desaturáciou kyslíkom pri telesnej námahe alebo zvýšenou citlivosťou dýchacích ciest na metacholín. Osoby liečené fingolimodom majú normálnu bronchodilatačnú odpoveď na inhalačné betaagonisty.
Klinická účinnosťabezpečnosť
Účinnosť Gilenye sa preukázala v dvoch štúdiách, ktoré hodnotili dávky 0,5 mg a 1,25 mg
fingolimodu raz denne u dospelých pacientov s relaps-remitujúcou sclerosis multiplex (RRSM). Do oboch štúdií boli zaradení dospelí pacienti, ktorí prekonali ≥2 relapsy počas predchádzajúcich 2 rokov alebo ≥1 relaps počas predchádzajúceho roka. Ich skóre rozšírenej Kurtzkeho škály funkčnej nespôsobilosti (EDSS) bolo medzi 0 a 5,5. Tretia štúdia zameraná na rovnakú populáciu dospelých pacientov sa skončila po zaregistrovaní Gilenye.
Štúdia D2301 (FREEDOMS) bola randomizovaná, dvojito slepá, placebom kontrolovaná štúdia fázy III trvajúca 2 roky u 1 272 pacientov (n=425 pri 0,5 mg, 429 pri 1,25 mg, 418 pri placebe). Hodnoty mediánu východiskových charakteristických znakov boli: vek 37 rokov, trvanie ochorenia
6,7 roka a skóre EDSS 2,0. Záverečné výsledky sú uvedené v Tabuľke 1. Nepreukázali sa žiadne
významné rozdiely medzi dávkami 0,5 mg a 1,25 mg ani pri jednom z ukazovateľov.
Tabuľka 1 Štúdia D2301 (FREEDOMS): hlavné výsledky
Kli
nické ukazovatele
F
i
ngolimod
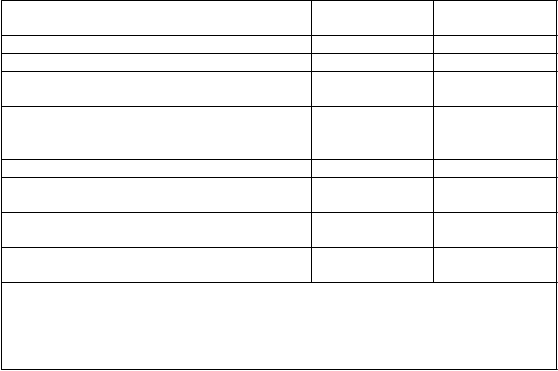 0,5 mg
P
l
acebo
0,5 mg
P
l
acebo
Frekvencia relapsov za rok (primárny ukazovateľ) 0,18** 0,40
Percentuálny podiel pacientov bez relapsov po
24 mesiacoch
Podiel s progresiou invalidizácie potvrdenou po
3 mesiacoch†
70 %** 46 %
17 % 24 %
Pomer rizika (95 % IS) 0,70 (0,52, 0,96)*
Ukazovatele MRI
Medián (priemer) počtu nových alebo zväčšujúcich sa T2-lézií počas 24 mesiacov Medián (priemer) počtu Gd-zvýrazňujúcich sa lézií po 24 mesiacoch
Medián (priemer) % zmeny objemu mozgu počas
24 mesiacov
0,0 (2,5)** 5,0 (9,8)
0,0 (0,2)** 0,0 (1,1)
-0,7 (-0,8)** -1,0 (-1,3)
† Progresia invalidizácie definovaná ako zvýšenie EDSS o 1 bod potvrdená o
3 mesiace neskôr.
** p<0,001, *p<0,05 v porovnaní s placebom
Všetky analýzy klinických ukazovateľov boli hodnotené pri liečebnom zámere (intent-to-
treat). Analýzy MRI používali vyhodnotiteľný súbor údajov.
Pacienti, ktorí ukončili 24 mesiacov základnej štúdie FREEDOMS, mohli byť zaradení do extenzie
(D2301E1) so zaslepenou dávkou a dostávať fingolimod. Celkovo sa extenzie zúčastnilo
920 pacientov (n=331 pokračovalo s 0,5 mg, 289 pokračovalo s 1,25 mg, 155 prešlo z placeba na
0,5 mg a 145 prešlo z placeba na 1,25 mg). Po 12 mesiacoch (36. mesiac) bolo ešte stále zaradených
856 pacientov (93 %). Medzi 24. a 36. mesiacom frekvencia relapsov za rok (ARR) u pacientov, ktorí dostávali 0,5 mg fingolimodu v základnej štúdii a zostali na dávke 0,5 mg, bola 0,17 (0,21 v základnej štúdii). ARR u pacientov, ktorí prešli z placeba na 0,5 mg fingolimodu, bola 0,22 (0,42 v základnej štúdii).
Porovnateľné výsledky sa zistili v opakovanej randomizovanej, dvojito slepej, placebom kontrolovanej štúdii fingolimodu fázy III trvajúcej 2 roky u 1 083 pacientov s RRMS (n=358 pri
0,5 mg, 370 pri 1,25 mg, 355 pri placebe) (D2309; FREEDOMS 2). Medián východiskových charakteristických hodnôt: vek 41 rokov, trvanie choroby 8,9 rokov, skóre EDSS 2,5.
Tabuľka 2 Štúdia D2309 (FREEDOMS): hlavné výsledky
Kli
nické ukazovatele
F
i
ngolimod
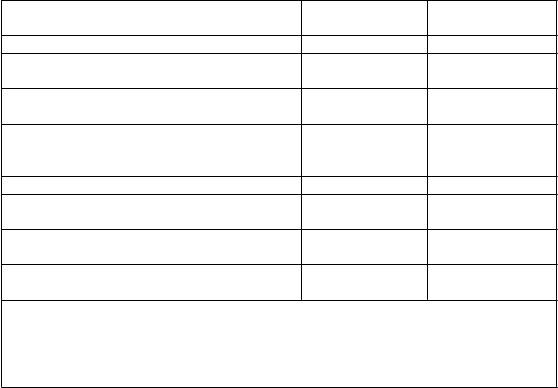 0,5 mg
P
l
acebo
0,5 mg
P
l
acebo
Frekvencia relapsov za rok (primárny
ukazovateľ)
Percentuálny podiel pacientov bez relapsov po
24 mesiacoch
Podiel s progresiou invalidizácie potvrdenou po
3 mesiacoch†
0,21** 0,40
71,5 %** 52,7 %
25 % 29 %
Pomer rizika (95 % IS) 0,83 (0,61, 1,12)
Ukazovatele MRI
Medián (priemer) počtu nových alebo zväčšujúcich sa T2-lézií počas 24 mesiacov Medián (priemer) počtu Gd-zvýrazňujúcich sa lézií po 24 mesiacoch
Medián (priemer) % zmeny objemu mozgu
počas 24 mesiacov
0,0 (2,3)** 4,0 (8,9)
0,0 (0,4)** 0,0 (1,2)
-0,71 (-0,86)** -1,02 (-1,28)
† Progresia invalidizácie definovaná ako zvýšenie EDSS o 1 bod potvrdená o
3 mesiace neskôr
** p<0,001 v porovnaní s placebom
Všetky analýzy klinických ukazovateľov boli hodnotené pri liečebnom zámere (intent-to-
treat). Analýzy MRI používali vyhodnotiteľný súbor údajov.
Štúdia D2302 (TRANSFORMS) bola randomizovaná, dvojito slepá, dvojito maskovaná, účinným
liekom (interferón beta-1a) kontrolovaná štúdia fázy III trvajúca 1 rok u 1 280 pacientov (n=429 pri
0,5 mg, 420 pri 1,25 mg, 431 pri interferóne beta-1a 30 µg podávanom intramuskulárnou injekciou raz za týždeň). Hodnoty mediánu východiskových charakteristických znakov boli: vek 36 rokov, trvanie ochorenia 5,9 roka a skóre EDSS 2,0. Záverečné výsledky sú uvedené v Tabuľke 3. Pri ukazovateľoch štúdie sa nepreukázali žiadne významné rozdiely medzi dávkami 0,5 mg a 1,25 mg.
Tabuľka 3 Štúdia D2302 (TRANSFORMS): hlavné výsledky
Kli
nické ukazovatele
F
i
ngolimod
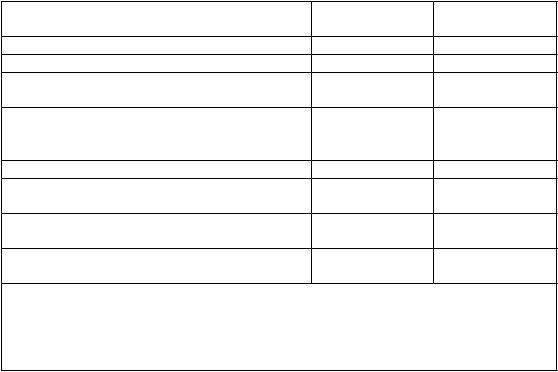 0,5 mg
Interferón beta-
1a, 30 μg
0,5 mg
Interferón beta-
1a, 30 μg
Frekvencia relapsov za rok (primárny ukazovateľ) 0,16** 0,33
Percentuálny podiel pacientov bez relapsov po
12 mesiacoch
Podiel s progresiou invalidizácie potvrdenou po
3 mesiacoch†
83 %** 71 %
6 % 8 %
Pomer rizika (95 % IS) 0,71 (0,42, 1,21)
Ukazovatele MRI
Medián (priemer) počtu nových alebo zväčšujúcich sa T2-lézií počas 12 mesiacov Medián (priemer) počtu Gd-zvýrazňujúcich sa lézií po 12 mesiacoch
Medián (priemer) % zmeny objemu mozgu počas
12 mesiacov
0,0 (1,7)* 1,0 (2,6)
0,0 (0,2)** 0,0 (0,5)
-0,2 (-0,3)** -0,4 (-0,5)
† Progresia invalidizácie definovaná ako zvýšenie EDSS o 1 bod potvrdená o
3 mesiace neskôr.
* p<0,01,** p<0,001 v porovnaní s interferónom beta-1a
Všetky analýzy klinických ukazovateľov boli hodnotené pri liečebnom zámere (intent-to-
treat). Analýzy MRI používali vyhodnotiteľný súbor údajov.
Pacienti, ktorí ukončili 12 mesiacov základnej štúdie TRANSFORMS, mohli byť zaradení do extenzie
(D2302E1) so zaslepenou dávkou a dostávať fingolimod. Celkovo sa extenzie zúčastnilo
1 030 pacientov, avšak 3 z týchto pacientov nedostali liečbu (n=356 pokračovalo s 0,5 mg, 330
pokračovalo s 1,25 mg, 167 prešlo z interferónu beta-1a na 0,5 mg a 174 z interferónu beta-1a na
1,25 mg). Po 12 mesiacoch (24. mesiac) bolo ešte stále zaradených 882 pacientov (86 %). Medzi 12. a
24. mesiacom ARR u pacientov, ktorí dostávali 0,5 mg fingolimodu v základnej štúdii a zostali na dávke 0,5 mg, bola 0,20 (0,19 v základnej štúdii). ARR u pacientov, ktorí prešli z interferónu beta-1a na 0,5 mg fingolimodu, bola 0,33 (0,48 v základnej štúdii).
Zlúčené výsledky štúdií D2301 a D2302 ukázali zhodný a štatisticky významný pokles frekvencie relapsov prerátanej na rok v porovnaní s komparátorom v podskupinách definovaných pohlavím, vekom, predchádzajúcou liečbou sclerosis multiplex a východiskovou aktivitou ochorenia alebo stupňom invalidizácie.
Ďalšie analýzy údajov z klinických skúšaní ukazujú zhodné účinky liečby u podskupín pacientov s vysoko aktívnou relaps-remitujúcou sclerosis multiplex.
Pediatrická populácia
Účinnosť a bezpečnosť dávok fingolimodu 0,25 mg alebo 0,5 mg podávaných raz denne (dávka
určená na základe telesnej hmotnosti a merania expozície) sa stanovili u pediatrických pacientov vo veku 10 až <18 rokov s relaps-remitujúcou sclerosis multiplex.
Štúdia D2311 (PARADIGMS) bola dvojito zaslepená, dvojito maskovaná, účinným liekom kontrolovaná štúdia s premenlivým trvaním do 24 mesiacov, s 215 pacientmi vo veku 10 až <18 rokov (n=107 liečených fingolimodom, 108 liečených interferónom beta-1a 30 µg podávaným intramuskulárnou injekciou raz týždenne).
Hodnoty mediánu východiskových charakteristík boli: vek 16 rokov, medián trvania choroby 1,5 roka a skóre EDSS 1,5. Väčšina pacientov mala stupeň 2 alebo vyšší podľa Tannera (94,4 %) a hmotnosť
>40 kg (95,3 %). Celkovo 180 (84 %) pacientov ukončilo základnú fázu liečby skúšaným liekom
(n=99 [92,5 %] fingolimodom, 81 [75 %] interferónom beta-1a). Výsledky sú uvedené v Tabuľke 4.
Tabuľka 4 Štúdia D2311 (PARADIGMS): hlavné výsledky
F
i
ngolimod
0,25 mg alebo 0,5 mg
I
nterferón beta-1a
30 µg
Kli
nické ukazovatele N=107 N=107#
Frekvencia relapsov za rok (primárny ukazovateľ) 0,122** 0,675
Percentuálny podiel pacientov bez relapsov po
24 mesiacoch
Ukazovatele MRI
Výskyt nových alebo novo sa zväčšujúcich T2-lézií za rok
85,7** 38,8
n=106 n=102
Upravený priemer 4,393** 9,269
Počet Gd-zvýrazňujúcich sa T1-lézií pripadajúci na sken do 24 mesiacov
n=105 n=95
Upravený priemer 0,436** 1,282
Výskyt atrofie mozgu za rok oproti východiskovému stavu do 24 mesiacov
n=96 n=89
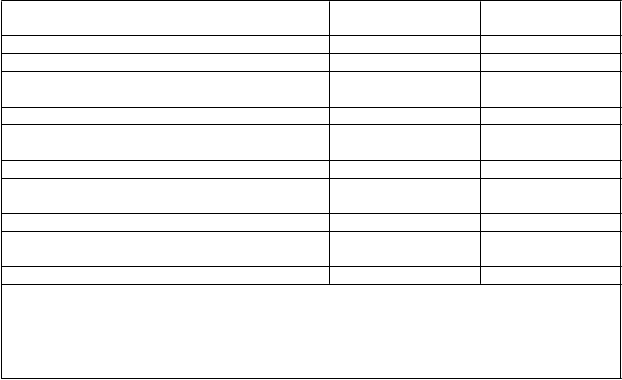
Priemer metódou najmenších štvorcov -0,48* -0,80
# Jeden pacient randomizovaný na podávanie interferónu beta-1a intramuskulárnou injekciou nebol schopný prehĺtať dvojito maskovanú medikáciu a ukončil účasť v štúdii. Pacient bol vylúčený z úplného súboru na analýzu a bezpečnosť.
* p<0,05, ** p<0,001, v porovnaní s interferónom beta-1a.
Všetky analýzy klinických ukazovateľov sa vykonali s úplným súborom na analýzu.
5.2 Farmakokinetické vlastnostiFarmakokinetické údaje sa získali u zdravých dospelých dobrovoľníkov, dospelých pacientov po
transplantácii obličky a u dospelých pacientov so sclerosis multiplex. Farmakologicky aktívny metabolit zodpovedný za účinnosť je fingolimodfosfát.
AbsorpciaAbsorpcia fingolimodu je pomalá (tmax 12-16 hodín) a rozsiahla (≥85 %). Zdanlivá absolútna
perorálna biologická dostupnosť je 93 % (95 % interval spoľahlivosti: 79-111 %). Koncentrácie v krvi v rovnovážnom stave sa dosiahnu do 1 až 2 mesiacov pri podávaní raz denne a rovnovážne hladiny sú približne 10-násobne vyššie ako po začiatočnej dávke.
Požitie jedla nemení Cmax alebo expozíciu (AUC) fingolimodu. Cmax fingolimodfosfátu sa mierne znížila o 34 %, ale AUC sa nezmenila. Gilenyu možno preto užívať bez ohľadu na jedlo (pozri časť 4.2).
Distribúcia
Fingolimod sa vo veľkej miere distribuuje do červených krviniek, s podielom 86 % v krvinkách.
Fingolimodfosfát má nižšie, <17 % vychytávanie krvinkami. Fingolimod a fingolimodfosfát sa vo
veľkej miere viažu na bielkoviny (>99 %).
Fingolimod sa v značnej miere distribuuje do tkanív organizmu, s distribučným objemom približne
1 200±260 litrov. Štúdia so štyrmi zdravými osobami, ktoré dostali intravenózne jednorazovú dávku
rádioaktívne značeného analógu fingolimodu, preukázala penetráciu fingolimodu do mozgu. V štúdii s 13 pacientmi so sclerosis multiplex, ktorí dostávali Gilenyu 0,5 mg/deň, stredné množstvo fingolimodu (a fingolimodfosfátu) v ejakuláte semena bolo v rovnovážnom stave približne
10 000-krát nižšie ako perorálne podávaná dávka (0,5 mg).
Biotransformácia
Fingolimod sa u ľudí transformuje reverzibilnou stereoselektívnou fosforyláciou na farmakologicky
aktívny (S)-enantiomér fingolimodfosfátu. Fingolimod sa eliminuje oxidatívnou biotransformáciou katalyzovanou najmä prostredníctvom CYP4F2 a možno iných izoenzýmov a následnou degradáciou, podobnou ako pri mastných kyselinách, na neaktívne metabolity. Pozorovala sa aj tvorba farmakologicky neaktívnych nepolárnych ceramidových analógov fingolimodu. Hlavný enzým, ktorý sa podieľa na metabolizme fingolimodu, je čiastočne identifikovaný, a môže to byť buď CYP4F2, alebo CYP3A4.
Po jednorazovej perorálnej dávke [14C] fingolimodu sú hlavnými zložkami v krvi, ktoré súvisia
s fingolimodom, ako sa usudzuje z ich podielu na AUC všetkých rádioaktívne značených zložiek až do 34 dní po podaní, samotný fingolimod (23 %), fingolimodfosfát (10 %) a neaktívne metabolity (metabolit charakteru karboxylovej kyseliny M3 (8 %), ceramidový metabolit M29 (9 %) a ceramidový metabolit M30 (7 %)).
Eliminácia
Klírens fingolimodu z krvi je 6,3±2,3 l/h a priemerný zdanlivý konečný polčas (t1/2) je 6-9 dní. Hladiny fingolimodu a fingolimodfosfátu v krvi klesajú v záverečnej fáze paralelne, čoho dôsledkom
sú podobné polčasy oboch látok.
Po perorálnom podaní sa asi 81 % dávky pomaly vylúči močom ako neaktívne metabolity. Fingolimod a fingolimodfosfát sa močom nevylučujú v nezmenenej forme, ale sú hlavnými zložkami v stolici, pričom množstvo každého z nich predstavuje menej ako 2,5 % dávky. Po 34 dňoch sa nájde 89 % podanej dávky.
Linearita
Koncentrácie fingolimodu a fingolimodfosfátu po opakovanom podávaní dávok 0,5 mg alebo 1,25 mg
raz denne sa zjavne zvyšujú úmerne dávke.
Charakteristika u osobitných skupín pacientov
Farmakokinetika fingolimodu a fingolimodfosfátu sa nelíši u mužov a žien, u pacientov rôzneho
etnického pôvodu, alebo u pacientov s ľahkou až ťažkou poruchou funkcie obličiek.
U osôb s ľahkou, stredne ťažkou alebo ťažkou poruchou funkcie pečene (trieda A, B a C podľa
Childa-Pugha) sa nepozorovala zmena Cmax fingolimodu, ale AUC fingolimodu sa príslušne zvýšila
o 12 %, 44 % a 103 %. U pacientov s ťažkou poruchou funkcie pečene (trieda C podľa Childa-Pugha) sa Cmax fingolimodfosfátu znížila o 22 % a AUC sa podstatne nezmenila. Farmakokinetika fingolimodfosfátu sa nehodnotila u pacientov s ľahkou alebo stredne ťažkou poruchou funkcie
pečene. Zdanlivý polčas eliminácie fingolimodu nie je zmenený u osôb s ľahkou poruchou funkcie pečene, ale predlžuje sa asi o 50 % u pacientov so stredne ťažkou alebo ťažkou poruchou funkcie pečene.
Fingolimod sa nemá používať u pacientov s ťažkou poruchou funkcie pečene (trieda C podľa Childa- Pugha) (pozri časť 4.3). Liečba fingolimodom sa má začať opatrne u pacientov s ľahkou a stredne ťažkou poruchou funkcie pečene (pozri časť 4.2).
Klinické skúsenosti a údaje o farmakokinetike u pacientov starších ako 65 rokov sú obmedzené.
Gilenya sa má používať opatrne u 65-ročných a starších pacientov (pozri časť 4.2).
Pediatrická populácia
U pediatrických pacientov (vo veku 10 rokov a starších) sa koncentrácie fingolimodfosfátu zjavne
zvyšujú úmerne dávke medzi 0,25 mg a 0,5 mg.
Koncentrácia fingolimodfosfátu v rovnovážnom stave je približne o 25 % nižšia u pediatrických pacientov (vo veku 10 rokov a starších) po podaní 0,25 mg alebo 0,5 mg fingolimodu v porovnaní s koncentráciou u dospelých pacientov liečených fingolimodom 0,5 mg raz denne.
Nie sú dostupné údaje u pediatrických pacientov mladších ako 10 rokov.
5.3 Predklinické údaje o bezpečnosti
Predklinický bezpečnostný profil fingolimodu sa vyhodnotil u myší, potkanov, psov a opíc. Hlavnými cieľovými orgánmi boli lymfatický systém (lymfopénia a atrofia lymfatických orgánov), pľúca (zvýšená hmotnosť, hypertrofia hladkého svalstva v oblasti bronchoalveolárneho prechodu) a srdce (negatívny chronotropný účinok, zvýšenie krvného tlaku, perivaskulárne zmeny a degenerácia myokardu) u viacerých druhov; krvné cievy (vaskulopatia) iba u potkanov v dávkach 0,15 mg/kg a vyšších v štúdii trvajúcej 2 roky, čo predstavuje približne 4-násobok hornej hranice systémovej expozície (AUC) u ľudí pri dennej dávke 0,5 mg.
Dôkazy karcinogenity sa nepozorovali v biologickom stanovení trvajúcom 2 roky na potkanoch pri perorálnych dávkach fingolimodu až do maximálnej tolerovanej dávky 2,5 mg/kg, čo predstavuje približne 50-násobok hornej hranice systémovej expozície (AUC) u ľudí pri dávke 0,5 mg. Avšak
v štúdii na myšiach trvajúcej 2 roky sa zaznamenal zvýšený výskyt malígneho lymfómu pri dávkach
0,25 mg/kg a vyšších, čo predstavuje približne 6-násobok hornej hranice systémovej expozície (AUC)
u ľudí pri dennej dávke 0,5 mg.
Fingolimod nebol mutagénny ani klastogénny v štúdiách na zvieratách.
Fingolimod nemal vplyv na počet/pohyblivosť spermií alebo na fertilitu u samcov a samíc potkana až do najvyššej testovanej dávky (10 mg/kg), čo predstavuje približne 150-násobok hornej hranice systémovej expozície (AUC) u ľudí pri dennej dávke 0,5 mg.
Fingolimod bol teratogénny u potkanov pri dávkach 0,1 mg/kg alebo vyšších. Expozícia liečivu u potkanov pri tejto dávke bola podobná ako u pacientov pri terapeutickej dávke (0,5 mg). Najčastejšie malformácie vnútorných orgánov u plodov zahŕňali pretrvávajúci truncus arteriosus
a defekt medzikomorovej priehradky. Teratogénny potenciál u králikov nebolo možné úplne stanoviť, ale zvýšená úmrtnosť embryí a fétov sa pozorovala pri dávkach 1,5 mg/kg a vyšších a pokles počtu životaschopných fétov a spomalenie rastu fétov sa pozorovali pri 5 mg/kg. Expozícia liečivu
u králikov pri týchto dávkach bola podobná ako u pacientov.
U potkanov sa znížilo prežívanie mláďat generácie F1 vo včasnom popôrodnom období pri dávkach, ktoré neboli toxické pre matky. Avšak podávanie fingolimodu neovplyvnilo telesnú hmotnosť, vývin, správanie a fertilitu generácie F1.
Fingolimod sa pri podávaní počas laktácie vylučoval do mlieka zvierat v koncentráciách 2- až 3- násobne vyšších, ako sa zistili v plazme matiek. Fingolimod a jeho metabolity prestupovali placentárnu bariéru u gravidných králikov.
Štúdie namladýchzvieratách
Výsledky dvoch štúdií toxicity na mladých potkanoch ukázali malé účinky na neurobehaviorálnu
odpoveď, spomalené pohlavné dozrievanie a zníženú imunitnú odpoveď na opakovanú stimuláciu hemocyanínom z Megathura crenulata (KLH, keyhole limpet haemocyanin), čo sa nepovažovalo za nežiaduce. Celkovo boli účinky súvisiace s podávaním fingolimodu u mladých zvierat porovnateľné
s účinkami pozorovanými u dospelých potkanov pri podobných veľkostiach dávok, s výnimkou zmien hustoty minerálov v kostiach a neurobehaviorálnej poruchy (znížená úľaková reakcia na sluchový podnet), ktoré sa pozorovali pri dávkach 1,5 mg/kg a vyšších u mladých zvierat, ako aj neprítomnosťou hypertrofie hladkého svalstva v pľúcach mladých potkanov.
Hodnotenie environmentálneho rizika (ERA)
Riziko pre životné prostredie spôsobené užívaním Gilenye pacientmi s relapsujúcou sclerosis
multiplex sa neočakáva.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Gilenya 0,25 mg tvrdé kapsuly
Obsah kapsuly
Manitol Hydroxypropylcelulóza Hydroxypropylbetadex Stearan horečnatý
Telo kapsuly
Želatína
Oxid titaničitý (E171) Žltý oxid železitý (E172)
Atr ament na pot l ač
Šelak (E904)
Čierny oxid železitý (E172)
Propylénglykol (E1520)
Amoniak, koncentrovaný roztok (E527)
G
il
enya 0,5 mg tvrdé kapsuly
O
bsah kapsuly
Manitol
Stearan horečnatý
Telo kapsuly
Želatína
Oxid titaničitý (E171) Žltý oxid železitý (E172)
Atr ament na pot l ač Šelak (E904) Etanol, bezvodý Izopropylalkohol Butylalkohol
Propylénglykol (E1520)
Čistená voda
Amoniak, koncentrovaný roztok (E527) Hydroxid draselný
Čierny oxid železitý (E172) Žltý oxid železitý (E172) Oxid titaničitý (E171) Dimetikón
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
Gilenya 0,25 mg tvrdé kapsuly
18 mesiacov
Gilenya 0,5 mg tvrdé kapsuly
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 25°C.
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
G
il
enya 0,25 mg tvrdé kapsuly
PVC/PVDC/hliníkové blistrové balenia obsahujúce 28 tvrdých kapsúl.
PVC/PVDC/hliníkové perforované blistrové balenie s jednotlivými dávkami obsahujúce 7x 1 tvrdú kapsulu.
Gilenya 0,5 mg tvrdé kapsulyPVC/PVDC/hliníkové blistrové balenia obsahujúce 7, 28 alebo 98 tvrdých kapsúl alebo spoločné
balenia obsahujúce 84 (3 balenia po 28) tvrdých kapsúl.
PVC/PVDC/hliníkové perforované blistrové balenie s jednotlivými dávkami obsahujúce 7x 1 tvrdú kapsulu.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Írsko
8. REGISTRAČNÉ ČÍSLAGilenya 0,25 mg tvrdé kapsulyEU/1/11/677/007-008
Gilenya 0,5 mg tvrdé kapsulyEU/1/11/677/001-006
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 17. marec 2011
Dátum posledného predĺženia registrácie: 23. november 2015
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu