
na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Osoby s precitlivenosťou po predchádzajúcom podaní očkovacej látky Gardasil 9 alebo
Gardasil/Silgard nesmú dostať Gardasil 9.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pri rozhodovaní o očkovaní jedinca sa má brať do úvahy riziko predchádzajúcej expozície HPV
a možný prínos z očkovania.
Pre prípad zriedkavých anafylaktických reakcií po podaní očkovacej látky musí byť, tak ako pri všetkých injekčne podávaných očkovacích látkach, vždy pohotovo k dispozícii príslušná liečba a zdravotný dohľad.
Ako psychogénna odpoveď na vpichnutie injekčnej ihly môže najmä u dospievajúcich osôb po akomkoľvek očkovaní alebo dokonca pred očkovaním dôjsť k synkope (mdlobe), niekedy spojenej s pádom. Toto môže byť sprevádzané niekoľkými neurologickými znakmi, ako napr. prechodné
poruchy zraku, parestézia a tonicko-klonické kŕče končatiny počas zotavovania sa. Očkované osoby sa preto majú po očkovaní sledovať počas približne 15 minút. Je dôležité zabezpečiť opatrenia, aby sa
predišlo poraneniu pri páde.
Očkovanie sa má odložiť u osôb s akútnym ťažkým febrilným ochorením. Prítomnosť miernej infekcie, ako je ľahká infekcia horných dýchacích ciest alebo nižšia horúčka, však nie je kontraindikáciou pre imunizáciu.
Tak ako pri iných očkovacích látkach, očkovanie očkovacou látkou Gardasil 9 nemusí viesť k ochrane u všetkých očkovaných osôb.
Očkovacia látka bude chrániť len proti ochoreniam, ktoré sú spôsobené typmi HPV, na ktoré je očkovacia látka zacielená (pozri časť 5.1). Preto sa má pokračovať v používaní príslušných opatrení proti sexuálne prenosným chorobám.
Očkovacia látka je len na profylaktické použitie a nemá žiadny účinok na aktívne infekcie spôsobené HPV alebo preukázané klinické ochorenie. Liečebný účinok sa u očkovacej látky nepreukázal. Očkovacia látka preto nie je indikovaná na liečbu cervikálneho, vulválneho, vaginálneho a análneho karcinómu, cervikálnych, vulválnych, vaginálnych a análnych dysplastických lézií vysokého stupňa alebo genitálnych bradavíc. Takisto nie je určená na prevenciu progresie iných zistených lézií súvisiacich s HPV.
Gardasil 9 nezabráni vzniku lézií spôsobených vakcínovým typom HPV u osôb, ktoré sú v čase očkovania infikované daným typom HPV.
Očkovanie nie je náhradou rutinného cervikálneho skríningu. Keďže žiadna očkovacia látka nie je
100 % účinná a Gardasil 9 nezabezpečuje ochranu proti každému typu HPV alebo proti infekciám
HPV prítomným v čase očkovania, rutinný cervikálny skríning zostáva zásadne dôležitý a má sa riadiť národnými odporúčaniami.
Neexistujú žiadne údaje týkajúce sa použitia očkovacej látky Gardasil 9 u osôb s poškodenou schopnosťou imunitnej odpovede. Bezpečnosť a imunogenita očkovacej látky qHPV sa hodnotili u osôb vo veku 7 až 12 rokov, o ktorých bolo známe, že sú infikované vírusom ľudskej imunodeficiencie (HIV) (pozri časť 5.1).
Osoby s poškodenou schopnosťou imunitnej odpovede, buď v dôsledku používania silnej imunosupresívnej liečby, genetickej poruchy, infekcie vírusom ľudskej imunodeficiencie (HIV) alebo z iných príčin, nemusia odpovedať na očkovaciu látku.
Táto očkovacia látka sa má podávať s opatrnosťou osobám s trombocytopéniou alebo akoukoľvek koagulačnou poruchou, pretože u týchto osôb môže dôjsť po intramuskulárnom podaní ku krvácaniu.
Na určenie dĺžky trvania ochrany prebiehajú v súčasnosti štúdie dlhodobého sledovania. (Pozri časť
5.1.).
Neexistujú žiadne údaje o bezpečnosti, imunogenite alebo účinnosti na podporu zameniteľnosti očkovacej látky Gardasil 9 s dvojvalentnými alebo štvorvalentnými očkovacími látkami proti HPV.
4.5 Liekové a iné interakcie
Bezpečnosť a imunogenita u osôb, ktoré dostali imunoglobulín alebo krvné deriváty počas 3 mesiacov pred očkovaním, sa v klinických skúšaniach neskúmali.
Použitie sinýmiočkovacímilátkami
Gardasil 9 sa môže podať súbežne s posilňovacou dávkou kombinovanej očkovacej látky proti záškrtu
(d) a tetanu (T) a buď čiernemu kašľu [nebunková komponentná] (ap) a/alebo detskej obrne
[inaktivovaná] (IPV) (očkovacie látky dTap, dT-IPV, dTap-IPV) bez signifikantného ovplyvnenia protilátkovej odpovede na ktorúkoľvek zložku oboch očkovacích látok. Toto pozorovanie je založené
na výsledkoch z klinického skúšania, v ktorom sa kombinovaná očkovacia látka dTap-IPV podávala
súbežne s prvou dávkou očkovacej látky Gardasil 9 (pozri časť 4.8).
Použitie shormonálnymikontraceptívami
V klinických štúdiách 60,2 % žien vo veku 16 až 26 rokov, ktoré dostali očkovaciu látku Gardasil 9,
užívalo počas očkovacieho obdobia klinických štúdií hormonálne kontraceptíva. Použitie hormonálnych kontraceptív nejavilo vplyv na typovo špecifické imunitné odpovede na Gardasil 9.
4.6 Fertilita, gravidita a laktácia
Gravidita
Veľké množstvo údajov u gravidných žien (viac ako 1 000 pôrodov) nenaznačuje žiadnu malformačnú
ani fetálnu/neonatálnu toxicitu očkovacej látky Gardasil 9 (pozri časť 5.1). Štúdie na zvieratách nenaznačujú reprodukčnú toxicitu (pozri časť 5.3).
Tieto údaje sa však považujú za nedostatočné na odporúčanie použitia očkovacej látky Gardasil 9
počas gravidity. Očkovanie sa má odložiť až do ukončenia gravidity (pozri časť 5.1).
Dojčenie
Gardasil 9 sa môže používať počas laktácie.
Počas očkovacieho obdobia klinických štúdií s očkovacou látkou Gardasil 9 dojčilo celkom 92 žien.
V štúdiách bola imunogenita očkovacej látky porovnateľná medzi dojčiacimi matkami a ženami, ktoré nedojčili. Okrem toho, profil nežiaducich skúseností u dojčiacich žien bol porovnateľný s profilom
u žien v celkovej populácii, v ktorej sa hodnotila bezpečnosť. U dojčiat, ktoré boli dojčené počas
očkovacieho obdobia, sa nehlásili žiadne závažné nežiaduce skúsenosti súvisiace s očkovacou látkou.
Fertilita
K dispozícii nie sú žiadne údaje týkajúce sa účinku očkovacej látky Gardasil 9 na fertilitu u ľudí.
Štúdie na zvieratách nenaznačujú žiadne škodlivé účinky na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Gardasil 9 nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá alebo obsluhovať stroje. Niektoré účinky uvedené v časti 4.8 „Nežiaduce účinky“ však môžu dočasne ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
A. Súhrnbezpečnostnéhoprofilu
V 7 klinických skúšaniach sa jedincom podala očkovacia látka Gardasil 9 v deň zaradenia do štúdie
a následne približne po 2 a 6 mesiacoch. Bezpečnosť sa hodnotila pomocou dohľadu s použitím karty hlásenia o očkovaní (vaccination report card, VRC) počas 14 dní po každom podaní injekcie
očkovacej látky Gardasil 9. Očkovaciu látku Gardasil 9 dostalo celkovo 15 776 osôb (10 495 osôb vo veku 16 až 26 rokov a 5 281 dospievajúcich vo veku 9 až 15 rokov v čase zaradenia do štúdie).
Niekoľko osôb (0,1%) prerušilo skúšky v dôsledku nežiaducich skúseností.
Najčastejšími nežiaducimi reakciami pozorovanými pri očkovacej látke Gardasil 9 boli nežiaduce reakcie v mieste podania injekcie (84,8 % očkovaných osôb počas 5 dní po ktorejkoľvek návšteve
z dôvodu očkovania) a bolesť hlavy (13,2 % očkovaných osôb počas 15 dní po ktorejkoľvek návšteve
z dôvodu očkovania). Tieto nežiaduce reakcie boli zvyčajne miernej až stredne závažnej intenzity.
B. Tabuľkovýsúhrnnežiaducichreakcií
Klinickéskúšania
Nežiaduce reakcie, považované aspoň za možno súvisiace s očkovaním, boli zoradené do kategórií
podľa frekvencie.
Frekvencie sú hlásené ako:
- Veľmi časté (≥ 1/10)
- Časté (≥ 1/100 až < 1/10)
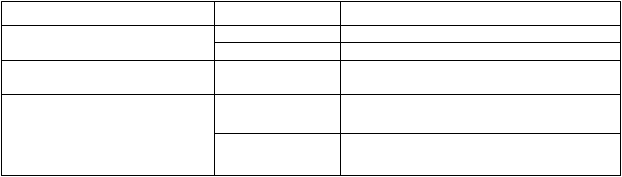
Tabuľka 1: Nežiaduce reakcie po podaní očkovacej látky Gardasil 9 objavujúce sa v klinických skúšaniach s frekvenciou aspoň 1,0 %
Trieda orgánových systémov Frekvencia Nežiaduca reakcia
Poruchy nervového systému Veľmi časté bolesť hlavy
Časté závrat
Poruchy gastrointestinálneho traktu
Celkové poruchy a reakcie v mieste podania
Časté nauzea
Veľmi časté v mieste podania injekcie: bolesť, opuch, erytém
Časté pyrexia, únava,
v mieste podania injekcie: pruritus, podliatina
V klinickom skúšaní u 1 053 zdravých dospievajúcich osôb vo veku 11 až 15 rokov sa preukázalo, že
pri súbežnom podaní prvej dávky očkovacej látky Gardasil 9 s posilňovacou dávkou kombinovanej očkovacej látky proti záškrtu, tetanu, čiernemu kašľu [nebunková komponentná] a detskej obrne
[inaktivovaná] sa hlásilo viac reakcií v mieste podania (opuch, erytém), bolesť hlavy a pyrexia.
Pozorované rozdiely boli < 10 % a u väčšiny osôb bola intenzita nežiaducich udalostí hlásená ako mierna až stredne silná (pozri časť 4.5).
Skúsenosti pouvedenínatrhNasledujúce nežiaduce skúsenosti boli spontánne hlásené počas používania očkovacej látky qHPV po
jej uvedení na trh a môžu sa tiež pozorovať pri očkovacej látke Gardasil 9 po jej uvedení na trh. Skúsenosť s bezpečnosťou očkovacej látky qHPV po jej uvedení na trh súvisí s očkovacou látkou Gardasil 9, pretože očkovacie látky obsahujú L1 proteíny 4 rovnakých typov HPV.
Pretože sa tieto udalosti hlásili dobrovoľne z populácie neznámej veľkosti, nie je možné spoľahlivo odhadnúť ich frekvenciu alebo stanoviť kauzálny vzťah k expozícii očkovacej látke pri všetkých
udalostiach.
Infekcie a nákazy: celulitída v mieste podania injekcie.
Poruchy krvi a lymfatického systému: idiopatická trombocytopenická purpura, lymfadenopatia. Poruchy imunitného systému: reakcie z precitlivenosti vrátane anafylaktických/anafylaktoidných
reakcií, bronchospazmus a urtikária.
Poruchy nervového systému: akútna diseminovaná encefalomyelitída, Guillainov-Barrého syndróm, synkopa niekedy sprevádzaná tonicko-klonickými kŕčmi.
Poruchy gastrointestinálneho traktu: vracanie.
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva: artralgia, myalgia. Celkové poruchy a reakcie v mieste podania: asténia, triaška, nevoľnosť.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
PríloheV.4.9 PredávkovanieNeboli hlásené žiadne prípady predávkovania.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: očkovacie látky, papilomavírusové očkovacie látky, ATC kód: J07BM03
Mechanizmus účinkuGardasil 9 je adjuvantná neinfekčná rekombinantná 9-valentná očkovacia látka. Je pripravená
z vysoko purifikovaných častíc podobných vírusu (VLP) hlavného kapsidového L1 proteínu
z rovnakých štyroch typov HPV (6, 11, 16, 18) nachádzajúcich sa v qHPV očkovacej látke a z 5
ďalších typov HPV (31, 33, 45, 52, 58). Použité je v nej rovnaké adjuvans amorfný síran hydroxyfosforečnanu hlinitého ako v očkovacej látke qHPV. VLP nemôžu infikovať bunky, reprodukovať sa, ani spôsobiť ochorenie. Predpokladá sa, že účinnosť očkovacích látok s L1 VLP je sprostredkovaná vznikom humorálnej imunitnej odpovede. Genotypy očkovacej látky pozostávajúcej z typov HPV 6, 11, 16, 18, 31, 33, 45, 52, 58 budú označované ako typy HPV očkovacej látky.
Na základe epidemiologických štúdií sa predpokladá, že očkovacia látka Gardasil 9 chráni pred typmi HPV, ktoré spôsobujú približne: 90 % cervikálnych karcinómov, viac ako 95 % adenokarcinómov
in situ (AIS), 75 - 85 % cervikálnych intraepiteliálnych neoplázií vysokého stupňa (CIN 2/3), 85 - 90 % vulválnych karcinómov súvisiacich s HPV, 90 - 95 % vulválnych intraepiteliálnych neoplázií vysokého stupňa (VIN 2/3) súvisiacich s HPV, 80 - 85 % vaginálnych karcinómov súvisiacich s HPV,
75 - 85 % vaginálnych intraepiteliálnych neoplázií vysokého stupňa (VaIN 2/3) súvisiacich s HPV, 90
- 95 % análnych karcinómov súvisiacich s HPV, 85 - 90 % análnych intraepiteliálnych neoplázií vysokého stupňa (AIN 2/3) súvisiacich s HPV a 90 % genitálnych bradavíc.
Indikácia očkovacej látky Gardasil 9 je založená na:
· neinferiórnej imunogenite medzi očkovacou látkou Gardasil 9 a očkovacou látkou qHPV pri
HPV typoch 6, 11, 16 a 18 u dievčat vo veku 9 až 15 rokov, žien a mužov vo veku 16 až 26 rokov; preto je možné odvodiť, že účinnosť očkovacej látky Gardasil 9 proti perzistentnej infekcii a ochoreniu súvisiaceho s typmi HPV 6, 11, 16 alebo 18 je porovnateľná s účinnosťou očkovacej látky qHPV.
· preukázaní účinnosti proti perzistentnej infekcii a ochoreniu súvisiaceho s typmi HPV 31, 33,
45, 52 a 58 u dievčat a žien vo veku 16 až 26 rokov a
· preukázaní neinferiórnej imunogenity proti vakcínovým typom HPV očkovacej látky Gardasil 9
u chlapcov a dievčat vo veku 9 až 15 rokov a mužov vo veku 16 až 26 rokov v porovnaní s dievčatami a ženami vo veku 16 až 26 rokov.
Klinické štúdiepriočkovacejlátkeGardasil9
Účinnosť a/alebo imunogenita očkovacej látky Gardasil 9 sa hodnotili v ôsmich klinických štúdiách.
Klinické štúdie hodnotiace účinnosť očkovacej látky Gardasil 9 oproti placebu neboli prijateľné, pretože v mnohých krajinách je očkovanie proti HPV odporúčané a zavedené na ochranu proti infekcii
a ochoreniu spôsobených HPV.
Preto sa v pivotnej klinickej štúdii (Protokol 001) hodnotila účinnosť očkovacej látky Gardasil 9
v porovnaní s očkovacou látkou qHPV.
Účinnosť proti HPV typom 6, 11, 16 a 18 sa primárne hodnotila s použitím stratégie prepojenia, pri ktorej sa preukázala porovnateľná imunogenita (meraná pomocou geometrického priemeru titrov
[GMT]) očkovacej látky Gardasil 9 v porovnaní s očkovacou látkou qHPV (Protokol 001, GDS01C/Protokol 009 a GDS07C/Protokol 020).
V pivotnej štúdii Protokol 001 sa účinnosť očkovacej látky Gardasil 9 proti typom HPV 31, 33, 45, 52
a 58 hodnotila v porovnaní s očkovacou látkou qHPV u žien vo veku 16 až 26 rokov (N = 14 204:
7 099 dostalo očkovaciu látku Gardasil 9; 7 105 dostalo očkovaciu látku qHPV).
V Protokole 002 sa hodnotila imunogenita očkovacej látky Gardasil 9 u dievčat a chlapcov vo veku 9 až 15 rokov a u žien vo veku 16 až 26 rokov (N = 3 066; 1 932 dievčat; 666 chlapcov a 468 žien dostalo očkovaciu látku Gardasil 9).
V Protokole 003 sa hodnotila imunogenita očkovacej látky Gardasil 9 u mužov vo veku 16 až 26 rokov a u žien vo veku 16 až 26 rokov (očkovaciu látku Gardasil 9 dostalo 1 103 heterosexuálnych mužov [HM], 313 mužov, ktorí mali pohlavný styk s mužom [MSM] a 1 099 žien).
V Protokoloch 005 a 007 sa hodnotilo podanie očkovacej látky Gardasil 9 súbežne s obvykle odporúčanými očkovacími látkami u dievčat a chlapcov vo veku 11 až 15 rokov (N = 2 295).
V Protokole 006 sa hodnotilo podanie očkovacej látky Gardasil 9 u dievčat a žien vo veku 12 až 26 rokov, ktoré boli predtým očkované očkovacou látkou qHPV (N = 921; 615 dostalo očkovaciu látku Gardasil 9 a 306 dostalo placebo).
V GDS01C/Protokole 009 sa hodnotila imunogenita očkovacej látky Gardasil 9 u dievčat vo veku 9 až
15 rokov (N = 600; 300 dostalo očkovaciu látku Gardasil 9 a 300 dostalo očkovaciu látku qHPV).
V GDS07C/Protokole 020 sa hodnotila imunogenita očkovacej látky Gardasil 9 u mužov vo veku 16
až 26 rokov (N = 500; 249 dostalo očkovaciu látku Gardasil 9 a 251 dostalo očkovaciu látku qHPV).
V Protokole 010 sa hodnotila imunogenita 2 dávok očkovacej látky Gardasil 9 u dievčat a chlapcov vo veku 9 až 14 rokov a 3 dávok očkovacej látky Gardasil 9 u dievčat vo veku 9 až 14 rokov a u žien vo veku 16 až 26 rokov (N = 1 518; 753 dievčat; 451 chlapcov a 314 žien).
Štúdie podporujúce účinnosť očkovacej látky Gardasil 9 proti typom HPV 6, 11, 16, 18
Účinnosť očkovacej látky qHPV proti typom HPV 6, 11, 16, 18
Účinnosť a dlhodobá efektivita očkovacej látky qHPV na cieľové ukazovatele ochorení súvisiacich s typmi HPV 6, 11, 16 a 18 boli preukázané v klinických štúdiách v populácii PPE (perprotokolová efektivita). Populácia PPE pozostávala z osôb, ktoré dostali všetky 3 očkovania očkovacou látkou qHPV v základnej štúdii počas 1 roka od zaradenia do štúdie, nemali veľké odchýlky od protokolu štúdie, boli pred 1. dávkou séronegatívne na príslušný typ (príslušné typy) HPV (typy 6, 11, 16 a 18) a v skupine osôb vo veku 16 rokov a viac v čase zaradenia do základnej štúdie, mali negatívny výsledok PCR na príslušný typ (príslušné typy) HPV pred 1. dávkou až 1 mesiac po 3. dávke (7. mesiac).
U žien vo veku 16 až 26 rokov (N = 20 541) bola účinnosť proti CIN 2/3, AIS alebo rakovine krčka maternice súvisiacim s typmi HPV 16 a 18 98,2 % (95% IS: 93,5; 99,8) na základe sledovania až do 4 rokov (medián 3,6 rokov); účinnosť proti ochoreniam súvisiacim s typmi HPV 6, 11, 16 alebo 18 bola pre CIN alebo AIS 96,0 % (95% IS: 92,3; 98,2), pre VIN 2/3 100 % (95% IS: 67,2; 100), pre VaIN 2/3
100 % (95% IS: 55,4; 100) a pre genitálne bradavice 99,0 % (95% IS: 96,2; 99,9).
U žien vo veku 24 až 45 rokov (N = 3 817) bola účinnosť proti pretrvávajúcej infekcii, genitálnym bradaviciam, vulválnym a vaginálnym léziám, CIN akéhokoľvek stupňa, AIS a rakovinám krčka maternice súvisiacim s typmi HPV 6, 11, 16 a 18 88,7 % (95% IS: 78,1; 94,8).
U mužov vo veku 16 až 26 rokov (N = 4 055) bola účinnosť proti ochoreniam súvisiacim s typmi HPV
6, 11, 16 alebo 18 pre AIN 2/3 74,9 % (95% IS: 8,8; 95,4) (medián dĺžky sledovania 2,15 rokov), pre
PIN 1/2/3 100,0% (95% IS: -52,1; 100) a pre genitálne bradavice 89.3 % (95% IS: 65,3; 97,9) (medián dĺžky sledovania 4 roky).
V dlhodobej rozšírenej registračnej štúdii u žien vo veku 16 až 23 rokov (N = 2 084) sa nepozorovali žiadne prípady CIN vysokého stupňa po dobu až do približne 12 rokov. Pretrvávajúca ochrana bola
v tejto štúdii štatisticky preukázaná po dobu približne 10 rokov.
V dlhodobých rozšíreniach klinických štúdií sa nepozorovali žiadne prípady intraepiteliálnej neoplázie vysokého stupňa a žiadne prípady genitálnych bradavíc:
- počas 10,7 rokov u dievčat (N = 369) a 10,6 rokov u chlapcov (N = 326), ktorí boli v čase
očkovania vo veku 9 až 15 rokov (medián sledovania 10,0 rokov a 9,9 rokov, v uvedenom poradí);
- počas 11,5 rokov u mužov (N = 917), ktorí boli v čase očkovania vo veku 16 až 26 rokov
(medián sledovania 9,5 rokov); a počas 10,1 rokov u žien (N = 685), ktoré boli v čase očkovania vo veku 24 až 45 rokov (medián sledovania 8,7 rokov).
Prepojenie imunogenity z očkovacej látky qHPV na Gardasil 9 pre typy HPV 6, 11, 16, 18
Porovnanie očkovacej látky Gardasil 9 s očkovacou látkou qHPV ohľadne typov HPV 6, 11, 16 a 18 sa vykonalo v populácii žien vo veku 16 až 26 rokov z Protokolu 001, dievčat vo veku 9 až 15 rokov z GDS01C/Protokolu 009 a mužov vo veku 16 až 26 rokov z GDS07C/Protokolu 020.
Štatistická analýza neinferiority sa vykonala v 7. mesiaci a porovnávala GMT cLIA anti-HPV 6, anti- HPV 11, anti-HPV 16 a anti-HPV 18 medzi osobami, ktorým sa podala očkovacia látka Gardasil 9
a osobami, ktorým sa podala očkovacia látka Gardasil. Imunitné odpovede, merané pomocou GMT,
boli pri očkovacej látke Gardasil 9 neinferiórne voči imunitným odpovediam pri očkovacej látke Gardasil (tabuľka 2). V klinických štúdiách sa 98,2 % až 100 % osôb, ktoré dostali očkovaciu látku Gardasil 9, stalo do 7. mesiaca séropozitívnych na protilátky proti všetkým 9 typom v očkovacej látke vo všetkých skúmaných skupinách. V Protokole 001 boli GMT pre HPV-6, -11, -16 a -18 porovnateľné u osôb, ktoré dostali očkovaciu látku qHPV alebo Gardasil 9 počas minimálne 3,5 rokov.
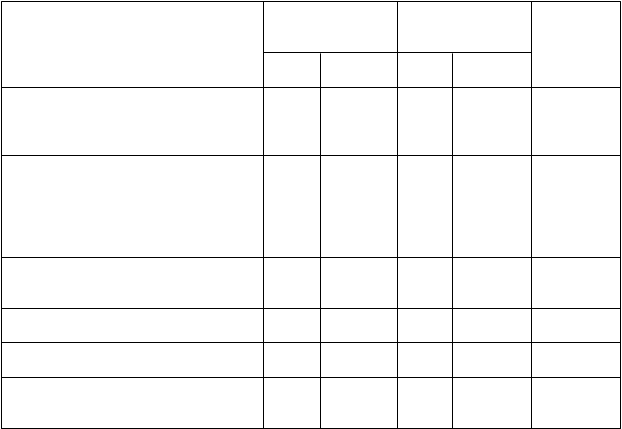
Tabuľka 2: Porovnanie imunitných odpovedí (na základe cLIA) medzi očkovacou látkou Gardasil 9 a očkovacou látkou qHPV pri typoch HPV 6, 11, 16 a 18 v populácii PPI (perprotokolová imunogenita)* dievčat vo veku 9 až 15 rokov a žien a mužov vo veku 16 až 26 rokov
Gardasil 9/
POPULÁCIA
Gardasil 9 očkovacia látka qHPV
očkovacia látka qHPV
Anti-HPV 6
Dievčatá vo
N (n)
300
GMT
(95 % IS)
mMU§/ml
1 679,4
N (n)
300
GMT
(95 % IS)
mMU§/ml
1 565,9
Pomer #
GMT (95 % IS)
veku 9 až 15
rokov
Ženy vo veku
16 až 26
rokov
Muži vo veku
(273)
6 792 (3 993)
(1 518,9; 1 856,9)
893,1 (871,7; 915,1)
(261)
6 795 (3 975)
(1 412,2; 1 736,3) 1,07 (0,93; 1,23)
875,2 1,02 (0,99; 1,06)¶
(854,2; 896,8)
16 až 26
rokov
Anti-HPV 11
Dievčatá vo veku 9 až 15 rokov
Ženy vo veku
16 až 26
rokov
Muži vo veku
16 až 26
rokov
Anti-HPV 16
Dievčatá vo
249
(228)
300 (273)
6 792 (3 995)
249 (228)
300
758,3
(665,9; 863,4)
1 315,6
(1 183,8; 1 462,0)
666,3 (649,6; 683,4)
681,7 (608,9; 763,4)
6 739,5
251
(226)
300 (261)
6 795 (3 982)
251 (226)
300
618,4
(554,0; 690,3)
1 417,3
(1 274,2; 1 576,5)
830,0 (809,2; 851,4)
769,1 (683,5; 865,3)
6 887,4
1,23 (1,04; 1,45)¶
0,93 (0,80; 1,08)
0,80 (0,77; 0,83)¶
0,89 (0,76; 1,04)¶
¶
veku 9 až 15
rokov
Ženy vo veku
16 až 26
rokov
Muži vo veku
(276)
6 792 (4 032)
249
(6 134,5; 7 404,1)
3 131,1
(3 057,1; 3 206,9)
3 924,1
(270)
6 795 (4 062)
251
(6 220,8; 7 625,5) 0,97 (0,85; 1,11)
3 156,6 ¶
(3 082,3; 3 232,7) 0,99 (0,96; 1,03)
3 787,9
16 až 26
rokov
Anti-HPV 18
Dievčatá vo veku 9 až 15 rokov
Ženy vo veku
16 až 26
rokov
Muži vo veku
(234)
300 (276)
6 792 (4 539)
249
(3 513,8; 4 382,3)
1 956,6
(1 737,3; 2 203,7)
804,6 (782,7; 827,1)
884,3
(237)
300 (269)
6 795 (4 541)
251
(3 378,4; 4 247,0)
1 795,6
(1 567,2; 2 057,3)
678,7 (660,2; 697,7)
790,9
1,04 (0,89; 1,21)¶
1,08 (0,91; 1,29)¶
1,19 (1,14; 1,23)¶
¶
16 až 26
rokov
(234)
(766,4; 1 020,4)
(236)
(683,0; 915,7) 1,12 (0,91; 1,37)

*Populácia PPI pozostávala z osôb, ktoré dostali všetky 3 očkovania vo vopred stanovenom časovom rozmedzí, nemali veľké odchýlky od protokolu štúdie, splnili vopred stanovené požiadavky na interval návštevy medzi 6.
a 7. mesiacom, pred 1. dávkou boli séronegatívne na príslušný typ (príslušné typy) HPV (typy 6, 11, 16 a 18)
a v skupine žien vo veku 16 až 26 rokov mali počas obdobia pred 1. dávkou až po obdobie jeden mesiac po 3. dávke (7. mesiac) negatívny výsledok PCR na príslušný typ (príslušné typy) HPV.
§mMU = jednotky mili-Merck.
¶hodnota p < 0,001.
# Dôkaz neinferiority vyžadoval, aby bola spodná hranica 95 % IS pomeru GMT väčšia ako 0,67.
IS = interval spoľahlivosti.
GMT = geometrický priemer titrov.
cLIA = kompetitívna imunometóda založená na Luminex-e.
N = počet osôb randomizovaných do príslušnej očkovanej skupiny, ktoré dostali aspoň jednu injekciu. n = počet osôb, ktorých údaje boli zahrnuté do analýzy.
Štúdie podporujúce účinnosť očkovacej látky Gardasil 9 proti typom HPV 31, 33, 45, 52 a 58
Účinnosť očkovacej látky Gardasil 9 u žien vo veku 16 až 26 rokov sa hodnotila v dvojito zaslepenej, randomizovanej klinickej štúdii kontrolovanej aktívnym komparátorom (Protokol 001), ktorá zahŕňala celkovo 14 204 žien (Gardasil 9 = 7 099; očkovacia látka qHPV = 7 105). Osoby boli sledované počas až 67 mesiacov po 3. dávke s mediánom trvania 43 mesiacov po 3. dávke.
Očkovacia látka Gardasil 9 bola účinná v predchádzaní perzistentnej infekcii a ochoreniu súvisiacemu s HPV 31, 33, 45, 52 a 58 (tabuľka 3). Očkovacia látka Gardasil 9 tiež znížila výskyt abnormalít v Pap teste, cervikálnych výkonov a výkonov v oblasti vonkajších genitálií (napr. biopsie) a definitívnych cervikálnych liečebných výkonov súvisiacich s HPV 31, 33, 45, 52 a 58 (tabuľka 3).
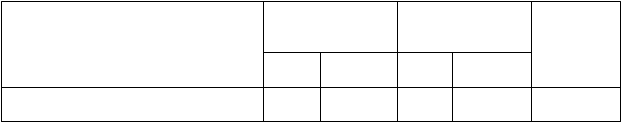
Tabuľka 3: Analýza účinnosti očkovacej látky Gardasil 9 proti typom HPV 31, 33, 45, 52 a 58
v populácii PPE‡ žien vo veku 16 až 26 rokov
Cieľový ukazovateľ ochorenia
Gardasil 9
N = 7 099
n Počet
očkovacia látka qHPV
N = 7 105
Počet
%
účinnosti** (95 % IS)
CIN 2/3, AIS, cervikálny karcinóm,
prípadov* n
prípadov*
VIN 2/3, VaIN 2/3, vulválny karcinóm a vaginálny karcinóm súvisiaci s HPV
31, 33, 45, 52, 58
α
6 016 1 6 017 38 97,4 (85,0; 99,9)
CIN 2/3 alebo AIS súvisiace s HPV 31,
33, 45, 52, 58
α
CIN 2 súvisiace s HPV 31, 33, 45, 52, 58
CIN 3 súvisiace s HPV 31, 33, 45, 52, 58
VIN 2/3, VaIN 2/3 súvisiace s HPV 31,
5 949
5 949
5 949
1 5 943
1 5 943
0 5 943
35 97,1 (83,5; 99,9)
32 96,9 (81,5; 99,8)
7 100 (39,4; 100)
100,0
33, 45, 52, 58 6 009 0 6 012 3
Perzistentná infekcia ≥ 6 mesiacov
súvisiaca s HPV 31, 33, 45, 52, 58§ 5 941 41 5 955 946
Perzistentná infekcia ≥ 12 mesiacov
súvisiaca s HPV 31, 33, 45, 52, 58¶ 5 941 23 5 955 657
ASC-US HR-HPV pozitívna alebo
(-71,5;
100,0)
96,0 (94,6; 97,1)
96,7 (95,1; 97,9)
 horšia abnormalita Pap testu
#
súvisiaca s HPV 31, 33, 45, 52, 58
horšia abnormalita Pap testu
#
súvisiaca s HPV 31, 33, 45, 52, 58
5 883 37 5 882 506 92,9 (90,2; 95,1)
Cieľový ukazovateľ ochorenia
Gardasil 9
N = 7 099
n Počet
očkovacia látka qHPV
N = 7 105
Počet
%
účinnosti** (95 % IS)
Definitívne cervikálne liečebné výkony
prípadov* n
prípadov*
90,2
súvisiace s HPV 31, 33, 45, 52, 58
† 6 013 4 6 014 41
(75,0; 96,8)
‡Populácia PPE pozostávala z osôb, ktoré dostali všetky 3 očkovania počas 1 roka od zaradenia do štúdie, nemali veľké odchýlky od protokolu štúdie, pred 1. dávkou nemali (mali negatívny výsledok PCR a boli séronegatívni) príslušný typ (príslušné typy) HPV (typy 31, 33, 45, 52 a 58) a ktoré mali aj počas jedného mesiaca po 3. dávke
(7. mesiac) negatívny výsledok PCR na príslušný typ (príslušné typy) HPV.
N = počet osôb randomizovaných do príslušnej očkovanej skupiny, ktoré dostali aspoň jednu injekciu. n = počet osôb, ktorých údaje boli zahrnuté do analýzy.
§Perzistentná infekcia detegovaná vo vzorkách z dvoch alebo viacerých po sebe nasledujúcich návštev s odstupom 6 mesiacov (rozostup návštev ±1 mesiac).
¶Perzistentná infekcia detegovaná vo vzorkách z troch alebo viacerých po sebe nasledujúcich návštev s odstupom
6 mesiacov (rozostup návštev ±1 mesiac).
#Papanicolaouvov test.
IS = interval spoľahlivosti.
ASC-US = atypické skvamózne bunky neurčenej významnosti. HR = vysoké riziko.
*Počet osôb s minimálne jednou kontrolnou návštevou po 7. mesiaci.
**Osoby boli sledované počas až 67 mesiacov po 3. dávke (medián 43 mesiacov po 3. dávke).
αV populácii PPE neboli diagnostikované žiadne prípady cervikálneho karcinómu, VIN2/3, vulválneho a vaginálneho karcinómu.
†Výkon slučkovej elektrochirurgickej excízie (LEEP) alebo konizácie.
Ďalšie hodnotenie účinnosti očkovacej látky Gardasil 9 proti typom HPV očkovacej látky Keďže sa účinnosť očkovacej látky Gardasil 9 nemohla hodnotiť oproti placebu, vykonali sa nasledujúce exploratórne analýzy.
HodnotenieúčinnostiočkovacejlátkyGardasil9proticervikálnymochoreniamvysokéhostupňaspôsobenýmtypmiHPVočkovacejlátkyvPPEÚčinnosť očkovacej látky Gardasil 9 proti CIN 2 a horším súvisiacim s typmi HPV očkovacej látky
bola v porovnaní s očkovacou látkou qHPV 94,4 % (95 % IS 78,8; 99,0) s 2/5 952 oproti 36/5 947
prípadom. Účinnosť očkovacej látky Gardasil 9 proti CIN 3 súvisiacim s typmi HPV očkovacej látky bola v porovnaní s očkovacou látkou qHPV 100 % (95 % IS 46,3; 100,0) s 0/5 952 oproti 8/5 947
prípadom.
VplyvočkovacejlátkyGardasil9nacervikálnubiopsiuadefinitívnuliečbusúvisiacustypmiHPVočkovacejlátkyvPPEÚčinnosť očkovacej látky Gardasil 9 proti cervikálnej biopsii súvisiacej s typmi HPV očkovacej látky v porovnaní s očkovacou látkou qHPV bola 95,9 % (95 % IS 92,7; 97,9) s 11/6 016 oproti 262/6 018
prípadom. Účinnosť očkovacej látky Gardasil 9 proti definitívnej cervikálnej liečbe (vrátane výkonu slučkovej elektrochirurgickej excízie [LEEP] alebo konizácie) súvisiacej s typmi HPV očkovacej látky v porovnaní s očkovacou látkou qHPV bola 90,7 % (95 % IS 76,3; 97,0) s 4/6 016 oproti 43/6 018
prípadom.
Štúdie dlhodobej účinnostiBezpečnosť, imunogenita a účinnosť proti klinickým ochoreniam súvisiacim s typmi HPV očkovacej látky sa u podskupiny osôb sleduje 10 až 14 rokov po očkovaní očkovacou látkou Gardasil 9.
V dlhodobých rozšíreniach klinických štúdií Protokolov 001 a 002 sa pozorovala účinnosť v populácii
PPE. Populácia PPE sa skladala z osôb:
- ktoré dostali všetky 3 očkovania v priebehu 1 roka od zaradenia do štúdie, bez veľkých odchýlok od protokolu štúdie,
- ktoré boli pred 1. dávkou séronegatívne na príslušný/é typ/y HPV očkovacej látky a medzi ženami vo veku 16 až 26 rokov, PCR negatívne na príslušný/é typ/y HPV očkovacej látky pred 1. dávkou a až jeden mesiac po 3. dávke (7. mesiac).'
V Protokole 001 registračnej štúdii sa nepozorovali žiadne prípady CIN vysokého stupňa súvisiace
s typmi HPV očkovacej látky po dobu 7,6 rokov po 3. dávke (medián sledovania 4,4 rokov) u žien (n
= 1 782), ktoré boli v čase očkovania očkovacou látkou Gardasil 9 vo veku 16 až 26 rokov.
V Protokole 002 rozšírenej štúdii sa nepozorovali žiadne prípady intraepiteliálnej neoplázie vysokého stupňa alebo genitálnych bradavíc po dobu 6,4 rokov po 3. dávke (medián sledovania 5,9 rokov)
u dievčat (n = 753) alebo chlapcov (n = 227), ktoré/í boli v čase očkovania očkovacou látkou
Gardasil 9 vo veku 9 až 15 rokov.
Imunogenita
Minimálny titer anti-HPV, ktorý poskytuje ochrannú účinnosť, sa nestanovil.
Na hodnotenie imunogenity každého typu HPV v očkovacej látke sa použili typovo špecifické imunologické metódy s typovo špecifickými štandardmi. Tieto metódy stanovovali protilátky proti neutralizačným epitopom pre každý typ HPV. Škály pre tieto metódy sú jedinečné pre každý typ HPV; preto porovnania medzi typmi a inými metódami nie sú vhodné.
Imunitná odpoveď na Gardasil 9 v 7. mesiaci
Imunogenita sa merala prostredníctvom (1) percentuálneho vyjadrenia osôb, ktoré boli séropozitívne na protilátky proti príslušným typom HPV v očkovacej látke a (2) geometrického priemeru titru (GMT).
Gardasil 9 indukoval výrazné anti-HPV 6, anti-HPV 11, anti-HPV 16, anti-HPV 18, anti-HPV 31,
anti-HPV 33, anti-HPV 45, anti-HPV 52 a anti-HPV 58 odpovede merané v 7. mesiaci v Protokoloch
001, 002, 005, 007 a GDS01C/Protokole 009. V klinických štúdiách sa do 7. mesiaca 99,6 % až 100 %
osôb vo všetkých skúmaných skupinách, ktoré dostali očkovaciu látku Gardasil 9, stalo séropozitívnych na protilátky proti všetkým 9 typom. GMT boli vyššie u dievčat a chlapcov ako u žien
vo veku 16 až 26 rokov a vyššie u chlapcov ako u dievčat a žien.
Odpovede proti HPV v 7. mesiaci boli v kombinovanej databáze štúdií imunogenity pre očkovaciu látku Gardasil 9 u dievčat/chlapcov vo veku 9 až 15 rokov porovnateľné s odpoveďami proti HPV u žien vo veku 16 až 26 rokov.
Na základe tohto prepojenia imunogenity sa odvodzuje účinnosť očkovacej látky Gardasil 9 u dievčat a chlapcov vo veku 9 až 15 rokov.
V protokole 003 boli pre typy HPV očkovacej látky GMT anti-HPV protilátok v 7. mesiaci medzi chlapcami a mužmi (HM) vo veku 16 až 26 rokov porovnateľné s GMT anti-HPV protilátok u dievčat a žien vo veku 16 až 26 rokov. U MSM vo veku 16 až 26 rokov sa tiež pozorovala vysoká imunogenita, hoci nižšia ako u HM, podobne ako pri očkovacej látke qHPV. V Protokole
020/GDS07C boli GMT anti-HPV protilátok v 7. mesiaci medzi chlapcami a mužmi (HM) vo veku 16 až 26 rokov porovnateľné s GMT anti-HPV protilátok u chlapcov a mužov (HM) vo veku 16 až 26 rokov, ktorým sa podala očkovacia látka qHPV s HPV typmi 6, 11, 16 a 18. Tieto výsledky podporujú účinnosť očkovacej látky Gardasil 9 v populácii mužov.
U žien vo veku viac ako 26 rokov sa nevykonali žiadne štúdie. U žien vo veku 27 až 45 rokov sa účinnosť očkovacej látky Gardasil 9 proti 4 pôvodným typom predpokladá na základe (1) vysokej účinnosti očkovacej látky qHPV u žien vo veku 16 až 45 rokov a (2) porovnateľnej imunogenity očkovacej látky Gardasil 9 a očkovacej látky qHPV u dievčat a žien vo veku 9 až 26 rokov.
Perzistencia imunitnej odpovede na očkovaciu látku Gardasil 9
V dlhodobom rozšírení sledovania v rámci klinických štúdií Protokol 001 a 002 sa pozorovala perzistencia protilátkovej odpovede:
· počas minimálne 5 rokov u žien, ktoré boli v čase očkovania očkovacou látkou Gardasil 9 vo veku 16 až 26 rokov, v závislosti od typu HPV bolo 78 až 100 % osôb séropozitívnych; účinnosť sa však zachovala u všetkých osôb bez ohľadu na stav séropozitivity pre akýkoľvek
typ HPV v očkovacej látke až do ukončenia štúdie (až do 67 mesiacov po 3. dávke, medián
dĺžky sledovania 43 mesiacov po 3. dávke).
· počas minimálne 5 rokov u dievčat a chlapcov, ktorí boli v čase očkovania očkovacou látkou Gardasil 9 vo veku 9 až 15 rokov, v závislosti od typu HPV bolo 90 až 99 % osôb séropozitívnych.
Dôkaz oanamnestickej(imunitnejpamäti)odpovedi
Dôkaz anamnestickej odpovede sa pozoroval u očkovaných žien, ktoré boli pred očkovaním
séropozitívne na príslušný/é typ/y HPV. Okrem toho, ženy (n = 150), ktoré dostali 3 dávky očkovacej látky Gardasil 9 v Protokole 001 a provokačnú (challenge) dávku o 5 rokov neskôr, vykazovali rýchlu
a silnú anamnestickú odpoveď, ktorá prekročila hodnotu anti-HPV GMT pozorovanú 1 mesiac po
podaní dávky 3.
Podávanie očkovacej látky Gardasil 9 osobám, ktoré boli v minulosti očkované očkovacou látkou qHPV
V Protokole 006 sa hodnotila imunogenita očkovacej látky Gardasil 9 u 921 dievčat a žien (vo veku 12
až 26 rokov), ktoré boli v minulosti očkované očkovacou látkou qHPV. U žien, ktoré dostali Gardasil 9 po podaní 3 dávok očkovacej látky qHPV, bol interval medzi dokončením očkovania očkovacou látkou qHPV a začiatkom očkovania očkovacou látkou Gardasil 9 s režimom 3 dávok najmenej 12 mesiacov (časový interval sa pohyboval v rozmedzí približne od 12 do 36 mesiacov).
Séropozitivita na typy HPV očkovacej látky sa do 7. mesiaca v perprotokolovej populácii u osôb, ktoré dostali Gardasil 9, pohybovala v rozmedzí od 98,3 do 100 %. GMT na typy HPV 6, 11, 16, 18 boli vyššie ako v populácii, ktorá v minulosti nedostala očkovaciu látku qHPV v iných štúdiách, zatiaľ čo GMT na typy HPV 31, 33, 45, 52 a 58 boli nižšie. Klinický význam tohto pozorovania nie je známy.
Imunogenita u osôb infikovaných HIV
U osôb infikovaných HIV sa nevykonala žiadna klinická štúdia s očkovacou látkou Gardasil 9. Štúdia dokumentujúca bezpečnosť a imunogenitu očkovacej látky qHPV sa vykonala u 126 osôb vo
veku 7 až 12 rokov infikovaných HIV s východiskovou hodnotou CD4% ≥ 15 a u osôb s hodnotou
CD4% < 25 užívajúcich vysoko účinnú antiretrovírusovú liečbu (highly active antiretroviral therapy, HAART) počas najmenej 3 mesiacov (z ktorých 96 dostalo očkovaciu látku qHPV). U viac ako 96 % osôb došlo k sérokonverzii na všetky štyri antigény. GMT (geometrické priemery titrov) boli o niečo nižšie ako tie, ktoré sa hlásili v iných štúdiách u osôb v tom istom veku, ktoré neboli infikované HIV. Klinický význam nižšej odpovede nie je známy. Bezpečnostný profil bol podobný profilu u osôb
v iných štúdiách, ktoré neboli infikované HIV. Očkovanie nemalo vplyv na CD4% ani RNA HIV
v plazme.
Imunitné odpovede na očkovaciu látku Gardasil 9 pri použití 2-dávkovej očkovacej schémy u osôb vo veku 9 až 14 rokov
V Protokole 010 sa merali HPV protilátkové odpovede na 9 typov HPV po očkovaní očkovacou látkou
Gardasil 9 v nasledujúcich kohortách: dievčatá a chlapci vo veku 9 až 14 rokov, ktorí dostali 2 dávky v 6-mesačnom alebo 12-mesačnom intervale (+/- 1 mesiac); dievčatá vo veku 9 až 14 rokov, ktoré
dostali 3 dávky (v 0., 2., 6. mesiaci); a ženy vo veku 16 až 26 rokov, ktoré dostali 3 dávky (v 0., 2., 6. mesiaci).
Mesiac po poslednej dávke prideleného režimu sa 97,9 % až 100 % osôb vo všetkých skupinách stalo séropozitívnych na protilátky proti 9 vakcínovým typom HPV. GMT boli vyššie u dievčat a chlapcov, ktorí dostali dve dávky očkovacej látky Gardasil 9 (buď v 0., 6. mesiaci alebo 0., 12. mesiaci) ako
u dievčat a žien vo veku 16 až 26 rokov, ktoré dostali 3 dávky očkovacej látky Gardasil 9 (v 0., 2., 6. mesiaci) pre každý z 9 vakcínových typov HPV. Na základe prepojenia imunogenity sa odvodzuje
účinnosť 2-dávkovej schémy očkovacej látky Gardasil 9 u dievčat a chlapcov vo veku 9 až 14 rokov.
V tej istej štúdii boli u dievčat a chlapcov vo veku 9 až 14 rokov mesiac po poslednej dávke očkovacej látky GMT numericky nižšie pre niektoré vakcínové typy po 2-dávkovej očkovacej schéme ako po 3- dávkovej očkovacej schéme (napr. typy HPV 18, 31, 45 a 52 po 0, 6 mesiacoch a typ HPV 45 po 0, 12 mesiacoch). Klinický význam týchto zistení nie je známy.
U dievčat a chlapcov, ktorí dostali 2 dávky v 6- alebo 12- mesačnom intervale (+/- 1 mesiac), bola
v 36. mesiaci preukázaná perzistencia protilátkovej odpovede; v závislosti od typu HPV bolo 81 % až
99 % dievčat a chlapcov, ktorí dostali 2 dávky v 6-mesačnom intervale a 88% až 100% dievčat
a chlapcov, ktorí dostali 2 dávky v 12-mesačnom intervale séropozitívnych. V 36. mesiaci bolo GMT u dievčat a chlapcov vo veku 9 až 14 rokov, ktorí dostali 2 dávky v 6-mesačnom intervale (+/- 1 mesiac) neinferiórne ku GMT u žien vo veku 16 až 26 rokov, ktoré dostali 3 dávky očkovacej látky Gardasil 9.
V klinickom skúšaní bola perzistencia protilátkovej odpovede u dievčat vo veku 9 až 13 rokov, ktoré dostali 2 dávky očkovacej látky qHPV, preukázaná po dobu najmenej 5 rokov.
Čas trvania ochrany 2-dávkovej očkovacej schémy očkovacej látky Gardasil 9 sa nestanovil. Gravidita
Špecifické štúdie očkovacej látky Gardasil 9 sa u gravidných žien nevykonali. Počas programu
klinického vývoja očkovacej látky Gardasil 9 sa na aktívnu kontrolu použila očkovacia látka qHPV.
Počas klinického vývoja očkovacej látky Gardasil 9 sa u 2 586 žien (1 347 v skupine s očkovacou látkou Gardasil 9 vs. 1 239 v skupine s očkovacou látkou qHPV) hlásila najmenej jedna gravidita. Typy anomálií alebo podiel gravidít s nežiaducim výsledkom u žien, ktoré dostali očkovaciu látku Gardasil 9 alebo qHPV, boli porovnateľné a v súlade s bežnou populáciou.
5.2 Farmakokinetické vlastnosti
Neaplikovateľné.
5.3 Predklinické údaje o bezpečnosti
Štúdia toxicity po opakovanej dávke na potkanoch, ktorá zahŕňala vyhodnotenie toxicity jednorazovej dávky a miestnu toleranciu, neodhalila žiadne osobitné riziko pre ľudí.
Podanie očkovacej látky Gardasil 9 samiciam potkana nemalo žiadne účinky na reprodukčný výkon, fertilitu alebo embryonálny/fetálny vývin.
Podanie očkovacej látky Gardasil 9 samiciam potkana nemalo žiadne účinky na vývin, správanie, reprodukčný výkon alebo fertilitu mláďat. Protilátky proti všetkým 9 typom HPV sa počas gravidity a laktácie preniesli na potomstvo.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Chlorid sodný L-histidín Polysorbát 80
Bórax
Voda na injekciu
Adjuvans, pozri časť 2.
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Gardasil 9 injekčná suspenzia:
Uchovávajte v chladničke (pri teplote 2 °C - 8 °C).
Neuchovávajte v mrazničke. Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Gardasil 9 sa má podať hneď ako je to možné po vybratí z chladničky.
Údaje týkajúce sa stability naznačujú, že zložky očkovacej látky sú stabilné počas 72 hodín, ak sa očkovacia látka uchováva pri teplote od 8 °C do 25 °C alebo od 0 °C do 2 °C. Po uplynutí tohto času sa má očkovacia látka Gardasil 9 použiť alebo zlikvidovať. Tieto údaje sú určené len na usmernenie zdravotníckych pracovníkov v prípade dočasnej odchýlky teploty.
Gardasil 9 injekčnásuspenziavnaplnenejinjekčnejstriekačke:
Uchovávajte v chladničke (pri teplote 2 °C - 8 °C).
Neuchovávajte v mrazničke. Naplnenú injekčnú striekačku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Gardasil 9 sa má podať hneď, ako je to možné po vybratí z chladničky.
Údaje týkajúce sa stability naznačujú, že zložky očkovacej látky sú stabilné počas 72 hodín, ak sa očkovacia látka uchováva pri teplote od 8 °C do 25 °C alebo od 0 °C do 2 °C. Po uplynutí tohto času sa má očkovacia látka Gardasil 9 použiť alebo zlikvidovať. Tieto údaje sú určené len na usmernenie zdravotníckych pracovníkov v prípade dočasnej odchýlky teploty.
6.5 Druh obalu a obsah balenia
Gardasil 9 injekčná suspenzia:
0,5 ml suspenzie v injekčnej liekovke (sklo) so zátkou (halobutylovou) a plastovým odklápacím (flip
off) viečkom (lemovaným hliníkovým prúžkom) vo veľkosti balenia po 1.
Gardasil 9 injekčnásuspenziavnaplnenejinjekčnejstriekačke:
0,5 ml suspenzie v naplnenej injekčnej striekačke (sklo) s piestovou zátkou (brómbutylový elastomér
obalený silikónovaným FluroTec-om) a vrchným viečkom (syntetická izoprén-brómbutylová zmes) vo veľkosti balenia po 1 alebo 10 s ihlami alebo vo veľkosti balenia po 10 bez ihiel.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Gardasil 9 injekčná suspenzia:
· Pred pretrepaním môže Gardasil 9 vyzerať ako číra kvapalina s bielou zrazeninou.
· Pred použitím dobre pretrepte, aby sa vytvorila suspenzia. Po dôkladnom pretrepaní je to biela zakalená kvapalina.
· Pred podaním suspenziu vizuálne skontrolujte na prítomnosť tuhých častíc a zmenu farby. Ak sa v očkovacej látke nachádzajú častice a/alebo je zmenená jej farba, vyraďte ju.
· Natiahnite 0,5 ml dávku očkovacej látky z jednodávkovej injekčnej liekovky pomocou sterilnej ihly a injekčnej striekačky.
· Ihneď podajte intramuskulárnu (i.m.) injekciu, uprednostňovaným miestom podania je deltoidná oblasť ramena alebo horná anterolaterálna oblasť stehna.
· Očkovacia látka sa má použiť tak, ako je dodávaná. Má sa použiť celá odporúčaná dávka očkovacej látky.
Všetka nepoužitá očkovacia látka alebo odpad vzniknutý z očkovacej látky sa má zlikvidovať v súlade s národnými požiadavkami.
Gardasil 9 injekčnásuspenziavnaplnenejinjekčnejstriekačke:
· Pred pretrepaním môže Gardasil 9 vyzerať ako číra kvapalina s bielou zrazeninou.
· Pred použitím naplnenú injekčnú striekačku dobre pretrepte, aby sa vytvorila suspenzia. Po dôkladnom pretrepaní je to biela zakalená kvapalina.
· Pred podaním suspenziu vizuálne skontrolujte na prítomnosť tuhých častíc a zmenu farby. Ak sa v očkovacej látke nachádzajú častice a/alebo je zmenená jej farba, vyraďte ju.
· Podľa veľkosti a hmotnosti pacienta vyberte vhodnú ihlu tak, aby sa zabezpečilo intramuskulárne (i.m.) podanie.
· V balení s ihlami sa nachádzajú dve ihly rôznej dĺžky na jednu striekačku.
· Nasaďte ihlu otáčaním v smere hodinových ručičiek, kým nie je ihla pevne pripevnená na injekčnej striekačke. Podajte celú dávku podľa štandardného protokolu.
· Ihneď podajte intramuskulárnu (i.m.) injekciu, uprednostňovaným miestom podania je deltoidná oblasť ramena alebo horná anterolaterálna oblasť stehna.
· Očkovacia látka sa má použiť tak, ako je dodávaná. Má sa použiť celá odporúčaná dávka očkovacej látky.
Všetka nepoužitá očkovacia látka alebo odpad vzniknutý z očkovacej látky sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMSD VACCINS
162 avenue Jean Jaurès
69007 Lyon
Francúzsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/15/1007/001
EU/1/15/1007/002
EU/1/15/1007/003
EU/1/15/1007/004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 10. júna 2015
10. DÁTUM REVÍZIE TEXTU{MM/RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.