
rem zmien uvedených v tabuľke 3. Počas 48. týždňa sa častejšie vyskytla eozinofília
[viac ako horná hranica normy > 0,7 x 109 /l] u skupiny pacientov liečenej Fuzeonom (12,4 pacientov s eozinofíliou na 100 pacientskych rokov) v porovnaní s pacientami liečenými iba ostatnými
antiretrovirotikami (5,6 pacientov na 100 pacientskych rokov ). Ak sa použije pre eozinofíliu vyšší limit (> 1,4 x 109/l), je počet pacientov s eozinofíliou v oboch skupinách rovnaký (1,8 pacientov
s udalosťou na 100 pacientskych rokov ).
Tabuľka 3: Laboratórne odchýlky 3. a 4. stupňa, ktoré súvisia s liečbou u pacientov liečených Fuzeonom v kombinácii s ďalšími antiretrovirotikami a u skupiny pacientov liečených iba ostatnými antiretrovirotikami, hlásené u viac než 2 pacientov s udalosťou na 100 pacientskych rokovLaboratórne parametre
| Fuzeon + ostatné antiretrovirotikána 100
pacientskych rokov
| Ostatné antiretrovirotikána
100 pacientskych rokov
|
n
(celkový počet liečených pacientov za rok)
| 663
(557,0)
| 334
(162,1)
|
ALAT
|
St. 3 (> 5-10 x horná hranica
normy)
St. 4 (> 10 x horná hranica normy)
| 4,8
1,4
| 4,6
1,2
|
Hemoglobín
|
St. 3 (6,5 – 7,9 g/dl)
St. 4 (< 6,5 g/dl)
| 2,0
0,7
| 1,9
1,2
|
Kreatinín fosfokináza
|
St. 3 (> 5-10 x horná hranica
normy)
St. 4 (> 10 x horná hranica normy))
| 8,3
3,1
| 8,0
8,6
|
4.9 PredávkovanieNeboli hlásené žiadne prípady predávkovania. Najvyššia jednorazová dávka podaná v rámci klinickej štúdie 12 pacientom bola 180 mg subkutánne. U týchto pacientov sa nevyskytli žiadne iné nežiaduce účinky, ako tie ktoré sa pozorovali pri odporúčanom dávkovaní. V štúdii „Early Access Program“ sa jednému pacientovi podala jednorazova dávka 180 mg Fuzeonu a nevyskytol sa u neho žiadny nežiaduci účinok.
Nie je žiadne špecifické antidotum pre prípad predávkovania enfuvirtidom. Liečba pri predávkovaní má pozostávať zo všeobecných podporných opatrení.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antivirotiká na systémové použitie, iné antivirotiká, ATC kód: J05A X07
Tento liek bol schválený podľa schémy takzvaného „Schválenia s podmienkou“. To znamená, že sa očakávajú ďalšie dôkazy o prínosoch tohto lieku.
Európska lieková agentúra (EMEA) bude každý rok posudzovať nové informácie o lieku a toto SPC
bude podľa potreby aktualizované.
Mechanizmus účinku: Enfuvirtid patrí do skupiny liekov nazývaných inhibítory fúzie. Je inhibítorom premeny štrukturálneho usporiadania gp41 HIV-1 Pôsobí prostredníctvom špecifickej väzby na tento vírusový proteín extracelulárne, čím blokuje fúziu medzi bunkovou membránou vírusu a membránou cieľových buniek, a tým zabraňuje preniknúť vírusovej RNA do cieľovej bunky.
Protivírusový účinok in vitro: Citlivosť na enfuvirtid u 612 rekombinantných kmeňov HIV obsahujúcich gény env, získaných z HIV RNA vzoriek od pacientov na začiatku štúdií III. fázy, dosiahla vo vstupných skúškach rekombinantného fenotypu HIV geometrický priemer EC50
0,259 μg/ml (geometrický priemer + 2SD = 1,96 μg/ml). Enfuvirtid tiež inhiboval bunkovú fúziu sprostredkovanú vírusovým obalom HIV - 1. Štúdie sledujúce účinok enfuvirtidu v kombinácii s ostatnými antivirotikami ukázal aditívny až synergický protivírusový účinok, pričom sa nepreukázal žiadny antagonizmus. Vzťah medzi citlivosťou HIV-1 na enfuvirtid in vitro a inhibíciou replikácie HIV-1 u ľudí nebol dokázaný.
Rezistencia na antiretrovirotiká: Neúplné potlačenie vírusovej replikácie môže viesť k liekovej rezistencii na jednu alebo viac súčastí liečebného režimu.
Rezistencia na enfuvirtid in vitro:HIV-1 izoláty so zníženou citlivosťou na enfuvirtid boli vyselektované v štúdiách in vitro. Tieto izoláty sa vyznačovali substitúciou aminokyselín na pozíciách
36 – 38 vonkajšej domény gp41. Tieto substitúcie sa dávali do vzťahu s rôznymi úrovňami zníženia citlivosti HIV mutantov na enfuvirtid.
Rezistencia na enfuvirtid in vivo:Ukázalo sa, že v III. fáze klinických štúdií rekombinanty HIV
obsahujúce gény env zo vzoriek HIV RNA, odobratých od 187 pacientov do 24. týždňa štúdie
mali > 4-násobný pokles citlivosti na enfuvirtid v porovnaní so vzorkami odobratými pred liečbou. U
185 (98,9%) z nich sa zistila substitúcia v génoch env v oblasti 36 - 45 glykoproteínu gp41. Pozorovali sa substitúcie v pozíciách aminokyselín 38, 43, 36, 40, 42 a 45 – poradie je uvedené podľa klesajúcej frekvencie výskytu. Jednotlivé špecifické substitúcie na týchto oblastiach proteínu gp41 mali za následok zníženie citlivosti rekombinantných kmeňov voči enfuvirtidu v porovnaní s východiskovými hodnotami pred začiatkom liečby. Geometrický priemer zmien citlivosti sa pohyboval od
15,2-násobne nižšej citlivosti pre V38M až do 41,6-násobne nižšej citlivosti pre V38A. Nebol dostatok príkladov mnohopočetných substitúcií na to, aby sa dali určiť stále vzory substitúcií alebo ich vplyv na citlivosť vírusu na enfuvirtid. Vzťah medzi týmito substitúciami a účinnosťou enfuvirtidu in vivo
nebol stanovený. Pokles citlivosti vírusu koreloval so stupňom rezistencie na ostatné antiretrovirotiká pred začiatkom liečby (Pozri tabuľku 5)
Skrížená rezistencia: Vďaka novému zacieleniu účinku je enfuvirtid in vitro rovnako účinný voči štandardným laboratórnym a klinickým izolátom a tým, ktoré sú rezistentné na 1, 2 alebo dokonca na
3 skupiny ostatných antiretrovirotík (nukleozidové inhibítory reverznej transkriptázy, nenukleozidové inhibítory reverznej transkriptázy a inhibítory proteázy). A naopak, neočakáva sa, že mutanty so substitúciou aminokyselín na pozíciách 36 - 45 proteínu gp41, ktoré sú rezistentné na enfuvirtid, budú mať skríženú rezistenciu na iné antiretrovírusové lieky.
Klinické farmakodynamické údaje
Štúdie u pacientov užívajúcich iné antiretrovírusové lieky: Klinická účinnosť Fuzeonu (v kombinácii s
inými antiretrovírusovými liekmi) na plazmatické hladiny HIV RNA a počty CD4 sa skúmala v dvoch randomizovaných, multicentrických, kontrolovaných štúdiách (TORO 1 a TORO 2), v ktorých sa podával Fuzeon počas 48 týždňov. Populácia zahŕňala 995 pacientov, ktorí mali podstúpiť liečbu. Demografia pacientov zahŕňa priemernú východiskovú hladinu HIV-1 RNA 5,2 log10 kópií/ml a 5,1 log10 kópií/ml a priemerný východiskový počet buniek CD4 88 buniek/mm3 pre Fuzeon + ostatné antiretrovirotiká a 97 buniek/mm3 pre pacientov liečených ostatnými antiretrovirotikami bez Fuzeonu. Predchádzajúca liečba pacientov bola v priemere 12 antiretrovírusových liekov v priemere počas 7
rokov. Všetci pacienti boli liečení 3 až 5 antiretrovírusovými liekmi vybranými na základe predchádzajúcej liečby pacienta a podľa stanovenia genotypovej a fenotypovej rezistencie voči vírusu.
Pomer pacientov, ktorí v 48. týždni dosiahli počet vírusových kópií < 400 kópií/ml, bol 30,4% pacientov s Fuzeonom v kombinácii s ďalšími antiretrovirotikami v porovnaní s 12% pacientov liečených iba ostatnými antiretrovirotikami (ARV) bez Fuzeonu. Priemerné zvýšenie počtu buniek CD4 bolo vyššie u pacientov s režimom Fuzeon + ďalšie antiretrovirotiká v porovnaní s pacientami, ktorí dostávali len ostatné antiretrovirotiká. (Pozri tabuľku 4).
Tabuľka 4: Výsledky randomizovanej liečby v 48. týždni (súhrn zo štúdií TORO 1 aTORO 2, ITT) Výsledky
| FUZEON
+ ostatné ARV
90 mg dvakrát denne
(N = 661)
| Ostatné
ARV
(N = 334)
| Rozdiel medzi
ramenami
| 95% Konfidenčný
interval
| Hodnota p
|
HIV-1 RNA
Log zmeny v porovnaní s východiskovou hodnotou (log10 kópií/ml)*
| -1,48
| -0,63
| LSM
-0,85
| -1,073;
-0,628
| <,0001
|
Počet CD4+ buniek
Zmena v porovnaní
s východiskovou hodnotou
(bunky/mm3 )#
| +91
| +45
| LSM
46,4
| 25,1; 67,8
| <,0001
|
Pokles HIV RNA ≥ 1 log pod východiskovú hodnotu**
| 247 (37,4%)
| 57 (17,1%)
| Pomer pravde-
podobnosti výskytu
3,02
| 2,16; 4,20
| <,0001
|
HIV RNA
< 400 kópií/ml**
| 201 (30,4%)
| 40
(12,0%)
| Pomer
pravde- podobnosti výskytu
3,45
| 2,36; 5,06
| <,0001
|
HIV RNA
< 50 kópií/ml**
| 121 (18,3%)
| 26 (7,8%)
| Pomer pravde-
podobnosti výskytu
2,77
| 1,76; 4,37
| <,0001
|
Ukončenie z dôvodu
nežiaducich reakcií/pridružených ochorení/laboratórnych nálezov†
| 9%
| 11%
|
|
|
|
Ukončenie z dôvodu reakcie
v mieste podania†
| 4%
| N/A
|
|
|
|
Ukončenie v dôsledku iného
dôvodu†φ§
| 13%
| 25%
|
|
|
|
* Na základe výsledkov zo súhrnných údajov z TORO 1 a TORO 2 štúdií v 48. týždni u populácii pacientov, ktorí
mali podstúpiť liečbu (ITT) a neboli ďalej sledovaní, prerušili liečbu alebo u nich bol zistený nedostatok vírusu, čo znamenalo poslednú prehliadku (LOCF).
# Použitá posledná hodnota
** M-H test: Prerušenie liečby alebo nedostatok vírusu považované za chybu
† Percentuálny pomer u populácie liečenej Fuzeonom + ďalšie antiretrovirotiká (N = 663) a ďalšími antiretrovirotikami
(N = 334). Menovateľ pre stálych pacientov, ktorí neprešli z jednej skupiny do druhej: N=112
φ Podľa úsudku skúšajúceho.
§ Zahŕňa prerušenie liečby z dôvodu vynechania následnej kontroly odmietnutia liečby a iné dôvody
Liečba Fuzeonom a ostatnými antiretrovirotikami bola spojená s vyšším pomerom pacientov, ktorí dosiahli < 400 kópií/ml (alebo < 50 kópií/ml) vo všetkých podskupinách na základe východiskového
počtu CD4 buniek, východiskovej hodnoty HIV-1 RNA, počtu antiretrovírusových liekov (ARV) v predchádzajúcej dobe alebo počtu účinných ARV, ktoré boli súčasťou režimu liečby ostatnými antiretrovirotikami bez Fuzeonu. Väčšia bola pravdepodobnosť, že jedinci s východiskovým počtom CD4 buniek > 100 buniek/mm3, východiskovou hodnotou HIV-1 RNA < 5,0 log10 kópií/ml, ≤ 10 pred liečbou ARV a / alebo inými účinnými ARV v režime liečby ostatnými antiretrovirotikami dosiahnu hodnotu HIV-1 RNA < 400 kópií/ml (alebo < 50 kópií/ml). (Pozri tabuľku 5).
Podskupiny
| HIV-1 RNA < 400 kópií/ml
| HIV-1 RNA < 50 kópií/ml
| FUZEON + ostatné
ARV
90 mg 2-krát denne
(N = 661)
| Ostatné ARV
(N = 334)
| FUZEON + ostatné
ARV
90 mg 2-krát denne
(N = 661)
| Ostatné
ARCV (N = 334)
| BL HIV-1 RNA < 5,0
1
log10 kópií/ml
| 118/269
(43,9%)
| 26/144
(18,1%)
| 77/269
(28,6%)
| 18/144
(12,5%)
| BL HIV-1 RNA ≥ 5,0
1
log10 kópií/ml
| 83/392
(21,2%)
| 14/190
(7,4%)
| 44/392
(11,2%)
| 8/190
(4,2%)
|
|
|
|
|
| Celkový počet
predchádzajúcich ARV
≤ 101
| 100/215
(46,5%)
| 29/120
(24,2%)
| 64/215
(29,8%)
| 19/120
(15,8%)
| Celkový počet predchádzajúcich ARV
> 101
| 101/446 (22,6%)
| 11/214 (5,1%)
| 57/446 (12,8%)
| 7/214 (3,3%)
| 0 podávaných účinných
ARV 1,2
| 9/112
(8,0%)
| 0/53
(0%)
| 4/112
(3,5%)
| 0/53
(0%)
| 1 podávané účinné
ARV1,2
| 56/194
(28,9%)
| 7/95
(7,4%)
| 34/194
(17,5%)
| 3/95
(3,2%)
| ≥ 2 podávané účinné
ARV1,2
| 130/344
(37,8%)
| 32/183
(17,5%)
| 77/334
(22,4%)
| 22/183
(12,0%)
|
|
|
Tabuľka 5: Pacienti, ktorí v 48. týždni dosiahli < 400 kópií/ml a < 50 kópií/ml, podľa podskupín (súhrnné údaje z TORO 1 a TORO 2, ITT)1 Prerušenie liečby alebo virologické poruchy, považované za zlyhanie
2 Na základe GSS skóre.
5.2 Farmakokinetické vlastnostiFarmakokinetické vlastnosti enfuvirtidu sa skúmali u dospelých a pediatrických pacientov infikovaných HIV-1.
Absorpcia: Absolútna biologická dostupnosť po subkutánnom podaní 90 mg enfuvirtidu do brucha bola 84,3 ± 15,5%. Priemerná hodnota (± SD) Cmax bola 4,59 ± 1,5 μg/ml, AUC bola
55,8 ± 12,1 μg
*hod/ml. Subkutánna absorpcia enfuvirtidu je priamo závislá od podanej dávky v
rozsahu 45 až 180 mg. Absorpcia dávky 90 mg pri podaní do brucha, stehna alebo ramena je porovnateľná. V štyroch rôznych štúdiách (N = 9 až 12) sa priemerná bazálna plazmatická koncentrácia rovnovážneho stavu pohybovala v rozsahu 2,6 až 3,4 μg/ml.
Distribúcia: Distribučný objem v rovnovážnom stave po intravenóznom podaní dávky 90 mg enfuvirtidu bol 5,5 ± 1,1 l. 92% enfuvirtidu sa u pacientov infikovaných HIV pri koncentráciách
2 až 10 μg/ml viaže na plazmatické bielkoviny. Z najväčšej časti sa viaže na albumín, z menšej časti
na kyslý α-1 glykoproteín. V štúdiách
in vitro enfuvirtid nebol vytlačovaný inými liekmi z ich väzobných miest, a ani enfuvirtid nevytlačoval iné lieky z ich väzobných miest. U HIV pacientov boli popísané hladiny enfuvirtidu v cerebrospinálnej tekutine ako zanedbateľné.
Metabolizmus: Keďže enfuvirtid je peptid, očakáva sa, že sa bude katabolizovať na jednotlivé aminokyseliny s následnou recykláciou aminokyselín v tele. Štúdie
in vitro s ľudskými mikrozómami a štúdie
in vivo ukazujú, že enfuvirtid nie je inhibítorom enzýmov CYP450. V štúdiách
in vitro s ľudskými mikrozómami a hepatocytmi, hydrolýza C-koncovej aminokyseliny fenylalanínu viedla k
tvorbe deaminovaného metabolitu, ktorého tvorba nie je závislá na NADPH. Tento metabolit sa dá zistiť v ľudskej plazme po podaní enfuvirtidu, jeho množstvo vyjadrené AUC sa pohybuje medzi hodnotami 2,4 až 15% AUC samotného enfuvirtidu.
Eliminácia: Klírens enfuvirtidu po intravenóznom podaní 90 mg bol 1,4 ± 0,28 l/hod a polčas eliminácie bol 3,2 ± 0,42 hod. Po subkutánnom podaní 90 mg enfuvirtidu bol polčas vylučovania enfuvirtidu 3,8 ± 0,6 hod. Štúdie hmotnostnej bilancie na určenie cesty eliminácie enfuvirtidu sa u ľudí neuskutočnili.
Hepatálna insuficiencia: Farmakokinetika enfuvirtidu sa u pacientov s poškodením funkcie pečene neskúmala.
Renálna insuficiencia: Analýza údajov plazmatických koncentrácií pacientov v klinických štúdiách ukázala, že klírens enfuvirtidu nie je klinicky významne ovplyvnený u pacientov s ľahkou až miernou poruchou funkcie obličiek. V štúdii, v ktorej sa sledovala porucha funkcie obličiek, bolo AUC zvýšené v priemere o 43-62 % u pacientov so závažným ochorením obličiek alebo u pacientov v konečnom štádiu ochorenia v porovnaní s pacientami s normálnou funkciou obličiek. Hemodialýza signifikantne nemenila klírens enfuvirtidu. Menej ako 13 % dávky sa odstránilo dialýzou. U pacientov
s poškodením funkcie obličiek nie je potrebná úprava dávky.
Staršie osoby: Farmakokinetika enfuvirtidu sa formálne u pacientov starších ako 65 rokov nesledovala.
Pohlavie a hmotnosť: Analýza plazmatických koncentrácií pacientov z klinických štúdií ukazuje, že klírens enfuvirtidu je o 20% nižší u žien než u mužov, a to bez ohľadu na hmotnosť. Klírens sa
zvyšuje so zvyšujúcou sa telesnou hmotnosťou bez ohľadu na pohlavie (klírens je o 20% vyšší u osoby s hmotnosťou 100 kg a o 20% nižší u osoby s hmotnosťou 40 kg v porovnaní s osobou s hmotnosťou
70 kg). Tieto zmeny však nie sú klinicky významné, a preto nie je potrebná úprava dávkovania.
Rasa: Analýza plazmatických koncentrácií pacientov z klinických štúdií ukázala, že klírens enfuvirtidu sa nelíšil u ľudí čiernej a bielej rasy. Iné farmakokinetické štúdie nasvedčujú, že nie sú rozdiely medzi jednotlivými rasami, ak sa dávka prispôsobí telesnej hmotnosti.
Pediatrickí pacienti: Farmakokinetika enfuvirtidu sa sledovala u 37 pediatrických pacientov. Dávka
2 mg/kg dvakrát denne (maximum 90 mg dvakrát denne) viedla k plazmatickým koncentráciám enfuvirtidu, ktoré boli podobné ako hladiny u dospelých pacientov, ktorí dostávali 90 mg dvakrát denne. U 25 pediatrických pacientov vo veku od 5 do 16 rokov, ktorí dostávali 2 mg/kg dvakrát denne do ramena, prednej časti stehna alebo do brucha, boli priemerné AUC v rovnovážnom stave
54,3 ± 23,5 μg*hod/ml, Cmax bola 6,14 ± 2,48 μg/ml a Cmin bola 2,93 ± 1,55 μg/ml.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a vplyvu na embryonálny vývoj neodhalili žiadne osobitné riziko pre ľudí. Dlhodobé štúdie karcinogenity na zvieratách neboli uskutočnené.
Štúdie na morčatách ukázali, že enfuvirtid môže spôsobiť oneskorenú kožnú precitlivenosť. Pri sledovaní odolnosti na infekciu chrípkou na potkanoch sa pozorovalo zhoršenie tvorby IFN-γ. Odolnosť na infekciu chrípkou a streptokokmi u potkanov bola len mierne porušená.. Klinický význam týchto zistení nie je známy.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok
Uhličitan sodný Manitol Hydroxid sodný
Kyselina chlorovodíková
Rozpúšťadlo
Voda na injekciu
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Prášok
3 roky
Rozpúšťadlo
3 roky
Čas použiteľnosti po rekonštitúcii
Ak sa liek chráni pred svetlom, je chemická a fyzikálna stabilita 48 hodín pri teplote 5°C.
Z mikrobiologického hľadiska sa má liek použiť okamžite. Ak sa nepoužije okamžite, za čas a spôsob skladovania pred použitím je zodpovedný používateľ. Ak sa rekonštitúcia neuskutočnila v kontrolovaných a zaručene aseptických podmienkach, čas skladovania za normálnych podmienok
pri 2°C až 8°C nemá byť dlhší než 24 hodín.
6.4 Špeciálne upozornenia na uchovávanie
Prášok
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
Po rekonštitúcii: Uchovávajte v chladničke pri teplote (2°C – 8°C). Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom. Podmienky na uchovávanie rekonštituovaného lieku, pozri časť 6.3.
Rozpúšťadlo
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Prášok
Injekčná liekovka: 3 ml injekčná liekovka, bezfarebné sklo typu 1
Zátka: zátka, guma (neobsahujúca latex) Tesnenie: hliníkové tesnenie s vyklápacím viečkom
Rozpúšťadlo
Objem: 2 ml
Injekčná liekovka: 2 ml injekčná liekovka, bezfarebné sklo, typ 1
Zátka: gumová zátka (neobsahujúca latex) Tesnenie: hliníkové tesnenie s vyklápacím viečkom
Veľkosť balenia
Balenie 1
60 injekčných liekoviek s práškom na injekčný roztok
60 injekčných liekoviek s rozpúšťadlom
60 3 ml injekčných striekačiek
60 1 ml injekčných striekačiek
180 tampónov s alkoholom
Balenie 2
60 injekčných liekoviek s práškom na injekčný roztok
60 injekčných liekoviek s rozpúšťadlom
6.6 Špeciálne opatrenia na likvidáciu
Nepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s miestnymi požiadavkami.
Pred prvým použitím Fuzeonu sa musia pacienti poučiť o používaní a podávaní zdravotníckym pracovníkom.
Fuzeon sa musí rekonštituovať len s 1,1 ml vody na injekciu. Pacienti sa musia poučiť, že najskôr majú pridať vodu na injekciu a potom jemne poklepávať špičkou prsta na injekčnú liekovku, kým sa prášok nezačne rozpúšťať. Nikdy nesmú injekčnú liekovku trepať alebo ju otáčať zhora nadol, aby obsah premiešali – toto môže spôsobiť nadmerné spenenie. Keď sa prášok začne rozpúšťať, môže sa odložiť injekčná liekovka nabok, aby sa prášok mohol úplne rozpustiť. Úplné rozpustenie prášku v roztoku môže trvať aj 45 minút. Pacient môže po pridaní vody na injekciu injekčnú liekovku jemne otáčať medzi rukami, a to až dovtedy, kým sa prášok úplne nerozpustí. Tento spôsob môže skrátiť čas potrebný na kompletné rozpustenie. Predtým, ako sa roztok natiahne pre použitie, pacient má prezrieť injekčnú liekovku a uistiť sa, či je obsah úplne vo forme roztoku, overiť si, či je roztok číry a bez bublín alebo čiastočiek. Ak roztok obsahuje nejaké častice, injekčná liekovka sa nesmie použiť a musí sa zlikvidovať alebo vrátiť do lekárne.
Injekčné liekovky s rozpúšťadlom obsahujú 2 ml vody na injekciu, z ktorého sa musí odobrať 1,1 ml na rekonštitúciu prášku. Pacienti sa majú poučiť ako zlikvidovať zvyšný objem v injekčnej liekovke.
Fuzeon neobsahuje žiadne konzervačné látky. Rekonštituovaný roztok sa má okamžite použiť. Ak sa nemôže použiť rekonštituovaný roztok okamžite, má sa uskladniť v chladničke až do použitia, pričom sa musí použiť v priebehu 24 hodín. Schladený rekonštituovaný roztok sa má pred použitím ohriať na izbovú teplotu.
1 ml rekonštituovaného roztoku sa má podať subkutánnou injekciou do ramena, brucha alebo prednej strany stehna. Injekcia sa má podať na iné miesto než bola podaná predchádzajúca injekcia, a to na miesto, na ktorom nie je prítomná žiadna reakcia. Injekčná liekovka je určená len na jednorazové použitie; nepoužitá časť sa musí znehodnotiť.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Roche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
8. REGISTRAČNÉ ČÍSLA
EU/1/03/252/001-002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
27.mája.2003
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry
(EMEA)
http://www.emea.europa.eu
1. NÁZOV LIEKU
Fuzeon 90 mg/ml prášok na injekčný roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá injekčná liekovka obsahuje 108 mg enfuvirtidu. 1 ml rekonštituovaného roztoku obsahuje
90 mg enfuvirtidu. Pomocné látky:
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, to znamená, že je v podstate
„bez sodíka“. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok na injekčný roztok
Biely až sivastý lyofilizovaný prášok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Fuzeon sa indikuje v kombinácii s inými antiretrovírusovými liekmi v liečbe pacientov infikovaných HIV-1, u ktorých zlyhal alebo ktorí netolerovali liečebný režim, obsahujúci aspoň jeden liek z každej nasledujúcich skupín antiretrovírusových látok, inhibítorov proteáz, nenukleozidových inhibítorov reverznej transkriptázy a nukleozidových inhibítorov reverznej transkriptázy. (Pozri časť 5.1)
Pri rozhodovaní o novom liečebnom režime u pacientov, u ktorých zlyhala antiretrovírusová liečba, sa majú starostlivo zvážiť údaje z predchádzajúcej liečby pacienta a charakter mutácií v súvislosti s rôznymi liekmi. Vhodné je vyšetrenie rezistencie, ak je dostupné. (Pozri časti 4.4 a 5.1)
4.2 Dávkovanie a spôsob podávania
Fuzeon má predpisovať lekár, ktorý má skúsenosti s liečbou HIV infekcie. Fuzeon sa má podávať len vo forme subkutánnej injekcie.
Dospelí a adolescenti ≥16rokov: Odporúčaná dávka Fuzeonu je 90 mg dvakrát denne, podaná subkutánnou injekciou do ramena, prednej strany stehna alebo brucha.
Staršie osoby: Nie sú skúsenosti s podávaním u pacientov > 65-rokov.
Deti ≥6 rokov a adolescenti: Skúsenosti u detí sú obmedzené. (Pozri časť 5.2). V súčasne prebiehajúcich klinických skúškach sa používa dávkovací režim uvedený v tabuľke 1.
Tabuľka 1: Dávkovanie v pediatrii
Hmotnosť (kg)
|
Dávka pre injekciu podávanú dvakrát denne (mg/dávka)
|
Objem injekcie
(90 mg enfuvirtidu/ml)
|
11,0 - 15,5
|
27
|
0,3 ml
|
15,6 - 20,0
|
36
|
0,4 ml
|
20,1 - 24,5
|
45
|
0,5 ml
|
24,6 - 29,0
|
54
|
0,6 ml
|
29,1 - 33,5
|
63
|
0,7 ml
|
33,6 - 38,0
|
72
|
0,8 ml
|
38,1 - 42,5
|
81
|
0,9 ml
|
≥ 42,6
|
90
|
1,0 ml
|
Fuzeon sa neodporúča používať u detí mladších ako 6 rokov vzhľadom na nedostatočné údaje o
bezpečnosti a účinnosti (pozri časť 5.2).
Porucha funkcie obličiek: Nie je potrebné upravovať dávkovanie u pacientov s poruchou funkcie obličiek, vrátane tých, ktorí sú na dialýze. (Pozri časti 4.4 a 5.2).
Porucha funkcie pečene: Nie sú k dispozícii údaje, na základe ktorých by sa dali u pacientov s poruchou pečene stanoviť odporúčania pre dávkovanie. (Pozri časti 4.4 a 5.2).
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na niektorú z pomocných látok.
4.4 Osobitné upozornenia a opatrenia pri používaníFuzeon sa musí podávať ako súčasť kombinovanej liečby. Pozrite si prosím, aj súhrny charakteristických vlastností ďalších antiretrovírusových liekov, ktoré sa používajú v kombinovanej liečbe. Podobne ako iné antiretrovírusové lieky, aj enfuvirtid sa má kombinovať s inými antiretrovírusovými liekmi, na ktoré je citlivý vírus pacienta. (Pozri časť 5.1)
Pacienti sa musia upozorniť na to, že nebolo dokázané, že antiretrovírusová liečba, vrátane enfuvirtidu, zabráni riziku prenosu HIV na iných jedincov sexuálnym kontaktom alebo kontaminovanou krvou. Pacienti musia naďalej dodržiavať primerané opatrenia. Pacienti sa majú tiež informovať o tom, že užívanie Fuzeonu neznamená vyliečenie infekcie HIV infekcie
Štúdie na zvieratách ukázali, že enfuvirtid môže narušiť niektoré funkcie imunitného systému. (Pozri časť 5.3) U pacientov liečených Fuzeonom sa zaznamenal vyšší výskyt niektorých bakteriálnych infekcií, a to hlavne pneumónií. U pacientov je potrebné starostlivo sledovať znaky a príznaky pneumónie. (Pozri časť 4.8)
Pri liečbe enfuvirtidom sa zriedkavo vyskytli reakcie z precitlivenosti a v zriedkavých prípadoch sa opakovali, keď sa liek znova začal podávať. Vyskytli sa vyrážka, horúčka, nauzea a vracanie, triaška, stuhlosť, nízky tlak krvi, zvýšené sérové hladiny pečeňových transamináz, a to v rôznych kombináciách a možné sú aj primárne imunokomplexové reakcie a ťažkosti s dýchaním a glomerulonefritída. Pacienti, u ktorých sa objavia znaky/príznaky systémovej precitlivenosti, majú ukončiť liečbu enfuvirtidom a majú okamžite vyhľadať lekárske vyšetrenie. Ak došlo k systémovým prejavom reakcií z precitlivenosti, u ktorých sa predpokladalo, že súvisia s enfuvirtidom, enfuvirtid sa nemá znovu zaradiť do liečby. Nie sú známe rizikové faktory, na základe ktorých by sa dal predvídať výskyt alebo závažnosť precitlivenosti na enfuvirtid.
Ochorenia pečene: Bezpečnosť a účinnosť enfuvirtidu neboli osobitne skúmané u pacientov so závažnými ochoreniami pečene. Pacienti s chronickou hepatitídou B a C a liečení antiretrovírusovou
liečbou, majú zvýšené riziko závažných a potenciálne fatálnych nežiaducich účinkov postihujúcich pečeň. Len málo pacientov, ktorí sa zúčastnili III. fázy klinických skúšok, bolo súčasne infikovaných hepatitídou B/C. U týchto pacientov pridanie Fuzeonu nezvýšilo výskyt nežiaducich účinkov postihujúcich pečeň. V prípade súčasnej antivírusovej liečby hepatitídy B alebo C si pozrite tiež písomné informácie pre používateľov týchto liekov.
Podávanie Fuzeonu jedincom, ktorí nie sú infikovaní HIV-1, môže vyvolať tvorbu protilátok proti enfuvirtidu, ktoré skrížene reagujú s gp41 HIV. Toto môže viesť pri anti-HIV ELISA testu k falošnej pozitivite testovania HIV infekcie.
Nie je žiadna skúsenosť u pacientov so zníženou funkciou pečene. Obmedzené údaje sú u pacientov s miernou až závažnou poruchou funkcie obličiek a u pacientov, ktorí na dialýze. U týchto skupín pacientov sa má používať Fuzeon s opatrnosťou. (Pozri časti 4.2 a 5.2).
Syndróm imunitnej reaktivácie: U HIV-infikovaných pacientov s ťažkou imunodeficienciou môže na začiatku kombinovanej antiretrovírusovej terapie ( CART) vzniknúť zápalová reakcia na asymptomatické alebo reziduálne oportúnne patogény a môže spôsobiť závažné klinické stavy alebo zhoršenie symptómov. Takéto reakcie sa typicky pozorovali počas prvých niekoľkých týždňov alebo mesiacov od zahájenia CART. Jedná sa napríklad o cytomegalovírusovú retinitídu, generalizované a/alebo fokálne mykobakteriálne infekcie a pneumónia spôsobená Pneumocystis carinii. Akékoľvek symptómy zápalu sa majú zhodnotiť a v prípade potreby sa musí začať liečba.
Osteonekróza: Aj keď sa etiológia považuje za mnohofaktorovú (vrátane používania kortikosteroidov, konzumácie alkoholu, ťažkej imunosupresie, vyššieho indexu telesnej hmotnosti), boli hlásené prípady osteonekrózy, najmä u pacientov s pokročilým HIV ochorením a/alebo dlhodobou expozíciou CART. Pacientom sa má odporučiť, aby vyhľadali lekársku pomoc, ak budú mať bolesť kĺbov, stuhnutosť kĺbov alebo ťažkosti s pohybom.
4.5 Liekové a iné interakcie
Interakčné štúdie sa uskutočnili len u dospelých.
Nepredpokladajú sa žiadne významné farmakokinetické interakcie medzi enfuvirtidom a súčasne podávanými liekmi, ktoré sú metabolizované enzýmami CYP450.
Vplyv enfuvirtidu na metabolizmus súčasne podávaných liekov: V in vivo štúdii, sledujúcej metabolizmus u ľudí, enfuvirtid pri odporúčanom dávkovaní 90 mg dvakrát denne, neinhiboval metabolizmus substrátov metabolizovaných cez CYP3A4 (dapson), CYP2D6 (debrizochín), CYP1A2 (kofeín), CYP2C19 (mefenytoín) a CYP2E1 (chlórzoxazon).
Vplyv súčasne podávaných liekov na metabolizmus enfuvirtidu: V inej štúdii zaoberajúcej sa famakokinetikou, súčasné podávanie ritonaviru (silný inhibítor CYP3A4) alebo sachinaviru v kombinácii s booster dávkou ritonaviru alebo rifampicínu (silný induktor CYP34A) neviedlo ku klinicky významným zmenám farmakokinetiky enfuvirtidu.
4.6 Gravidita a laktácia
Nie sú k dispozícii dostatočné a dobre kontrolované klinické údaje o gravidných ženách. Štúdie na zvieratách nepreukázali škodlivé účinky na fetálny vývoj. Enfuvirtid sa má počas gravidity podávať len vtedy, keď potenciálny prínos liečby preváži potenciálne riziko pre plod.
Nie je známe, či sa enfuvirtid vylučuje do materského mlieka. Matky sa majú poučiť že, ak užívajú enfuvirtid, nemajú dieťa dojčiť kvôli možnému prenosu HIV a možným nežiaducim účinkom u dojčených detí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Neexistujú žiadne dôkazy o tom, že by enfuvirtid ovplyvňoval schopnosť viesť vozidlá alebo obsluhovať stroje, potrebné je však vziať do úvahy profil nežiaducich účinkov enfuvirtidu. (Pozri časť
4.8)
4.8 Nežiaduce účinkyÚdaje o bezpečnosti pochádzajú hlavne zo súhrnných údajov počas 48 týždňov štúdií TORO 1
a TORO 2 (pozri časť 5.1). Výsledky bezpečnosti sú vyjadrené ako počet pacientov s nežiaducimi účinkami počas 100 pacientskych rokov expozície (s výnimkou reakcií v mieste podania).
Reakcie v mieste podaniaNajčastejšími nežiaducimi reakciami boli lokálne reakcie v mieste podania (ISRs) a vyskytli sa u 98 %
pacientov (tabuľka 2). Väčšinou sa ISRs objavili v priebehu prvého týždňa podávania Fuzeonu, pričom boli spojené s miernou až stredne silnou bolesťou alebo nepríjemnými pocitmi v mieste podania, ktoré neovplyvnili bežné činnosti pacientov. Intenzita bolesti a nepríjemné pocity sa nezvyšovali s pokračovaním liečby. Známky a symptómy trvali zvyčajne menej než 7 dní. Infekcie v mieste podania (vrátane abscesov a celulitídy) sa vyskytli u 1,5 % pacientov.
Tabuľka 2: Súhrn jednotlivých príznakov/symptómov charakteristických pre lokálne reakcie v mieste podania v kombinovaných štúdiách TORO 1 a TORO 2 (% pacientov)
| n = 663
| Ukončenie liečby pre ISRs
| 4%
| Udalosť
| FUZEON
+ ostatné antiretrovirotikáa
| % výskytu reakcií
3. stupňa
| % výskytu reakcií
4. stupňa
| Bolesť / nepríjemný pocit
| 96,1%
| 11,0%b
| 0%b
| Erytém
| 90,8%
| 23,8%c
| 10,5%c
| Indurácia
| 90,2%
| 43,5%d
| 19,4%d
| Noduly a cysty
| 80,4%
| 29,1%e
| 0,2%e
| Pruritus
| 65,2%
| 3,9%f
| nie je definovaný
| Ekchymóza
| 51,9%
| 8,7%g
| 4,7%g
|
|
|
a Akýkoľvek stupeň závažnosti
bStupeň 3 = silná bolesť vyžadujúca analgetiká (alebo opiátové analgetiká ≤ 72 hodín) a/alebo obmedzujúca bežné aktivity; stupeň 4 = silná bolesť vyžadujúca hospitalizáciu alebo predĺženie hospitalizácie, vedúca k úmrtiu, alebo trvalej alebo závažnej pracovnej nespôsobilosti, alebo život ohrozujúca alebo medicínsky významná.
cStupeň 3 = ≥ 50 mm avšak < 85 mm v priemere; stupeň 4 = ≥ 85 mm v priemere dStupeň 3 = ≥ 25 mm avšak < 50 mm v priemere; stupeň 4 = ≥ 50 mm v priemere eStupeň 3 = ≥ 3 cm; stupeň 4 = ak je drenáž.
fStupeň 3 = refraktérne na lokálnu liečbu alebo vyžadujúce perorálnu alebo parenterálnu liečbu; stupeň 4 = nie je stanovený.
gStupeň 3 = > 3 cm ale ≤ 5 cm; stupeň 4 = > 5 cm.
Ďalšie nežiaduce účinkyPridanie Fuzeonu k základnej antiretrovírusovej liečbe vo všeobecnosti nezvýšilo výskyt alebo
závažnosť väčšiny nežiaducich udalostí. V štúdiách TORO 1 a TORO 2 bola najčastejšie hlásená hnačka (u 38 pacientov, ktorým sa podával Fuzeon v kombinácii s ostatnými antiretrovirotikami oproti
73 pacientom liečených ostatnými antiretrovirotikami bez Fuzeonu za 100 pacientských rokov)
a nauzea (27 pacientov, ktorým sa podával Fuzeon v kombinácii s ostatnými antiretrovirotikami oproti
50 pacientom, liečených ostatnými antiretrovirotikami bez Fuzeonu za 100 pacientskych rokov).
Nasledujúci zoznam uvádza udalosti, ktoré sa vyskytli častejšie u pacientov liečených Fuzeonom v kombinácii s ostatnými antiretrovirotikami v porovnaní s pacientami liečenými ostatnými antiretrovirotikami bez Fuzeonu, ktorých výskyt sa zvýšil v súvislosti s liečbou najmenej u 2 pacientov s udalosťou za 100 pacientských rokov. Tieto udalosti sa potom označili na základe frekvencie výskytu („veľmi časté“ (≥1/10) alebo „časté (≥1/100, <1/10)). Štatisticky významné sa ukázalo zvýšenie výskytu pneumónie a lymfadenopatie. Väčšina nežiaducich účinkov bolo miernej alebo strednej intenzity.
Infekcie a nákazy
Časté (≥ 1/100, < 1/10): - sinusitída, kožný papilóm, chrípka, pneumónia, infekcia ucha.
Poruchy krvi a lymfatického systému
Časté (≥ 1/100, < 1/10): - lymfadenopatia.
Poruchy metabolizmu a výživy
Časté (≥1/100, < 1/10): - znížená chuť do jedla, nechutenstvo, hypertriglyceridémia, diabetes mellitus.
Psychické poruchy
Časté (≥ 1/100, < 1/10): - úzkosť, nočná mora, iritabilita.
Poruchy nervového systému
Veľmi časté (≥ 1/10): - periférna neuropatia.
Časté (≥ 1/100, < 1/10): - hypoestézia, porucha pozornosti, tremor.
Ochorenia oka
Časté (≥ 1/100, < 1/10): - konjunktivitída.
Poruchy ucha a vnútorného ucha
Časté (≥ 1/100, < 1/10): -vertigo.
Poruchy dýchacej sústavy, hrudníka a mediastína
Časté (≥1/100, < 1/10): upchanie nosa.
Gastrointestinálne poruchy
Časté (≥ 1/100, < 1/10): - pankreatitída, gastroezofageálny reflux.
Poruchy kože a podkožného tkaniva
Časté (≥ 1/100, < 1/10): - suchá koža, seboroický ekzém, erytém, akné.
Poruchy kostrového svalstva, spojivových tkanív a kostí
Časté (≥ 1/100, < 1/10): - myalgia.
Poruchy obličiek a močových ciest
Časté (≥ 1/100, < 1/10): - obličkový kameň.
Celkové poruchy a reakcie v mieste podania
Časté (≥ 1/100, < 1/10): - ochorenie podobné chrípke, slabosť.
Vyšetrenia
Veľmi časté (≥ 1/10): - úbytok hmotnosti
Časté (≥ 1/100, < 1/10): - zvýšené triglyceridy v krvi, krv v moči.
Okrem toho sa vyskytol malý počet hypersenzitívnych reakcií na enfuvirtid a v niektorých prípadoch sa pozoroval opätovný výskyt pri opakovanej liečbe. (Pozri časť 4.4)
U HIV-infikovaných pacientov s ťažkou imunodeficienciou môže v čase zahájenia kombinovanej antiretrovírusovej terapie (CART) vzniknúť zápalová reakcia na asymptomatické alebo reziduálne oportúnne infekcie (pozri časť 4.4).
Boli hlásené prípady osteonekrózy, najmä u pacientov so všeobecne uznávanými rizikovými faktormi, pokročilým HIV ochorením alebo dlhodobou expozíciou CART. Frekvencia osteonekrózy nie je známa (pozri časť 4.4).
Laboratórne odchýlky

U väčšiny pacientov nedošlo počas štúdie ku zmene stupňa toxicity žiadneho z laboratórnych parametrov, okrem zmien uvedených v tabuľke 3. Počas 48. týždňa sa vyskytla eozinofília [viac ako horná hranica normy > 0,7 x 109 /l] u skupiny pacientov liečenej Fuzeonom (12,4 pacientov
s eozinofíliou na 100 pacientských rokov) v porovnaní s pacientami liečenými iba ostatnými antiretrovirotikami (5,6 pacientov na 100 pacientských rokov). Ak sa použije pre eozinofíliu vyšší limit (> 1,4 x 109/l), je počet pacientov s eozinofíliou v oboch skupinách rovnaký (1,8 pacientov
s udalosťou na 100 pacientskych rokov).
Tabuľka 3: Laboratórne odchýlky 3. a 4. ktoré súvisia s liečbou u pacientov liečených Fuzeonom v kombinácii s ďalšími antiretrovirotikami a u skupiny pacientov liečených iba ostatnými antiretrovirotikami, hlásené u viac než 2 pacientovs udalosťou na 100 pacientskych rokovLaboratórne parametre
| Fuzeon + ostatné antiretrovirotiká
na 100 pacientskych rokov
| Ostatné antiretrovirotiká na 100 pacientskych rokov
|
n
(Celkový počet liečených pacientov za rok)
| 663
(557,0)
| 334
(162,1)
|
ALAT
|
St. 3 (> 5-10 x horná hranica
normy)
St. 4 (> 10 x horná hranica normy)
| 4,8
1,4
| 4,6
1,2
|
Hemoglobín
|
St. 3 (6,5 – 7,9 g/dl)
St. 4 (< 6,5 g/dl)
| 2,0
0,7
| 1,9
1,2
|
Kreatinín fosfokináza
|
St. 3 (> 5-10 x horná hranica
normy)
St. 4 (> 10 x horná hranica normy)
| 8,3
3,1
| 8,0
8,6
|
4.9 PredávkovanieNeboli hlásené žiadne prípady predávkovania. Najvyššia dávka, a to 180 mg, sa podávala v rámci klinickej štúdie 12 pacientom v jednorazovej dávke, podávanej subkutánne. U týchto pacientov sa nevyskytli žiadne iné nežiaduce účinky, ako tie, ktoré boli pozorované pri odporúčanom dávkovaní. V štúdii „Early Access Program “ sa jednému pacientovi podala jednorazova dávka 180 mg Fuzeonu a nevyskytol sa u neho žiaden nežiaduci účinok.
Nie je žiadne špecifické antidotum pre prípad predávkovania enfuvirtidom. Liečba pri predávkovaní má pozostávať zo všeobecných podporných opatrení.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antivirotiká na systémové použitie, iné antiretrovirotiká, ATC kód: J05A X07
Tento liek bol schválený podľa schémy takzvaného „Schválenia s podmienkou“. To znamená, že sa očakávajú ďalšie dôkazy o prínosoch tohto lieku.
Európska lieková agentúra (EMEA) bude každý rok posudzovať nové informácie o lieku a toto SPC
bude podľa potreby aktualizované.
Mechanizmus účinku: Enfuvirtid je členom terapeutickej triedy nazývanej inhibítory fúzie. Je inhibítorom premeny štrukturálneho usporiadania gp41 HIV-1. Pôsobí prostredníctvom špecifickej väzby na tento vírusový proteín extracelulárne, čím blokuje fúziu bunkovej membrány vírusu s cieľovou bunkovou membránou, a tým zabraňuje vírusovej RNA preniknúť do cieľovej bunky. Enfuvirtid nevyžaduje intracelulárnu aktiváciu. Protivírusový účinok enfuvirtidu vyplýva z jeho spojenia s opakujúcim sa motívom v sedmiciach, HR1, vo vnútri natívneho gp41, ktorý sa nachádza na povrchu vírusu.
Protivírusový účinok in vitro: Citlivosť na enfuvirtid u 612 rekombinantných kmeňov HIV obsahujúcich gény env, získaných z HIV RNA vzoriek od pacientov na začiatku štúdií III. fázy, dosiahla vo vstupných skúškach rekombinantného fenotypu HIV geometrický priemer EC50
0,259 μg/ml (geometrický priemer + 2SD = 1,96 μg/ml). Enfuvirtid tiež inhiboval bunkovú fúziu sprostredkovanú vírusovým obalom HIV - 1. Štúdie sledujúce účinok enfuvirtidu v kombinácii s ostatnými antivirotikami ukázal aditívny až synergický protivírusový účinok, pričom sa nepreukázal žiadny antagonizmus. Vzťah medzi citlivosťou HIV-1 na enfuvirtid in vitro a inhibíciou replikácie HIV-1 u ľudí nebol dokázaný.
Rezistencia na antiretrovirotiká: Neúplné potlačenie vírusovej replikácie môže viesť k liekovej rezistencii na jednu alebo viac súčastí liečebného režimu.
Rezistencia na enfuvirtid in vitro:HIV-1 izoláty so zníženou citlivosťou na enfuvirtid boli vyselektované v štúdiách in vitro. Tieto izoláty sa vyznačovali substitúciou aminokyselín na pozíciách
36 – 38 vonkajšej domény gp41. Tieto substitúcie sa dávali do vzťahu s rôznymi úrovňami zníženia citlivosti HIV mutantov na enfuvirtid.
Rezistencia na enfuvirtid in vivo:Ukázalo sa, že v III. fáze klinických štúdií rekombinanty HIV
obsahujúce gény env zo vzoriek HIV RNA, odobratých od 187 pacientov do 24. týždňa štúdie
mali > 4-násobný pokles citlivosti na enfuvirtid v porovnaní so vzorkami odobratými pred liečbou. U
185 (98,9%) z nich sa zistila substitúcia v génoch env v oblasti 36 - 45 proteínu gp41. Pozorovali sa substitúcie v pozíciách aminokyselín 38, 43, 36, 40, 42 a 45 – poradie je uvedené podľa klesajúcej frekvencie výskytu. Jednotlivé špecifické substitúcie na týchto oblastiach proteínu gp41 mali za následok zníženie citlivosti rekombinantných kmeňov voči enfuvirtidu v porovnaní s východiskovými hodnotami pred začiatkom liečby. Geometrický priemer zmien citlivosti sa pohyboval od 15,2- násobne nižšej citlivosti pre V38M až do 41,6-násobne nižšej citlivosti pre V38A. Nebol dostatok
príkladov mnohopočetných substitúcií na to, aby sa dali určiť stále vzory substitúcií alebo ich vplyv na citlivosť vírusu na enfuvirtid. Vzťah medzi týmito substitúciami a účinnosťou enfuvirtidu in vivo
nebol stanovený. Pokles citlivosti vírusu koreloval so stupňom rezistencie na ostatné antiretrovirotiká pred začiatkom liečby. (Pozri tabuľku 5)
Skrížená rezistencia: Vďaka novému zacieleniu účinku je enfuvirtid je in vitro rovnako účinný voči štandardným laboratórnym a klinickým izolátom a izolátom a tým, ktoré sú rezistentné na
1, 2 alebo dokonca na 3 skupiny ostatných antiretrovirotík (nukleozidové inhibítory reverznej transkriptázy, nenukleozidové inhibítory reverznej transkriptázy a inhibítory proteázy). A naopak, neočakáva sa, že mutanty so substitúciou aminokyselín na pozíciách 36 - 45 proteínu gp41, ktoré sú rezistentné na enfuvirtid, budú mať skríženú rezistenciu na iné antiretrovírusové lieky.
Klinické farmakodynamické údaje
Štúdie u pacientov užívajúcich iné antiretrovírusové lieky: Klinická účinnosť Fuzeonu (v kombinácii s
inými antiretrovírusovými liekmi) na plazmatické hladiny HIV RNA a počty CD4 sa skúmala v dvoch randomizovaných, multicentrických, kontrolovaných štúdiách (TORO 1 a TORO 2), v ktorých sa podával Fuzeon počas 48 týždňov. Populácia zahŕňala 995 pacientov, ktorí mali podstúpiť liečbu. Demografia pacientov zahŕňa priemernú východiskovú hladinu HIV-1 RNA 5,2 log10 kópií/ml a 5,1
log10 kópií/ml a priemerný východiskový počet buniek CD4 88 buniek/mm3 pre Fuzeon + ostatné
antiretrovirotiká a 97 buniek/mm3 pre ostatné antiretrovirotiká bez Fuzeonu. Predchádzajúca liečba pacientov bola priemerne 12 antiretrovírusových liekov, ktorými boli liečení priemerne 7 rokov.
Všetci pacienti boli liečení 3 až 5 antiretrovírusovými liekmi vybranými na základe predchádzajúcej liečby pacienta a podľa stanovenia genotypovej a fenotypovej rezistencie voči vírusu.
Pomer pacientov, ktorí v 48. týždni dosiahli počet vírusových kópií < 400 kópií/ml, bol 30,4%
u pacientov s Fuzeonom v kombinácii s ďalšími antiretrovirotikami v porovnaní s 12% pacientov liečených iba ostatnými antiretrovirotikami (ARV) bez Fuzeonu. Priemerné zvýšenie počtu buniek CD4 bolo vyššie u pacientov s režimom Fuzeon + ďalšie antiretrovirotiká v porovnaní s pacientami, ktorí dostávali len ostatné antiretrovirotiká. (Pozri tabuľku 4).
Tabuľka 4: Výsledky randomizovanej liečby v 48. týždni (štúdií TORO 1 a TORO 2,ITT)Výsledky
| FUZEON + os
tatné ARVB
90 mg dvakrát denne
(N = 661)
| Ostatné
ARV
(N = 334)
| Rozdiel medzi
ramenami
| 95%
Interval spoľahlivosti
| Hodnota p
|
HIV-1 RNA
Log zmeny v porovnaní s východiskovou hodnotou (log10 kópií/ml)**
| -1,48
| -0,63
| LSM
-0,85
| -1,073;
-0,628
| <,0001
|
Počet CD4+ počet buniek
Zmena z porovnaní s východiskovou hodnotou (bunky/mm3 )#
| +91
| +45
| LSM
46,4
| 25,1; 67,8
| <,0001
|
Pokles HIV RNA ≥ 1 log pod východiskovú hodnotu**
| 247 (37,4%)
| 57
(17,1%)
| Pomer pravde-
podobnosti výskytu
3,02
| 2,16; 4,20
| <,0001
|
HIV RNA
< 400 kópií/ml**
| 201 (30,4%)
| 40
(12,0%)
| Pomer pravde-
podobnosti výskytu
3,45
| 2,36; 5,06
| <,0001
|
HIV RNA
< 50 kópií/ml**
| 121 (18,3%)
| 26 (7,8%)
| Pomer pravde-
podobnosti výskytu
2,77
| 1,76; 4,37
| <,0001
|
Ukončenie v dôsledku
nežiaducich reakcií/pridružených ochorení/laboratórnych nálezov†
| 9%
| 11%
|
|
|
|
Ukončenie v dôsledku
reakcií v mieste podania†
| 4%
| N/A
|
|
|
|
Ukončenie v dôsledku iných
dôvodov†φ§
| 13%
| 25%
|
|
|
|
* Na základe výsledkov zo súhrnných údajov z TORO 1 a TORO 2 štúdií u ITT populácie jedincov, ktorí ďalej neboli
sledovaní, ukončili liečbu alebo u nich došlo k virologickej poruche, ktorá bola nahradená poslednou prehliadkou
(LOCF).
# Použitá posledná hodnota
** M-H test: Prerušenie liečby alebo virologická porucha, považovaná za chybu
† Percentuálny pomer u populácie liečenej Fuzeonom + ďalšie antiretrovirotiká (N = 663) a ďalšími antiretrovirotikami
(N = 334). Menovateľ pre stálych pacientov, ktorí neprešli z jednej skupiny do druhej: N = 112
φ Podľa úsudku skúšajúceho.
§ Zahŕňa prerušenie liečby z dôvodu vynechania následnej kontroly, odmietnutie liečby a iné dôvody
Liečba Fuzeonom a ostatnými antiretrovirotikami bola spojená s vyšším pomerom pacientov, ktorí dosiahli < 400 kópií/ml (alebo < 50 kópií/ml) vo všetkých podskupinách na základe východiskového počtu CD4 buniek, východiskovej hodnoty HIV-1 RNA, počtu predchádzajúcich antiretrovírusových liekov (ARV) v predchádzajúcej dobe alebo počtu účinných ARV, ktoré boli súčasťou režimu liečby
ostatnými antiretrovirotikami bez Fuzeonu. Avšak bola väčšia pravdepodobnosť, že jedinci
s východiskovým počtom CD4 buniek > 100 buniek/mm3, východiskovou hodnotou HIV-1 RNA
< 5,0 log10 kópií/ml, ≤ 10 pred liečbou ARVs a / alebo inými účinnými ARV v režime liečby ostatnými antiretrovirotikami, pri liečbe dosiahnu hodnotuHIV-1 RNA < 400 kópií/ml (alebo
< 50 kópií/ml). (Pozri tabuľku 5).
Tabuľka 5: Percento pacientov, ktorí v 48. týždni dosiahli < 400 kópií/ml a < 50 kópií/ml, podľa podskupiny (súhrnné údaje z TORO 1 a TORO 2, ITT) Podskupiny
| HIV-1 RNA < 400 kópií/ml
| HIV-1 RNA < 50 kópií/ml
| FUZEON + ostatné
ARV
90 mg 2-krát denne
(N = 661)
| Ostatné ARV (N = 334)
| FUZEON + ostatné
ARV
90 mg 2-krát denne
(N = 661)
| OSTATNÉ ARV
(N = 334)
| BL HIV-1 RNA < 5,0
1
log10 kópií/ml
| 118/269
(43,9%)
| 26/144
(18,1%)
| 77/269
(28,6%)
| 18/144
(12,5%)
| BL HIV-1 RNA ≥ 5,0
1
log10 kópií/ml
| 83/392
(21,2%)
| 14/190
(7,4%)
| 44/392
(11,2%)
| 8/190
(4,2%)
| Celkový počet
predchádzajúcich ARV
≤ 101
| 100/215
(46,5%)
| 29/120
(24,2%)
| 64/215
(29,8%)
| 19/120
(15,8%)
| Celkový počet predchádzajúcich ARV
> 101
| 101/446 (22,6%)
| 11/214 (5,1%)
| 57/446 (12,8%)
| 7/214 (3,3%)
| 0 podávaných účinných
ARV1,2
| 9/112
(8,0%)
| 0/53
(0%)
| 4/112
(3,5%)
| 0/53
(0%)
| 1 podávané účinné
ARV1,2
| 56/194
(28,9%)
| 7/95
(7,4%)
| 34/194
(17,5%)
| 3/95
(3,2%)
| ≥ 2 podávané účinné
ARV1,2
| 130/344
(37,8%)
| 32/183
(17,5%)
| 77/334
(22,4%)
| 22/183
(12,0%)
|
|
|
1 Prerušenie liečby alebo virologické poruchy, považovaná za zlyhanie
2 Na základe GSS skóre.
5.2 Farmakokinetické vlastnostiFarmakokinetické vlastnosti enfuvirtidu sa skúmali u dospelých a pediatrických pacientov infikovaných HIV-1.
Absorpcia: Absolútna biologická dostupnosť po subkutánnom podaní 90 mg enfuvirtidu do brucha bola 84,3 ± 15,5%. Priemerná hodnota (± SD) Cmax bola 4,59 ± 1,5 μg/ml, AUC bola
55,8 ± 12,1 μg
*hod/ml. Subkutánna absorpcia enfuvirtidu je priamo závislá od podanej dávky v
rozsahu 45 až 180 mg. Absorpcia dávky 90 mg pri podaní do brucha, stehna alebo ramena je porovnateľná. V štyroch rôznych štúdiách (N = 9 až 12) sa priemerná bazálna plazmatická koncentrácia rovnovážneho stavu pohybovala v rozsahu 2,6 až 3,4 μg/ml.
Distribúcia: Distribučný objem v rovnovážnom stave po intravenóznom podaní dávky 90 mg enfuvirtidu bol 5,5 ± 1,1 l. 92% enfuvirtidu sa u pacientov infikovaných HIV pri koncentráciách
2 až 10 μg/ml viaže na plazmatické bielkoviny. Z najväčšej časti sa viaže na albumín, z menšej časti
na kyslý α-1 glykoproteín. V štúdiách
in vitro enfuvirtid nebol vytlačovaný inými liekmi z ich väzobných miest, a ani enfuvirtid nevytlačoval iné lieky z ich väzobných miest. U HIV pacientov boli popísané hladiny enfuvirtidu v cerebrospinálnej tekutine ako zanedbateľné.
Metabolizmus: Keďže enfuvirtid je peptid, očakáva sa, že sa bude katabolizovať na jeho jednotlivé aminokyseliny s následnou recykláciou aminokyselín v tele. Štúdie ľudských mikrozómov uskutočnené
in vitro a štúdie
in vivo ukazujú, že enfuvirtid nie je inhibítorom enzýmov CYP450. V štúdiách skúmajúcich ľudské mikrozómy a hepatocyty
in vitro, hydrolýza amidovej skupiny C-konca
aminokyseliny fenylalanínu viedla k tvorbe deaminovaného metabolitu, pričom tvorba tohto metabolitu nie je závislá od NADPH. Tento metabolit sa dá zistiť v ľudskej plazme po podaní enfuvirtidu, pričom jeho AUC sa pohybujú medzi hodnotami 2,4 až 15% hodnôt AUC enfuvirtidu.
Eliminácia: Klírens enfuvirtidu po intravenóznom podaní 90 mg bol 1,4 ± 0,28 l/hod, polčas eliminácie bol 3,2 ± 0,42 hod. Po subkutánnom podaní dávky 90 mg enfuvirtidu subkutánne, bol polčas vylučovania enfuvirtidu 3,8 ± 0,6 hod. Štúdie hmotnostnej bilancie na určenie cesty eliminácie enfuvirtidu sa u ľudí neuskutočnili.
Hepatálna insuficiencia: Farmakokinetika enfuvirtidu sa u pacientov s poškodením funkcie pečene neskúmala.
Renálna insuficiencia: Analýza údajov plazmatických koncentrácií pacientov v klinických štúdiách ukázala, že klírens enfuvirtidu nie je klinicky významne ovplyvnený u pacientov s ľahkou až miernou poruchou funkcie obličiek. V štúdii, v ktorej sa sledovala porucha funkcie obličiek, bolo AUC zvýšené v priemere o 43-62 % u pacientov so závažným ochorením obličiek alebo u pacientov v konečnom štádiu ochorenia v porovnaní s pacientami s normálnou funkciou obličiek. Hemodialýza signifikantne nemenila klírens enfuvirtidu. Menej ako 13 % dávky sa odstránilo dialýzou. U pacientov s
poškodením funkcie obličiek nie je potrebná úprava dávky.
Staršie osoby: Farmakokinetika enfuvirtidu sa formálne u pacientov starších ako 65 rokov nesledovala.
Pohlavie a hmotnosť: Analýza plazmatických koncentrácií pacientov z klinických štúdií ukazuje, že klírens enfuvirtidu je o 20% nižší u žien než u mužov, a to bez ohľadu na hmotnosť. Klírens sa zvyšuje so zvyšujúcou sa telesnou hmotnosťou bez ohľadu na pohlavie (klírens je o 20% vyšší u
pacienta s hmotnosťou 100 kg a o 20% nižší u pacienta s hmotnosťou 40 kg v porovnaní s pacientom s hmotnosťou 70 kg). Tieto zmeny však nie sú klinicky významné, a preto úprava dávkovania nie je potrebná.
Rasa: Analýza údajov plazmatických koncentrácií od pacientov z klinických štúdií ukázala, že klírens enfuvirtidu sa nelíšil u ľudí čiernej a bielej rasy. Iné farmakokinetické štúdie nasvedčujú, že nie sú rozdiely medzi aziatmi a bielymi ľuďmi, ak sa dávka prispôsobí telesnej hmotnosti.
Pediatrickí pacienti: Farmakokinetika enfuvirtidu sa sledovala u 37 pediatrických pacientov. Dávka
2 mg/kg dvakrát denne (maximum 90 mg dvakrát denne) viedla k plazmatickým koncentráciám enfuvirtidu, ktoré boli podobné ako hladiny dospelých pacientov, ktorí dostávali 90 mg dvakrát denne. U 25 pediatrických pacientov vo veku od 5 do 16 rokov, ktorí dostávali 2 mg/kg dvakrát denne do ramena, prednej časti stehna alebo do brucha, boli priemerné AUC v rovnovážnom stave
54,3 ± 23,5 μg*hod/ml, Cmax bola 6,14 ± 2,48 μg/ml a Cmin bola 2,93 ± 1,55 μg/ml.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a vplyvu na embryonálny vývoj, neodhalili žiadne osobitné riziko pre ľudí. Dlhodobé štúdie karcinogenity na zvieratách neboli uskutočnené.
Štúdie na morčatách ukázali, že enfuvirtid môže spôsobiť oneskorenú kožnú precitlivenosť. Pri sledovaní odolnosti na infekciu chrípkou na potkanoch sa pozorovalo zhoršenie tvorby IFN-γ. Odolnosť na infekciu chrípkou a streptokokmi u potkanov bola len mierne porušená. Klinický význam týchto zistení nie je známy.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok
Uhličitan sodný Manitol Hydroxid sodný
Kyselina chlorovodíková
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
3 roky
Čas použiteľnosti po rekonštitúcii:
Ak sa liek chránil pred svetlom, chemická a fyzikálna stabilita je 48 hodín pri teplote 5°C.
Z mikrobiologického hľadiska sa má liek použiť okamžite. Ak sa nepoužije okamžite, za čas a spôsob skladovania pred použitím je zodpovedný používateľ. Ak sa rekonštitúcia neuskutočnila v kontrolovaných a zaručene aseptických podmienkach, čas skladovania za normálnych podmienok
pri 2°C až 8°C nemá byť dlhší než 24 hodín.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
Po rekonštitúcii: Uchovávajte v chladničke pri teplote (2°C – 8°C). Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom. Podmienky na uchovávanie rekonštituovaného lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Injekčná liekovka: 3 ml injekčná liekovka, bezfarebné sklo typu 1
Zátka: zátka, guma (neobsahujúca latex) Tesnenie: hliníková tesnenie s vyklápacím viečkom
Veľkosťbalenia
Každé balenie obsahuje 60 injekčných liekoviek s Fuzeonom
6.6 Špeciálne opatrenia na likvidáciu
Nepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s miestnymi požiadavkami.
Pred prvým použitím Fuzeonu sa musia pacienti poučiť o používaní a podávaní zdravotníckym pracovníkom.
Fuzeon sa musí rekonštituovať len s 1,1 ml vody na injekciu. Pacienti sa musia poučiť, že najskôr majú pridať vodu na injekciu a potom jemne poklepávať špičkou prsta na injekčnú liekovku, kým sa prášok nezačne rozpúšťať. Nikdy nesmú injekčnú liekovku trepať alebo ju otáčať zhora nadol, aby obsah premiešali – toto môže spôsobiť nadmerné spenenie. Po tom ako sa prášok začne rozpúšťať, môžu odložiť injekčnú liekovku nabok, aby sa prášok mohol úplne rozpustiť. Úplné rozpustenie prášku v roztoku môže trvať aj 45 minút. Pacient môže po pridaní vody na injekciu injekčnú liekovku jemne otáčať medzi rukami, a to až dovtedy, kým sa prášok úplne nerozpustí. Tento spôsob môže skrátiť čas potrebný na kompletné rozpustenie. Predtým, ako sa roztok natiahne pre použitie, pacient má prezrieť injekčnú liekovku a uistiť sa, či je obsah úplne vo forme roztoku, overiť
si, či je roztok číry a bez bublín alebo čiastočiek. Ak roztok obsahuje nejaké častice, injekčná liekovka sa nesmie použiť a musí sa zlikvidovať alebo vrátiť do lekárne.
Fuzeon neobsahuje žiadne konzervačné látky. Rekonštituovaný roztok sa má okamžite použiť. Ak sa rekonštituovaný roztok nemôže okamžite použiť, je potrebné ho až do použitia uskladniť v chladničke, pričom sa musí použiť v priebehu 24 hodín. Schladený rekonštituovaný roztok sa má pred použitím ohriať na izbovú teplotu.
1 ml rekonštituovaného roztoku sa má podať subkutánnou injekciou do ramena, brucha alebo prednej strany stehna. Injekcia sa má podať na iné miesto než bola podaná predchádzajúca injekcia, a to na miesto, na ktorom nie je prítomná žiadna reakcia. Injekčná liekovka je určená len na jednorazové použitie; nepoužitá časť sa musí znehodnotiť.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIRoche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/03/252/003
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE27. mája 2003
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry
(EMEA)
http://www.emea.europa.eu
PRÍLOHA II
A. DRŽITEĽ POVOLENIA NA VÝROBU ZODPOVEDNÝ ZA UVOĽNENIE ŠARŽE
B. PODMIENKY REGISTRÁCIE
C. OSOBITNÉ POVINNOSTI, KTORÉ MUSÍ SPLNIŤ
D
R
Ž
I
T
EĽ ROZHODNUTIA O REGISTRÁCII
A. DRŽITEĽ POVOLENIA NA VÝROBU ZODPOVEDNÝ ZA UVOĽNENIE ŠARŽE
Meno a adresa výrobcu zodpovedného za prepustenie šarže
Roche Pharma AG, Emil-Barrell-Str. 1, D-79639 Grenzach-Wyhlen, Nemecko
B. PODMIENKY REGISTRÁCIE
• PODMIENKY ALEBO OBMEDZENIA TÝKAJÚCE SA DODÁVKY A POUŽITIA, KTORÉ SA VZŤAHUJÚ NA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
Liek na lekársky predpis s obmedzením predpisovania (pozri prílohu I: Súhrn charakteristických vlastností lieku, časť 4.2).
• PODMIENKY ALEBO OBMEDZENIA S OHĽADOM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVANIE LIEKU
Neaplikovateľné.
• ĎALŠIE PODMIENKY
Držiteľ rozhodnutia bude pokračovať v predkladaní 6 mesačných PSURov.
C. OSOBITNÉ POVINNOSTI, KTORÉ MUSÍ SPLNIŤ DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Držiteľ rozhodnutia vykoná v určenom časovom rámci nasledujúci program štúdií, ktorých výsledky budú tvoriť základ každoročného prehodnotenia pomeru prínosu a rizika.
Klinické aspekty
SOB 005
Držiteľ rozhodnutia sa zaväzuje prerokovať ďalšie klinické štúdie, ak sa možná imunotoxicita nedá vylúčiť inými spôsobmi, vrátane funkčnosti neutrofilov, buniek prejavujúcich sa antigénne a
aktivity komplementu.
Po podaní návrhu na vykonanie ex vivo štúdií imunogenicity sa ďalej musí prediskutovať, či je rozšírený klinický program dostatočný na tento účel. Návrh držiteľa rozhodnutia vykonať ex vivo štúdie zameranej na účinok enfuvirtidu na tvorbu INF-γ bol prijatý.
Držiteľ rozhodnutia podal 13. februára 2007 predklinickú študijnú správu 1024389 “Enfuvirtide (Fuzeon, predtým T-20): potenciálny vplyv enfuvirtidu na sekréciu cytokínu ľudskými periférnymi krvnými bunkami“ a 20. marca 2007 ďalšie dokumenty.
Predklinická študijná správa a ďalšie dokumenty čakajú na prerokovanie, SOB 005 zostáva otvorená.
PRÍLOHA III
O
Z
N
AČENIE OBALU A PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV
A. OZNAČENIE OBALU








 ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
VONKAJŠÍ OBAL PRE BALENIE 1
1. NÁZOV LIEKU
ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
VONKAJŠÍ OBAL PRE BALENIE 1
1. NÁZOV LIEKU
Fuzeon 90 mg/ml prášok a rozpúšťadlo na injekčný roztok
Enfuvirtid
2. LIEČIVOKaždá injekčná liekovka Fuzeonu obsahuje 108 mg enfuvirtidu.
1 ml znova vytvoreného roztoku obsahuje 90 mg enfuvirtidu.
3. ZOZNAM POMOCNÝCH LÁTOKKaždá injekčná liekovka s práškom tiež obsahuje bezvodý uhličitan sodný, manitol, hydroxid sodný a
kyselinu chlorovodíkovú.
Každá injekčná liekovka s rozpúšťadlom obsahuje 2 ml vody na injekciu.
4. LIEKOVÁ FORMA A OBSAHPrášok a rozpúšťadlo na injekčný roztok
Obsah krabice:
60 injekčných liekoviek s práškom na injekčný roztok
60 injekčných liekoviek s rozpúšťadlom
60 3 ml striekačiek
60 1 ml striekačiek
180 tampónov s alkoholom
5. SPÔSOB A CESTA PODANIANa podkožné použitie
Pred použitím si prečítajte písomnú informáciu pre používateľov
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOSAHU A DOHĽADU DETÍUchovávajte mimo dosahu a dohľadu detí
7. INÉ ŠPECIÁLNE UPOZORNENIA, AK JE TO POTREBNÉ8. DÁTUM EXSPIRÁCIEEXP







 9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIE
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIE
Po rozpustení uchovávajte v chladničke
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom
10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉZvyšná voda na injekciu v injekčnej liekovke s rozpúšťadlom po odobratí 1,1 ml potrebného na
rozpustenie sa má zlikvidovať
11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCIIRoche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
12. REGISTRAČNÉ ČÍSLOEU/1/03/252/001
13. ČÍSLO VÝROBNEJ ŠARŽEČ. šarže
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJAVýdaj lieku viazaný na lekársky predpis.
15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSME









 ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VNÚTORNOM OBALE
BEZPROSTREDNÝ VONKAJŠÍ OBAL PRE INJEKČNÉ LIEKOVKY FUZEONU VOVNÚTRI BALENIA 1
1. NÁZOV LIEKU
ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VNÚTORNOM OBALE
BEZPROSTREDNÝ VONKAJŠÍ OBAL PRE INJEKČNÉ LIEKOVKY FUZEONU VOVNÚTRI BALENIA 1
1. NÁZOV LIEKU
Fuzeon 90 mg/ml prášok na injekčný roztok
Enfuvirtid
2. LIEČIVOKaždá injekčná liekovka obsahuje 108 mg enfuvirtidu.
1 ml znova vytvoreného roztoku obsahuje 90 mg enfuvirtidu.
3. ZOZNAM POMOCNÝCH LÁTOKKaždá injekčná liekovka tiež obsahuje bezvodý uhličitan sodný, manitol, hydroxid sodný a kyselinu
chlorovodíkovú.
4. LIEKOVÁ FORMA A OBSAHPrášok na injekčný roztok
60 injekčných liekoviek s práškom na injekčný roztok
5. SPÔSOB A CESTA PODANIANa podkožné použitie
Pred použitím si prečítajte písomnú informáciu pre používateľov
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOSAHU A DOHĽADU DETÍUchovávajte mimo dosahu a dohľadu detí
7. INÉ ŠPECIÁLNE UPOZORNENIA, AK JE TO POTREBNÉ8. DÁTUM EXSPIRÁCIEEXP
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIEPo rozpustení uchovávajte v chladničke
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom






 10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ
11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ
11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
Roche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
12. REGISTRAČNÉ ČÍSLOEU/1/03/252/001
13. ČÍSLO VÝROBNEJ ŠARŽEČ. šarže
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJAVýdaj lieku viazaný na na lekársky predpis.
15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSME






 MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
ŠTÍTOK NA INJEKČNEJ LIEKOVKE FUZEONU
1. NÁZOV LIEKU A CESTA PODANIA
MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
ŠTÍTOK NA INJEKČNEJ LIEKOVKE FUZEONU
1. NÁZOV LIEKU A CESTA PODANIA
Fuzeon 90 mg/ml prášok na injekčný roztok
Enfuvirtid
Podkožné použitie
2. SPÔSOB PODÁVANIAPred použitím si prečítajte písomnú informáciu pre používateľov
3. DÁTUM EXSPIRÁCIEEXP
4. ČÍSLO VÝROBNEJ ŠARŽEČ. šarže
5. OBSAH V HMOTNOSTNÝCH, OBJEMOVÝCH ALEBO V KUSOVÝCH JEDNOTKÁCH108 mg enfuvirtidu
6. INÉ










 ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VNÚTORNOM OBALE
BEZPROSTREDNÝ VONKAJŠÍ OBAL PRE INJEKČNÉ LIEKOVKY VODY NA INJEKCIU VO VNÚTRI BALENIA 1
1. NÁZOV LIEKU
ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VNÚTORNOM OBALE
BEZPROSTREDNÝ VONKAJŠÍ OBAL PRE INJEKČNÉ LIEKOVKY VODY NA INJEKCIU VO VNÚTRI BALENIA 1
1. NÁZOV LIEKU
Voda na injekciu
2. LIEČIVO3. ZOZNAM POMOCNÝCH LÁTOK4. LIEKOVÁ FORMA A OBSAHRozpúšťadlo na parenterálne použitie
V krabici je 60 injekčných liekoviek s 2 ml vody na injekciu
5. SPÔSOB A CESTA PODANIAVoda na injekciu je určená na rozpustenie lieku Fuzeon 90 mg/ml prášok na injekčný roztok na
podkožné použite
Pred použitím si prečítajte písomnúj informáciu pre používateľov
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOSAHU A DOHĽADU DETÍUchovávajte mimo dosahu a dohľadu detí
7. INÉ ŠPECIÁLNE UPOZORNENIA, AK JE TO POTREBNÉ8. DÁTUM EXSPIRÁCIEEXP
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIE10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBOODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉZvyšná vodu na injekciu v injekčnej liekovke s rozpúšťadlom po odobratí 1,1 ml potrebného na
rozpustenie sa má zlikvidovať





 11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
Roche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
12. REGISTRAČNÉ ČÍSLOEU/1/03/252/001
13. ČÍSLO VÝROBNEJ ŠARŽEČ. šarže
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJAVýdaj lieku viazaný na lekársky predpis.
15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSME






 MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
ŠTÍTOK NA INJEKČNEJ LIEKOVKE VODY NA INJEKCIU
1. NÁZOV LIEKU A CESTA PODANIA
MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
ŠTÍTOK NA INJEKČNEJ LIEKOVKE VODY NA INJEKCIU
1. NÁZOV LIEKU A CESTA PODANIA
Voda na injekciu
Podkožné použitie
2. SPÔSOB PODÁVANIAPred použitím si prečítajte písomnú informáciu pre používateľov
3. DÁTUM EXSPIRÁCIEEXP
4. ČÍSLO VÝROBNEJ ŠARŽEČ. šarže
5. OBSAH V HMOTNOSTNÝCH, OBJEMOVÝCH ALEBO V KUSOVÝCH JEDNOTKÁCH2 ml
6. INÉ








 ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
VONKAJŠÍ OBAL PRE BALENIE 2
1. NÁZOV LIEKU
ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
VONKAJŠÍ OBAL PRE BALENIE 2
1. NÁZOV LIEKU
Fuzeon 90 mg/ml prášok a rozpúšťadlo na injekčný roztok
Enfuvirtid
2. LIEČIVOKaždá injekčná liekovka obsahuje 108 mg enfuvirtidu.
1 ml znova vytvoreného roztoku obsahuje 90 mg enfuvirtidu.
3. ZOZNAM POMOCNÝCH LÁTOKKaždá injekčná liekovka s práškom obsahuje bezvodý uhličitan sodný, manitol, hydroxid sodný a
kyselinu chlorovodíkovú.
Každá injekčná liekovka s rozpúšťadlom obsahuje 2 ml vody na injekciu.
4. LIEKOVÁ FORMA A OBSAHPrášok a rozpúšťadlo na injekčný roztok
Obsah krabice:
60 injekčných liekoviek s práškom na injekčný roztok
60 injekčných liekoviek s rozpúšťadlom
5. SPÔSOB A CESTA PODANIANa podkožné použite
Pred použitím si prečítajte písomnú informáciu pre používateľov
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOSAHU A DOHĽADU DETÍUchovávajte mimo dosahu a dohľadu detí
7. INÉ ŠPECIÁLNE UPOZORNENIA, AK JE TO POTREBNÉ8. DÁTUM EXSPIRÁCIEEXP







 9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIE
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIE
Po rozpustení uchovávajte v chladničke
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom
10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉZvyšná voda na injekciu v injekčnej liekovke s rozpúšťadlom po odobratí 1,1 ml potrebného na
rozpustenie sa má zlikvidovať
11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCIIRoche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
12. REGISTRAČNÉ ČÍSLOEU/1/03/252/002
13. ČÍSLO VÝROBNEJ ŠARŽEČ. šarže
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJAVýdaj lieku viazaný na lekársky predpis
15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSME









 ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VNÚTORNOM OBALE
BEZPROSTREDNÝ VONKAJŠÍ OBAL PRE INJEKČNÉ LIEKOVKY FUZEONU VOVNÚTRI BALENIA 2
1. NÁZOV LIEKU
ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VNÚTORNOM OBALE
BEZPROSTREDNÝ VONKAJŠÍ OBAL PRE INJEKČNÉ LIEKOVKY FUZEONU VOVNÚTRI BALENIA 2
1. NÁZOV LIEKU
Fuzeon 90 mg/ml prášok a rozpúšťadlo na injekčný roztok
Enfuvirtid
2. LIEČIVOKaždá injekčná liekovka Fuzeonu obsahuje 108 mg enfuvirtidu.
1 ml znova vytvoreného roztoku obsahuje 90 mg enfuvirtidu.
3. ZOZNAM POMOCNÝCH LÁTOKKaždá injekčná liekovka tiež obsahuje bezvodý uhličitan sodný, manitol, hydroxid sodný a kyselinu
chlorovodíkovú.
4. LIEKOVÁ FORMA A OBSAHPrášok na injekčný roztok
60 injekčných liekoviek s práškom na injekčný roztok
5. SPÔSOB A CESTA PODANIANa podkožné použite
Pred použitím si prečítajte písomnú informáciu pre používateľov
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOSAHU A DOHĽADU DETÍUchovávajte mimo dosahu a dohľadu detí
7. INÉ ŠPECIÁLNE UPOZORNENIA, AK JE TO POTREBNÉ8. DÁTUM EXSPIRÁCIEEXP
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIEPo rozpustení uchovávajte v chladničke







Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom
10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCIIRoche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
12. REGISTRAČNÉ ČÍSLOEU/1/03/252/002
13. ČÍSLO VÝROBNEJ ŠARŽEČ. šarže
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJAVýdaj lieku viazaný na lekársky predpis
15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSME






 MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
ŠTÍTOK NA INJEKČNEJ LIEKOVKE FUZEONU
1. NÁZOV LIEKU A CESTA PODANIA
MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
ŠTÍTOK NA INJEKČNEJ LIEKOVKE FUZEONU
1. NÁZOV LIEKU A CESTA PODANIA
Fuzeon 90 mg/ml prášok na injekčný roztok
Enfuvirtid
Podkožné použitie
2. SPÔSOB PODÁVANIAPred použitím si prečítajte písomnú informáciu pre používateľov
3. DÁTUM EXSPIRÁCIEEXP
4. ČÍSLO VÝROBNEJ ŠARŽEČ. šarže
5. OBSAH V HMOTNOSTNÝCH, OBJEMOVÝCH ALEBO V KUSOVÝCH JEDNOTKÁCH108 mg enfuvirtidu
6. INÉ










 ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VNÚTORNOM OBALE
BEZPROSTREDNÝ VONKAJŠÍ OBAL PRE INJEKČNÚ LIEKOVKU VODY NA INJEKCIU
- VO VNÚTRI BALENIA 2
1. NÁZOV LIEKU
ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VNÚTORNOM OBALE
BEZPROSTREDNÝ VONKAJŠÍ OBAL PRE INJEKČNÚ LIEKOVKU VODY NA INJEKCIU
- VO VNÚTRI BALENIA 2
1. NÁZOV LIEKU
Voda na injekciu
2. LIEČIVO3. ZOZNAM POMOCNÝCH LÁTOK4. LIEKOVÁ FORMA A OBSAHRozpúšťadlo na parenterálne použitie
V krabici je 60 injekčných liekoviek s 2 ml vody na injekciu
5. SPÔSOB A CESTA PODANIAVoda na injekciu je určená na rozpustenie lieku Fuzeon 90 mg/ml prášok na injekčný roztok na
získanie roztoku na podkožné použitie
Pred použitím si prečítajte písomnú informáciu pre používateľov
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOSAHU A DOHĽADU DETÍUchovávajte mimo dosahu a dohľadu detí
7. INÉ ŠPECIÁLNE UPOZORNENIA, AK JE TO POTREBNÉ8. DÁTUM EXSPIRÁCIEEXP
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIE10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBOODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉZvyšná voda na injekciu v injekčnej liekovke s rozpúšťadlom po odobratí 1,1 ml potrebného na
rozpustenie sa má zlikvidovať





 11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
Roche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
12. REGISTRAČNÉ ČÍSLOEU/1/03/252/002
13. ČÍSLO VÝROBNEJ ŠARŽEČ. šarže
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJAVýdaj lieku viazaný na lekársky predpis
15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSME






 MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
ŠTÍTOK NA INJEKČNEJ LIEKOVKE VODY NA INJEKCIU
1. NÁZOV LIEKU A CESTA PODANIA
MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
ŠTÍTOK NA INJEKČNEJ LIEKOVKE VODY NA INJEKCIU
1. NÁZOV LIEKU A CESTA PODANIA
Voda na injekciu
Podkožné použitie
2. SPÔSOB PODÁVANIAPred použitím si prečítajte písomnú informáciu pre používateľov
3. DÁTUM EXSPIRÁCIEEXP
4. ČÍSLO VÝROBNEJ ŠARŽEČ. šarže
5. OBSAH V HMOTNOSTNÝCH, OBJEMOVÝCH ALEBO V KUSOVÝCH JEDNOTKÁCH2 ml
6. INÉ









 ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
VONKAJŠÍ OBAL PRE BALENIE OBSAHUJÚCE LEN INJEKČNÉ LIEKOVKY FUZEONU
1. NÁZOV LIEKU
ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
VONKAJŠÍ OBAL PRE BALENIE OBSAHUJÚCE LEN INJEKČNÉ LIEKOVKY FUZEONU
1. NÁZOV LIEKU
Fuzeon 90 mg/ml prášok na injekčný roztok
Enfuvirtid
2. LIEČIVOKaždá injekčná liekovka obsahuje 108 mg enfuvirtidu.
1 ml znova vytvoreného roztoku obsahuje 90 mg enfuvirtidu.
3. ZOZNAM POMOCNÝCH LÁTOKKaždá injekčná liekovka tiež obsahuje bezvodý uhličitan sodný, manitol, hydroxid sodný a kyselinu
chlorovodíkovú.
4. LIEKOVÁ FORMA A OBSAHPrášok na injekčný roztok
60 injekčných liekoviek s práškom na injekčný roztok
5. SPÔSOB A CESTA PODANIANa podkožné použitie
Pred použitím si prečítajte písomnú informáciu pre používateľov
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOSAHU A DOHĽADU DETÍUchovávajte mimo dosahu a dohľadu detí
7. INÉ ŠPECIÁLNE UPOZORNENIA, AK JE TO POTREBNÉ8. DÁTUM EXSPIRÁCIEEXP
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIEPo rozpustení uchovávajte v chladničke







Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom
10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCIIRoche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
12. REGISTRAČNÉ ČÍSLOEU/1/03/252/003
13. ČÍSLO VÝROBNEJ ŠARŽEČ. šarže
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJAVýdaj lieku viazaný na lekársky predpis
15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSME






 MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
ŠTÍTOK NA INJEKČNEJ LIEKOVKE FUZEONU
1. NÁZOV LIEKU A CESTA PODANIA
MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
ŠTÍTOK NA INJEKČNEJ LIEKOVKE FUZEONU
1. NÁZOV LIEKU A CESTA PODANIA
Fuzeon 90 mg/ml prášok na injekčný roztok
Enfuvirtid
Na podkožné použitie
2. SPÔSOB PODÁVANIAPred použitím si prečítajte písomnú informáciu pre používateľov
3. DÁTUM EXSPIRÁCIEEXP
4. ČÍSLO VÝROBNEJ ŠARŽEČ. šarže
5. OBSAH V HMOTNOSTNÝCH, OBJEMOVÝCH ALEBO V KUSOVÝCH JEDNOTKÁCH108 mg enfuvirtidu
6. INÉ
B. PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV
Fuzeon 90 mg/ml prášok a rozpúšťadlo na injekčný roztok
Enfuvirtid
Pozorne si prečítajte celú písomnú informáciu skôr, ako začnete používať Váš liek.
- Túto písomnú informáciu si uschovajte. Možno bude potrebné aby ste si ju znovu prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
- Tento liek bol predpísaný iba Vám. Nedávajte ho nikomu inému. Môže mu uškodiť, dokonca aj vtedy, ak má rovnaké príznaky ako Vy.
- Ak začnete pociťovať akýkoľvek vedľajší účinok ako závažný alebo ak spozorujete vedľajšie účinky, ktoré nie sú uvedené v tejto písomnej informácii pre používateľov, povedzte to, prosím, svojmu lekárovi alebo lekárnikovi.
V tejto písomnej informácii pre používateľov:
1. Čo je Fuzeon a na čo sa používa
2. Skôr ako použijete Fuzeon
3. Ako používať Fuzeon
4. Možné vedľajšie účinky
5. Ako uchovávať Fuzeon
6. Ďalšie informácie
1. ČO JE FUZEON A NA ČO SA POUŽÍVA
Čo je Fuzeon
Fuzeon potláča vstup ľudského vírusu imunitnej nedostatočnosti (HIV) do buniek, ktoré vírus HIV
napáda (nazývajú sa CD4 alebo T-bunky) v krvi. Zabraňuje tomu, aby sa HIV dostal do kontaktu s postihnutou membránou bunky. To znamená, že HIV nemôže vstúpiť do bunky a množiť sa, pretože aby sa HIV mohol množiť, potrebuje DNA hostiteľskej bunky.
Kedy sa má Fuzeon používať
Fuzeon sa používa v kombinácii s inými antiretrovírusovými liekmi v liečbe pacientov infikovaných
HIV vírusom, ktorý spôsobuje AIDS. Váš lekár Vám predpísal Fuzeon preto, aby sa dala infekcia HIV
lepšie zvládnuť. Liečba Fuzeonom neznamená vyliečenie HIV infekcie. Nikdy nepoužívajte znečistené ihly, a ani sa s nikým o ne nedeľte.
2. SKÔR AKO POUŽIJETE FUZEON Nepoužívajte Fuzeon
- keď ste alergický (precitlivený) na enfuvirtid alebo niektorú z ďalších zložiek Fuzeonu.
Buďte zvlášť opatrný pri používaní Fuzeonu
Informujte svojho lekára
- keď trpíte nejakou inou chorobou
- keď ste v minulosti prekonali alebo v súčasnosti trpíte nejakým pľúcnym ochorením, alebo si podávate intravenózne drogy alebo fajčíte
- keď ste mali v minulosti problémy s obličkami.
Fuzeon neznižuje riziko prenosu HIV na iných ľudí prostredníctvom sexuálneho kontaktu alebo kontaminovanou krvou. Preto je potrebné naďalej dodržiavať všetky opatrenia, ktoré zabraňujú prenosu HIV na iných. Liečba Fuzeonom neznamená vyliečenie HIV infekcie.
U niektorých pacientov s pokročilou HIV infekciou (AIDS) a oportúnnou infekciou v anamnéze sa po krátkom čase od začatia liečby HIV môžu vyskytnúť známky a príznaky zápalu z predošlých infekcií.
Predpokladá sa, že tieto príznaky sú dôsledkom zlepšenia imunitnej odpovede organizmu, ktorá mu umožňuje prekonávať infekcie, ktoré môžu byť prítomné bez akýchkoľvek zjavných príznakov. Ak spozorujete akékoľvek príznaky infekcie, prosím informujte o tom okamžite svojho lekára.
Problémy s kosťami
U niektorých pacientov, ktorí sú liečení kombinovanou protivírusovou liečbou, sa môže rozvinúť ochorenie kostí nazývané osteonekróza (odumretie kostného tkaniva spôsobené prerušením prísunu krvi do kosti). Niektoré z mnohých rizikových faktorov pre rozvoj tohto ochorenia môžu byť, okrem iného, dĺžka kombinovanej protivírusovej liečby, používanie kortikosteroidov, konzumácia alkoholu, závažné potlačenie imunitných reakcií, vyšší index telesnej hmotnosti. Prejavmi osteonekrózy sú stuhnutosť kĺbov, bolesť kĺbov (hlavne bedra, kolena a ramena) a ťažkosti pri pohybe. Ak spozorujete niektorý z týchto príznakov, informujte, prosím, svojho lekára.
Užívanie iných liekov
Ak užívate alebo ste v poslednom čase užívali ešte iné lieky, vrátane liekov, ktorých výdaj nie je viazaný na lekársky predpis, prosím, oznámte to svojmu lekárovi alebo lekárnikovi. Fuzeon nemá interakcie s inými liekmi pôsobiacimi proti HIV, ani s rifampicínom (antibiotikum).
Používanie Fuzeonu s jedlom a nápojmi
Fuzeon môžete používať spolu s jedlom alebo bez jedla, ale mali by ste dodržiavať inštrukcie, ktoré sú uvedené v písomných informáciách pre používateľov ostatných liekov, ktoré užívate.
Tehotenstvo a dojčenie
Tehotné ženy a dojčiace matky nemajú užívať Fuzeon, pokiaľ im to osobitne neurčí ich lekár. Ak ste otehotneli, alebo by ste mohli byť tehotná alebo dojčíte svoje dieťa, oznámte to okamžite svojmu'
lekárovi. Ženám infikovaným HIV sa neodporúča dojčiť, pretože materským mliekom sa môže vírus
HIV preniesť na dieťa. Skôr ako začnete užívať akýkoľvek liek, poraďte sa so svojim lekárom alebo lekárnikom.
Vedenie vozidla a obsluha strojov
Vplyv Fuzeonu na schopnosť viesť vozidlá a obsluhovať stroje nebol skúmaný. Avšak, ak pri používaní Fuzeonu pociťujete závrat, radšej nejazdite.
3. AKO POUŽÍVAŤ FUZEON
Vždy používajte Fuzeon presne tak, ako Vám povedal lekár. Ak si nie ste niečim istý, overte si to u svojho lekára alebo lekárnika.
Zvyčajná dávka je 90 mg dvakrát denne, podávaná v 1 ml roztoku podkožnou (tesne pod kožu)
injekciou.
Ďalšie pokyny pre používanie Fuzeonu sú uvedené na konci tejto písomnej informácie pre používateľov. Tam nájdete pokyny ako si pripravíte Fuzeon a ako si ho sám injekčne podáte.
Ak ste použili viac Fuzeonu ako by ste mali
Nie je žiadne špecifické antidotum pre predávkovanie Fuzeonom. Ak použijete viac Fuzeonu ako je odporúčaná dávka, prosím kontaktujte vášho lekára.
Ak ste zabudli použiť Fuzeon
Podajte si dávku čo najskôr, ako ste si na ňu spomenuli a ďalšiu dávku si podajte v pravidelnom čase. Dávku, na ktorú ste zabudli, si nepodajte v prípade, že ďalšiu bežnú dávku máte použiť za menej než
6 hodín a nikdy nepoužívajte dvojitú dávku, aby ste nahradili vynechanú dávku.
4. MOŽNÉ VEDĽAJŠIE ÚČINKY
Tak ako všetky lieky, Fuzeon môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
V klinických štúdiách sa u pacientov liečených Fuzeonom pozoroval vyšší výskyt zápalu pľúc. Ak sa u Vás objaví kašeľ s vysokou teplotou, rýchle dýchanie a/alebo dušnosť, je dôležité o tom informovať lekára, pretože tieto príznaky môžu znamenať, že sa u Vás rozvíja zápal pľúc.
Najčastejší vedľajší účinok, ktorý sa vyskytuje pri používaní Fuzeonu, sú reakcie v mieste, do ktorého si podávate injekciu. Je pravdepodobné, že v mieste, do ktorého si podávate injekciu s liekom, sa vyskytne jedna alebo viac miernych až stredne závažných reakcií: svrbenie, opuch, začervenanie, bolesť alebo citlivosť, zhrubnutie kože alebo hrčky. Tieto reakcie sa môžu objaviť počas prvého týždňa liečby a obvykle sa v priebehu ďalšej liečby Fuzeonom nezhoršujú. Reakcie v jednotlivých miestach podania injekcie trvajú zvyčajne 7 dní alebo menej.
Reakcie v mieste podania sa môžu zhoršiť, ak sa injekcie podávajú na to isté miesto na tele, alebo keď
sa injekcia podá hlbšie ako by sa mala (napríklad do svalu).
Veľmi častými vedľajšími účinkami (u viac ako jednej osôb z desiatich) sú bolesť a znížená citlivosť
rúk, chodidiel alebo nôh a strata hmotnosti.
Častými vedľajšími účinkami (u viac ako u jednej zo sto osôb, ale menej ako jednej osoby z desiatich) sú zápal dutín, lokálny opuch na koži, pneumónia “chrípka”, infekcia ucha, opuchnuté žľazy, znížená chuť do jedla, nechutenstvo, zvýšené hodnoty tuku v krvi, cukrovka, pocit úzkosti alebo podráždenosti, nočné mory, pocit závrate, strata koncentrácie, tremor (tras), zapálené očné viečka, upchanie nosa, zápal pankreasu, pálenie pri srdci, suchá koža, ekzém, začervenanie pokožky, akné, bolesť svalov, obličkové kamene, príznaky podobné “chrípke”, pocit slabosti a krv v moči.
Je potrebné si uvedomiť, že reakcie v mieste podania sú bežnými vedľajšími účinkami (u viac ako u jednej osoby zo sto, ale menej ako u jednej osoby z desiatich) užívania Fuzeonu. Ak sa u Vás objavia reakcie v mieste podania, je dôležité, aby ste neprestali užívať Fuzeon skôr než si Vaše problémy prediskutujete s lekárom.
Vo vzácnych prípadoch dôjde k infekcii v miestach podania injekcie. Aby sa znížilo riziko infekcie, je dôležité sa pridŕžať nižšie uvedených pokynov pre podávanie injekcie Fuzeonu.
Precitlivenosť (alergia) na Fuzeon je zriedkavá (u viac ako u jednej osoby z desaťtisíc, ale menej ako u jednej osoby z tisíc). Ak sa však u Vás objavia príznaky, ktoré môžu znamenať, že ste alergický/á na tento liek, musíte ho okamžite prestať užívať a povedať o tom čo najskôr Vášmu lekárovi. Príznaky, ktoré by ste si mali všímať, sú vyrážka, vysoká teplota alebo zimnica, pocit nevoľnosti alebo choroby, potenie a triaška. Tieto príznaky neznamenajú jednoznačne, že ste alergický/á na tento liek, avšak musíte ich prediskutovať s lekárom.
Ak začnete pociťovať akýkoľvek vedľajší účinok ako závažný alebo ak spozorujete vedľajšie účinky, ktoré nie sú uvedené v tejto písomnej informácii pre používateľov, povedzte to, prosím, svojmu lekárovi alebo lekárnikovi.
5. AKO UCHOVÁVAŤ FUZEON
Uchovávajte mimo dosahu a dohľadu detí.
Nepoužívajte Fuzeon po dátume exspirácie, ktorý je uvedený buď na štítku Fuzeonu alebo na štítku inječnej liekovky Vody na injekciu po EXP. Dátum exspirácie sa vzťahuje na posledný deň v mesiaci.
Injekčné liekovky Fuzeonu alebo vody na injekciu nevyžadujú žiadne zvláštne podmienky na uchovávanie.
Keď sa už pripraví roztok na injekciu, má sa použiť okamžite. Ak sa nepoužije ihneď, musí sa uchovávať v chladničke pri teplote (2°C - 8°C) a použiť do 24 hodín. Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Nepoužívajte Fuzeon, keď spozorujete akékoľvek čiastočky v prášku alebo roztoku po pridaní vody na injekciu. Takisto nepoužívajte vodu na injekciu, ak ste videli v liekovke nejaké čiastočky alebo ak je voda skalená.
6. ĎALŠIE INFORMÁCIE
Čo Fuzeon obsahuje
- Liečivo je enfuvirtid. Po rozpustení s rozpúšťadlom vznikne 1 ml nariedeného roztoku, ktorý obsahuje 90 mg enfuvirtidu.
- Ďalšie zložky sú:
Prášok
Bezvodý uhličitan sodný
Manitol
Hydroxid sodný
Kyselina chlorovodíková
Rozpúšťadlo
Voda na injekciu
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, to znamená, že je v podstate
„bez sodíka“.
Ako vyzerá Fuzeon a a obsah balenia
Fuzeon prášok a rozpúšťadlo na injekčný roztok sa dodáva v baleniach, ktoré obsahujú:
60 injekčných liekoviek s Fuzeonom
60 injekčných liekoviek s vodou na injekciu, ktorá sa používa na nariedenie prášku Fuzeon
60 ks 3 ml striekačiek
60 ks 1 ml striekačiek
180 alkoholových tampónov.
Toto balenie obsahuje všetko, čo potrebujete k príprave a používaniu Fuzeonu počas 30 dní. Fuzeon je tiež dostupný v baleniach, ktoré obsahujú 60 injekčných liekoviek s Fuzeonom a
60 injekčných liekoviek s vodou na injekciu.
Držiteľ rozhodnutia o registrácii
Roche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
Výrobca zodpovedný za prepustenie šarže je
Roche Pharma AG Emil-Barell-Str.1,
D-79639 Grenzach-Wyhlen
Nemecko
Ak potrebujete akúkoľvek informáciu o tomto lieku kontaktujte, prosím, miestneho zástupcu držiteľa rozhodnutia o registrácii:
België/Belgique/Belgien
N.V. Roche S.A.
Tél/Tel: +32 (0) 2 525 82 11
| Luxembourg/Luxemburg
(Voir/siehe Belgique/Belgien)
|
България
Рош България ЕООД Тел: +359 2 818 44 44
|
Magyarország
Roche (Magyarország) Kft. Tel: +36 - 23 446 800
|
Česká republika
Roche s. r. o.
Tel: +420 - 2 20382111
|
Malta
(See United Kingdom)
|
Danmark
Roche a/s
Tlf: +45 - 36 39 99 99
|
Nederland
Roche Nederland B.V. Tel: +31 (0) 348 438050
|
Deutschland Roche Pharma AG Tel: +49 (0) 7624 140
|
Norge
Roche Norge AS
Tlf: +47 - 22 78 90 00
|
Eesti
Roche Eesti OÜ
Tel: + 372 - 6 112 401
|
Österreich
Roche Austria GmbH Tel: +43 (0) 1 27739
|
Ελλάδα
Roche (Hellas) A.E.
Τηλ: +30 210 61 66 100
|
Polska
Roche Polska Sp.z o.o. Tel: +48 - 22 345 18 88
|
España
Roche Farma S.A.
Tel: +34 - 91 324 81 00
|
Portugal
Roche Farmacêutica Química, Lda
Tel: +351 - 21 425 70 00
|
France
Roche
Tél: +33 (0) 1 46 40 50 00
|
România
Roche România S.R.L. Tel: +40 21 206 47 01
|
Ireland
Roche Products (Ireland) Ltd. Tel: +353 (0) 1 469 0700
|
Slovenija
Roche farmacevtska družba d.o.o. Tel: +386 - 1 360 26 00
|
Ísland
Roche a/s
c/o Icepharma hf
Sími: +354 540 8000
|
Slovenská republika Roche Slovensko, s.r.o. Tel: +421 - 2 52638201
|
Italia
Roche S.p.A.
Tel: +39 - 039 2471
|
Suomi/Finland
Roche Oy
Puh/Tel: +358 (0) 9 525 331
|
Kύπρος
Γ.Α.Σταμάτης & Σια Λτδ.
Τηλ: +357 - 22 76 62 76
Sverige
Roche AB
Tel: +46 (0) 8 726 1200
Latvija
Roche Latvija SIA Tel: +371 - 7 039831
United Kingdom
Roche Products Ltd.
Tel: +44 (0) 1707 366000
Lietuva
UAB “Roche Lietuva” Tel: +370 5 2546799
Táto písomná informácia pre používateľov bola naposledy schválená vTomuto lieku bolo udelené „schválenie s podmienkou“.
To znamená, že sa očakávajú ďalšie doplňujúce informácie týkajúce sa tohto lieku.
Európska lieková agentúra (EMEA) bude každý rok posudzovať nové informácie o lieku, ktoré budú dostupné a podľa potreby aktualizovať túto písomnú informáciu.
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry (EMEA)
http://www.emea.europa.eu. Sú tam aj odkazy na ďalšie internetové stránky o zriedkavých ochoreniach a ich liečbe.
AKO SA MÁ POUŽÍVAŤ FUZEONFuzeon vždy používajte presne podľa pokynov svojho lekára. Ak si nie ste niečim istý, overte si to u svojho lekára alebo lekárnika.
Zvyčajná dávka je 90 mg dvakrát denne, podávaná v 1 ml podkožne (tesne pod kožu) do ramena, prednej steny stehna alebo brucha. Každá injekcia sa má podať na iné miesto, než je miesto poslednej injekcie a nikdy nepodávajte injekciu na miesto, kde je prítomná reakcia po predchádzajúcej dávke. Nepodávajte Váš liek do materských znamienok, jazvovitého tkaniva, podliatin alebo pupka.
Kedy sa má Fuzeon používaťNajlepšie je používať Fuzeon každý deň v tom istom čase. Skúste, aký čas Vám bude vyhovovať, pričom si naplánujte dávky tak, že medzi nimi budú rovnaké intervaly. Vhodný čas na podávanie je hneď ráno po prebudení a potom zase večer.
Ďalej je potrebné postupovať krok za krokom podľa návodu na podanie Vášho lieku. Prosím kontaktujte Vášho lekára alebo lekárnika, ak máte nejaké otázky ohľadne podávania Fuzeonu.
Ako dlho máte používať Fuzeon?Liek máte používať dovtedy, kým Vám lekár neoznámi, že jeho podávanie máte ukončiť. Ak skončíte alebo prerušíte liečbu Fuzeonom, môže sa stať HIV vo Vašej krvi skôr rezistentným než by k tomu došlo pri pravidelnom používaní a bez prerušovania liečby. HIV vírus vo Vašej krvi sa nakoniec môže
stať rezistentným na Fuzeon, čo spôsobí vzostup hladín vírusu v krvi. Vtedy sa Váš lekár môže
rozhodnúť nepokračovať ďalej v liečbe Fuzeonom a mal by to s Vami prediskutovať.
Čo máte robiť, ak ste ľavákObrázky v tejto písomnej informácii ukazujú osoby, ktoré sú pravákmi. Ak ste ľavák/ľaváčka, robte to, čo sa Vám zdá prirodzené. Pravdepodobne sa Vám bude zdať najpohodlnejšie držať striekačku v
ľavej ruke a injekčnú liekovku držať medzi palcom a ukazovákom pravej ruky.
Keď máte pri sebe osobu, ktorá Vám pomôže


Niektoré miesta na podanie injekcie, napríklad nadlaktie, môže byť na začiatku zložité používať. Zabezpečte si, aby bol pri Vás partner, priateľ alebo člen rodiny, ak budete potrebovať pomoc. Aby sa znížilo riziko poranenia ihlou, je vhodné, aby osoba, ktorá Vám pomáha sa zúčastnila školenia ako podať injekciu.
Vaše injekčné striekačkyInjekčné striekačky, ktoré sa dodávajú s týmto liekom, majú farebný ochranný kryt na ochranu ihly, ktorý je pripojený k ihle. Tento ochranný kryt zabezpečí ihlu po použití a znižuje riziko poranenia ihlou.
Hoci tieto injekčné striekačky majú tento ochranný kryt, je dôležité, aby ste použité injekčné striekačky zlikvidovali správnym spôsobom podľa pokynov, ktoré Vám dal Váš lekár.
Tipy pre bezpečnosť● Dôkladne si umyte ruky, aby ste znížili riziko bakteriálnych infekcií. Nedotýkajte sa ničoho
okrem lieku a pomôcok.
● Keď manipulujete s injekčnou striekačkou, nedotýkajte sa ihly. Nedotýkajte sa vrchnej časti injekčnej liekovky potom, ako ste ju už očistili alkoholovým tampónom.
● Preverte si, či žiadna súčasť Vašej súpravy nebola otvorená. Nepoužívajte tie súčasti, ktoré boli otvorené.
• Nikdy nepoužívajte striekačku s ohnutou alebo poškodenou ihlou.
● Nikdy nemiešajte Váš liek s vodou z vodovodu.
● Nikdy nepodávajte Váš liek s inými injekčnými liekmi.
● Jediným odporúčaným spôsobom podania je subkutánna injekcia (pod kožu). Fuzeon sa
nesmiepodávať intravenózne (priamo do žily) alebo intramuskulárne (priamo do svalu).
● Použité injekčné striekačky zahadzujte do nádoby určenej na odpadky, ktorá má vrchnák, aby sa zabezpečila bezpečná likvidácia odpadového materiálu. Ak máte nejaké otázky týkajúce sa bezpečnej likvidácie týchto materiálov, kontaktujte Vášho lekára.
AKO ZAČAŤPripravte si pomôckyPripravte si všetky nasledujúce pomôcky:
● Jednu injekčnú liekovku s Fuzeonom (sklenená nádobka obsahujúca biely prášok)
● Jednu injekčnú liekovku s vodou na injekciu (sklenená nádobka obsahujúca číru a bezfarebnú tekutinu)
● Jednu 3 ml injekčnú striekačku (väčšia striekačka) s 25 mm ihlou
● Jednu 1 ml injekčnú striekačku (menšia striekačka) s 13 mm ihlou
● 3 alkoholové tampóny
● Nádobu na odpad s vrchnákom na bezpečnú likvidáciu odpadového materiálu.
Otvorte balenia s injekčnými striekačkami a snímte viečka z injekčných liekoviek


● Odhoďte obaly a viečka z injekčných liekoviek do odpadovej nádoby.
● Položte injekčné striekačky a injekčné liekovky na čisté miesto.
Dôkladne si umyte ruky● Po umytí rúk sa už nedotýkajte ničoho, okrem pomôcok potrebných na podanie injekcie a miesta podania injekcie.
Očistite zátku injekčnej liekovky● Pretrite zátku každej injekčnej liekovky čerstvým alkoholovým tampónom. Nechajte zátky vyschnúť na vzduchu.
Po očistení gumových zátok sa ich už nedotýkajte. Ak sa ich dotknete, je potrebné ich znovu očistiť.
MIEŠANIE FUZEONUNatiahnite vodu na injekciuZoberte
3 ml veľkú injekčnú striekačku. Ukazovákom potlačte na farebný ochranný kryt ihly smerom k injekčnej striekačke.
Uistite sa, že ihla je bezpečne nasadená, uchyťte priesvitný plastový kryt a jemne otočte ihlu v smere hodinových ručičiek. Nepoužívajte príliš veľkú silu, lebo sa môže ihla uvoľniť.
Priesvitný plastový kryt odstránite zatlačením smerom k injekčnej striekačke a potom kryt stiahnite.
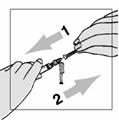
Natiahnite 1,1 ml vzduchu do striekačky-
Prepichnite ihlu injekčnej striekačky gumový kryt injekčnej liekovky s vodou na injekciu a stlačením piestu vstreknete vzduch.


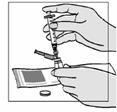
Otočte injekčnú liekovku hore dnom. Uistite sa, že koniec ihly je stále pod hladinou vody na injekciu.
Tým sa predíde vniknutiu vzduchových bublín do injekčnej striekačky.
Piest pomaly ťahajte späť dovtedy, kým voda nedosiahne označenie 1,1 ml.
Prosím uvedomte si, že injekčná liekovka obsahuje nadmerné množstvo vody na injekciu (2 ml); odoberte iba 1,1 ml na správnu prípravu vášho lieku.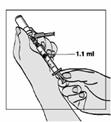
● Jemne poklepte na injekčnú striekačku, aby sa vzduchové bubliny dostali navrch.
Ak sa dostalo do striekačky väčšie množstvo vzduchu, jemne zatlačte na piest, aby sa všetok vzduch vytlačil naspäť do injekčnej liekovky a potom znova natiahnite vodu na injekciu. Ubezpečte sa, že je v injekčnej striekačke 1,1 ml vody na injekciu.
● Odstráňte ihlu z injekčnej liekovky,
pričom sa ihly nikdy nedotknite prstami alebo nejakým iným predmetom.● Odhoďte injekčnú liekovku do odpadkov. Injekčná liekovka, v ktorej je rozpúšťadlo je určená len na jednorazové použitie a zvyšná voda na injekciu v liekovke po odobratí potrebného objemu na rozpustenie sa má zlikvidovať.
Pridanie vody na injekciu do prášku Fuzeonu● Jemne potrepte na injekčnú liekovku s Fuzeonom, aby sa prášok uvoľnil.
● Držte vodou naplnenú injekčnú striekačku za telo a vpichnite ihlu cez gumovú zátku injekčnej liekovky v miernom uhle.
Pomaly stlačte piest striekačky. Voda by mala pomaly stekať do injekčnej liekovky.
Dávajte pozor, aby ste vodu nepridali k prášku rýchlo, keďže rýchle pridanie by mohlo spôsobiť spenenie. Ak dôjde k speneniu, môže trvať dlhší čas, kým sa prášok úplne rozpustí.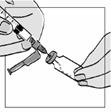
● Keď pridáte celé množstvo sterilnej vody na injekciu do injekčnej liekovky s Fuzeonom, odstráňte striekačku z injekčnej liekovky.


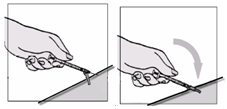
● Držte telo injekčnej striekačky jednou rukou a mierne tlačte farebný ochranný kryt ihly smerom na
rovnú podložku, pokiaľ sa nezakryje ihla. Budete počuť cvaknutie.
Nepoužívajte druhú ruku na zatlačenie krytu na ihlu.● Odhoďte injekčnú striekačku do odpadovej nádoby určenej pre takýto odpad.
Miešanie vody s práškom Fuzeonu● Jemne poklepkávajte na injekčnú liekovku končekom prsta dovtedy, kým sa prášok začne rozpúšťať.
Nikdy nepretrepávajte injekčnú liekovku, ani ju neprevracajte zhora nadol za účelom premiešania – spôsobilo by to nadmerné penenie. Keď sa začne prášok rozpúšťať, môžete odložiť injekčnú liekovku nabok a počkať, kým sa prášok úplne rozpustí. Rozpúšťanie môže trvať aj 45 minút. Injekčnú liekovku môžete tiež po pridaní vody na injekciu jemne otáčať medzi rukami, a to dovtedy, kým sa úplne prášok nerozpustí. Tým sa môže skrátiť čas potrebný na rozpustenie prášku.
● Ak ste sa náhodou dotkli gumovej zátky, určite ju znovu očistite novým alkoholovým tampónom.
● Nechajte prášok úplne rozpustiť a umožniť vytvoreným bublinám usadiť sa. Ak bubliny v roztoku pretrvávajú, jemne poklepte na stenu injekčnej liekovky, čím napomôžete ich usadeniu.
● Podobne ako u všetkých injekčne podávaných liekov, dôležité je skontrolovať, či sa v roztoku nenachádzajú nejaké častice. Ak si všimnete v roztoku nejaké častice, nepoužite ho. Injekčnú liekovku odhoďte do nádoby s vrchnákom, ktorá je určená na takýto odpad alebo ju vráťte do lekárne. Začnite s novou injekčnou liekovkou s práškom Fuzeonu.
● Hneď po tom, ako sa dávka zmieša s vodou na injekciu, musí sa ihneď použiť alebo odložiť do chladničky a použiť do 24 hodín. Pred použitím nechajte roztok ohriať na izbovú teplotu.
● Ak si pripravujete obidve denné dávky v tom istom čase, použite na prípravu každej dávky nové injekčné striekačky, vodu na injekciu a Fuzeon.
PRÍPRAVA INJEKCIEKde podať injekciu
Miesta, ktoré možno použiť na podanie injekcie, zahŕňajú brucho, hornú časť stehna a nadlaktie. Injekcia sa má podať na iné miesto než je miesto posledného podania injekcie. Nikdy nepodávajte injekciu na miesto, kde pretrváva reakcia z predtým podanej dávky. Liek nepodávajte do materských znamienok, jazvovitého tkaniva, podliatin alebo pupka.
Vyberte si iné miesto, než je miesto posledného podania injekcie. Potom si skontrolujte miesta, kde by
ste mohli mať reakciu (stlačte kožu, aby ste zistili, či sa tam nenachádza nejaká tvrdá hrčka). Je lepšie

sa takýmto miestam vyhnúť. Tiež sa vyhýbajte miestam, ktoré sú dráždené opaskom alebo pásom
Vášho oblečenia.
Očistenie miesta podaniaMiesto vybrané na podanie injekcie dôkladne očistite alkoholovým tampónom, a to krúživým pohybom smerom von. Počkajte, kým miesto úplne vyschne.
Natiahnutie Fuzeonu do 1 ml injekčnej striekačky● Pretrite znovu zátku injekčnej liekovky s Fuzeonom novým alkoholovým tampónom.
Zoberte si
1 ml malú injekčnú striekačku. Ukazovákom potlačte na farebný ochranný kryt smerom k striekačke.
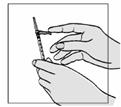
Priesvitný plastový kryt zatlačte smerom k injekčnej striekačke a potom kryt stiahnite.
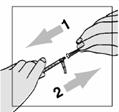
Natiahnite 1 ml vzduchu. Neťahajte piest príliš silno, aby ste neminuli označenie 1 ml a/alebo nevytiahli piest z tela injekčnej striekačky.
Prepichnite ihlou striekačky gumovú zátku injekčnej liekovky s Fuzeonom a zatlačením na piest podajte do injekčnej liekovky vzduch. Jemne otočte injekčnú liekovku hore dnom.
Dávajte pozor na to, aby bol koniec ihly stále pod hladinou roztoku, čo zabráni vniknutiu vzduchových bublín do injekčnej striekačky. Pomaly povyťahujte piest, kým roztok nedosiahne značku 1,0 ml. Neťahajte piest príliš rýchlo, aby ste neminuli označenie 1 ml a/alebo nevytiahli piest z tela injekčnej striekačky.
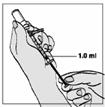
● Poklepte jemne na injekčnú striekačku, aby bubliny vystúpili navrch.
● Ak sa dostalo do injekčnej striekačky väčšie množstvo vzduchu, jemne stlačte piest, aby sa všetok vzduch dostal naspäť do injekčnej liekovky a potom znova natiahnite roztok tak, aby sa do striekačky dostalo 1,0 ml (alebo akýkoľvek iný objem, ktorý Vám určil lekár). Tento krok opakujte dovtedy, kým nebude v striekačke správne množstvo roztoku.



● Odstráňte injekčnú striekačku z injekčnej liekovky.
PODANIE INJEKCIE FUZEONURada: Zdravotnícky pracovník, Vám môže navrhnúť iné spôsoby podania injekcie.
Stlačte si kožnú riasu čo najviac, avšak tak, aby ste sa necítili nepríjemne.
● Prepichnite si kožu v 45-stupňovom uhle.
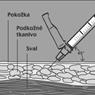
Keď je ihla vo vnútri, uvoľnite kožu a tou istou rukou si pridržte telo striekačky tak, aby ste zabezpečili jej stabilitu a predišli posunu.
● Pomocou palca stlačte piest, čím podáte liek. Keď podáte celú dávku, vytiahnite ihlu z kože.
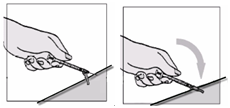
• Držte telo striekačky jednou rukou a mierne tlačte farebný kryt ihly smerom na
rovnú podložku, pokiaľ sa nezakryje ihla. Budete počuť cvaknutie.
Nepoužívajte druhú ruku na zatlačenie krytu na ihlu.● Odhoďte striekačku do odpadovej nádoby s vrchnákom určenej pre tento účel.
● Ak je prítomná krv v mieste podania, prekryte ho náplasťou.
LIKVIDÁCIA POUŽITÝCH POMÔCOKOdhoďte všetky použité injekčné striekačky priamo do odpadovej nádoby s vrchnákom, určenej pre
tento účel. Odpadová nádoba musí byť tesne prikrytá vrchnákom a musí sa uchovávať mimo dosahu detí. Spýtajte sa Vášho lekára alebo lekárnika, ako máte správne zlikvidovať odpadovú nádobu.
Okrem toho musíte bezpečne zlikvidovať všetky použité alkoholové tampóny a injekčné liekovky, a to aj v prípadoch, keď injekčné liekovky obsahujú nepoužité množstvá lieku alebo vody na injekciu. Injekčné liekovky s Fuzeonom a vodou na injekciu sú len na jednorazové použitie. Použité pomôcky okrem injekčných striekačiek (alkoholové tampóny a prázdne injekčné liekovky) sa môžu odhodiť do bežných odpadkov, ak na nich nie je viditeľná krv. Ak je na nich viditeľná krv, odhoďte materiál do odpadovej nádoby s vrchnákom určenej pre tento účel.

Ak máte nejaké otázky alebo obavy o bezpečnosti likvidácie týchto materiálov, zavolajte Vášmu lekárovi alebo lekárnikovi.
PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽOV Fuzeon 90 mg/ml prášok na injekčný roztok Enfuvirtid
Pozorne si prečítajte celú písomnú informáciu skôr, ako začnete používať Váš liek.
- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Ak máte ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
- Tento liek bol predpísaný Vám. Nedávajte ho nikomu inému. Môže mu uškodiť, dokonca aj vtedy ak má rovnaké príznaky ako Vy.
- Ak začnete pociťovať akýkoľvek vedľajší účinok ako závažný alebo ak spozorujete vedľajšie účinky, ktoré nie sú uvedené v tejto písomnej informácii pre používateľov, povedzte to, prosím, svojmu lekárovi alebo lekárnikovi.
V tejto písomnej informácii pre používateľov:
1. Čo je Fuzeon a na čo sa používa
2. Skôr ako použijete Fuzeon
3. Ako používať Fuzeon
4. Možné vedľajšie účinky
5. Ako uchovávať Fuzeon
6. Ďalšie informácie
1. ČO JE FUZEON A NA ČO SA POUŽÍVA
Čo je Fuzeon
Fuzeon potláča vstup ľudského vírusu imunitnej nedostatočnosti (HIV) do buniek, ktoré vírus HIV
napáda (nazývajú sa CD4 alebo T-bunky) v krvi. Zabraňuje tomu, aby sa HIV dostal do kontaktu s postihnutou membránou bunky. To znamená, že HIV nemôže vstúpiť do bunky, a množiť sa, pretože aby sa HIV mohol množiť potrebuje DNA hostiteľskej bunky.
Kedy sa má Fuzeon používať
Fuzeon sa používa v kombinácii s inými antiretrovírusovými liekmi v liečbe pacientov infikovaných
HIV, vírusom, ktorý spôsobuje AIDS. Váš lekár Vám predpísal Fuzeon preto, aby sa dala infekcia HIV lepšie zvládnuť. Liečba Fuzeonom neznamená vyliečenie HIV infekcie. Nikdy nepoužívajte znečistené ihly, a ani sa s nikým o ne nedeľte.
2. SKÔR AKO POUŽIJETE FUZEON Nepoužívajte Fuzeon
- keď ste alergický (precitlivený) na enfuvirtid alebo niektorú z ďalších zložiek Fuzeonu.
Buďte zvlášť opatrný pri používaní Fuzeonu
Informujte lekára
- keď trpíte nejakou inou chorobou
- keď ste v minulosti prekonali alebo v súčasnosti trpíte nejakým pľúcnym ochorením alebo si podávate intravenózne drogy alebo fajčíte
- keď ste mali v minulosti problémy s obličkami.
Fuzeon neznižuje riziko prenosu HIV na iných ľudí prostredníctvom sexuálneho kontaktu alebo kontaminácie krvi. Preto je potrebné naďalej dodržiavať primerané opatrenia, ktoré majú zabrániť prenosu HIV na iných. Liečba Fuzeonom neznamená vyliečenie HIV infekcie.
U niektorých pacientov s pokročilou HIV infekciou (AIDS) a oportúnnou infekciou v anamnéze sa po krátkom čase od začatia liečby HIV môžu vyskytnúť známky a príznaky zápalu z predošlých infekcií.
Predpokladá sa, že tieto príznaky sú dôsledkom zlepšenia imunitnej odpovede organizmu, ktorá mu umožňuje prekonávať infekcie, ktoré môžu byť prítomné bez akýchkoľvek zjavných príznakov. Ak spozorujete akékoľvek príznaky infekcie, prosím informujte o tom okamžite svojho lekára.
Problémy s kosťami
U niektorých pacientov, ktorí sú liečení kombinovanou protivírusovou liečbou, sa môže rozvinúť ochorenie kostí nazývané osteonekróza (odumretie kostného tkaniva spôsobené prerušením prísunu krvi do kosti). Niektoré z mnohých rizikových faktorov pre rozvoj tohto ochorenia môžu byť, okrem iného, dĺžka kombinovanej protivírusovej liečby, používanie kortikosteroidov, konzumácia alkoholu, závažné potlačenie imunitných reakcií, vyšší index telesnej hmotnosti. Prejavmi osteonekrózy sú stuhnutosť kĺbov, bolesť kĺbov (hlavne bedra, kolena a ramena) a ťažkosti pri pohybe. Ak spozorujete niektorý z týchto príznakov, informujte, prosím, svojho lekára.
Užívanie iných liekov
Ak užívate alebo ste v poslednom čase užívali ešte iné lieky, vrátane liekov, ktorých výdaj nie je viazaný na lekársky predpis, prosím oznámte to svojmu lekárovi alebo lekárnikovi. Fuzeon nemá interakcie s inými liekmi pôsobiacimi proti HIV, ani s rifampicínom (antibiotikum).
Používanie Fuzeonu s jedlom a nápojmi:
Fuzeon môžete používať spolu s jedlom, alebo bez jedla, ale mali by ste dodržiavať inštrukcie, ktoré sú uvedené v písomných informáciách pre používateľov ostatných liekov, ktoré užívate.
Tehotenstvo a dojčenie
Tehotné ženy a dojčiace matky nemajú užívať Fuzeon, pokiaľ im to osobitne neurčí ich lekár. Ak ste otehotneli, alebo by ste mohli byť tehotná alebo dojčíte dieťa, oznámte to okamžite Vášmu lekárovi.
Ženám infikovaným HIV sa neodporúča dojčiť, pretože materským mliekom sa môže vírus HIV
preniesť na dieťa. Skôr ako začnete užívať akýkoľvek liek poraďte sa s Vaším lekárom alebo lekárnikom.
Vedenie vozidla a obsluha strojov
Vplyv lieku Fuzeon na schopnosť viesť vozidlá a obsluhovať stroje nebol skúmaný. Avšak, ak pri užívaní Fuzeonu pociťujete závrat, radšej nejazdite.
3. AKO POUŽÍVAŤ FUZEON
Vždy používajte Fuzeon presne tak, ako Vám povedal Váš lekár. Ak si nie ste niečim istý, overte si to u svojho lekára alebo lekárnika.
Zvyčajná dávka je 90 mg dvakrát denne, podávaná v 1 ml roztoku podkožnou (tesne pod kožu)
injekciou.
Ďalšie pokyny pre používanie Fuzeonu sú uvedené na konci tejto písomnej informácie pre používateľov. Tam nájdete pokyny ako si pripravíte Fuzeon a ako si ho sám injekčne podáte.
Ak ste použili viac Fuzeonu ako by ste mali
Nie je žiadne špecifické antidotum pre predávkovanie Fuzeonom. Ak použijete viac Fuzeonu ako je odporúčaná dávka, prosím kontaktujte Vášho lekára.
Ak ste zabudli použiť Fuzeon
Podajte si dávku čo najskôr ako ste si na ňu spomenuli a ďalšiu dávku si podajte v pravidelnom čase. Dávku, na ktorú ste zabudli, si nedajte v prípade, že ďalšiu bežnú dávku máte použiť za menej než
6 hodín a nikdy nepoužívajte dvojitú dávku, aby ste nahradili vynechanú dávku.
4. MOŽNÉ VEDĽAJŠIE ÚČINKY
Tak ako všetky lieky, Fuzeon môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
V klinických štúdiách sa u pacientov liečených Fuzeonom pozoroval vyšší výskyt zápalu pľúc. Ak sa u Vás objaví kašeľ s vysokou teplotou, rýchle dýchanie a/alebo dušnosť, je dôležité o tom informovať lekára, pretože tieto príznaky môžu znamenať, že sa u Vás rozvíja zápal pľúc.
Najčastejší vedľajší účinok, ktorý sa vyskytuje pri používaní Fuzeonu, sú reakcie v mieste, do ktorého si podávate injekciu. Je pravdepodobné, že v mieste, do ktorého si podávate injekciu s liekom, sa vyskytne jedna alebo viac miernych až stredne závažných reakcií: svrbenie, opuch, začervenanie, bolesť alebo citlivosť, zhrubnutie kože alebo hrčky. Tieto reakcie sa môžu objaviť počas prvého týždňa liečby a obvykle sa v priebehu ďalšej liečby Fuzeonom nezhoršujú. Reakcie v jednotlivých miestach podania injekcie trvajú zvyčajne 7 dní alebo menej.
Reakcie v mieste podania sa môžu zhoršiť, ak sa injekcie podávajú na to isté miesto na tele alebo keď
sa injekcia podá hlbšie, ako by sa mala (napríklad do svalu).
Veľmi častými vedľajšími účinkami (u viac ako u jednej zo sto osôb, ale menej ako jednej osoby z desiatich) sú bolesť a znížená citlivosť rúk, chodidiel alebo nôh a strata hmotnosti.
Častými vedľajšími účinkami (u viac ako jednej osoby z desiatich)sú zápal dutín, lokálny opuch na koži, pneumónia “chrípka”, infekcia ucha, opuchnuté žľazy, znížená chuť do jedla, nechutenstvo, zvýšené hodnoty tuku v krvi, cukrovka, pocit úzkosti alebo podráždenosti, nočné mory, pocit závrate, strata koncentrácie, tremor (tras), zapálené očné viečka, upchanie nosa, zápal pankreasu, pálenie pri srdci, suchá koža, ekzém, začervenanie pokožky, akné, bolesť svalov, obličkové kamene, príznaky podobné “chrípke”, pocit slabosti a krv v moči.
Je potrebné si uvedomiť, že reakcie v mieste podania sú bežnými vedľajšími účinkami (u viac ako u jednej osoby zo sto, ale menej ako u jednej osoby z desiatich) užívania Fuzeonu. Ak sa u Vás objavia reakcie v mieste podania, je dôležité, aby ste neprestali užívať Fuzeon skôr než si Vaše problémy prediskutujete s lekárom.
Vo vzácnych prípadoch dôjde k infekcii v miestach podania injekcie. Aby sa znížilo riziko infekcie, dôležité je pridŕžať sa nižšie uvedených pokynov pre podávanie injekcie Fuzeonu.
Precitlivenosť (alergia) na Fuzeon je zriedkavá (u viac ako u jednej osoby z desaťtisíc, ale menej ako u jednej osoby z tisíc osôb). Ak sa však u Vás objavia príznaky, ktoré môžu znamenať, že ste alergický/á na tento liek, musíte ho okamžite prestať užívať a povedať o tom čo najskôr Vášmu lekárovi.
Príznaky, ktoré by ste si mali všímať sú vyrážka, vysoká teplota alebo zimnica, pocit nevoľnosti alebo choroby, potenie a triaška. Tieto príznaky neznamenajú jednoznačne, že ste alergický/á na tento liek, avšak musíte ich prediskutovať s lekárom.
Ak začnete pociťovať akýkoľvek vedľajší účinok ako závažný alebo ak spozorujete vedľajšie účinky, ktoré nie sú uvedené v tejto písomnej informácii pre používateľov, povedzte to, prosím, svojmu lekárovi alebo lekárnikovi.
5. AKO UCHOVÁVAŤ FUZEON
Uchovávajte mimo dosahu a dohľadu detí.
Nepoužívajte Fuzeon po dátume exspirácie, ktorý je uvedený na štítku injekčnej liekovky Fuzeonu po
EXP. Dátum exspirácie sa vzťahuje na posledný deň v mesiaci. Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
Keď sa už pripraví roztok na injekciu, má sa použiť okamžite. Ak sa nepoužije hneď, musí sa uchovávať v chladničke pri teplote (2°C - 8°C) a použiť do 24 hodín. Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Nepoužívajte Fuzeon, keď spozorujete nejaké čiastočky v prášku alebo roztoku po pridaní vody na injekciu.
6. ĎALŠIE INFORMÁCIEČo Fuzeon obsahuje- Liečivo je enfuvirtid. Po rozpustení s rozpúšťadlom vznikne 1 ml nariedeného roztoku, ktorý obsahuje 90 mg enfuvirtidu.
- Ďalšie zložky sú: Bezvodý uhličitan sodný Manitol
Hydroxid sodný
Kyselina chlorovodíková
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, to znamená, že je v podstate
„bez sodíka“.
Ako vyzerá Fuzeon a a obsah baleniaFuzeon prášok na injekčný roztok sa dodáva v baleniach, ktoré obsahujú 60 injekčných liekoviek s
Vaším liekom.
Držiteľ rozhodnutia o registráciiRoche Registration Limited
6 Falcon Way
Shire Park
Welwyn Garden City
AL7 1TW Veľká Británia
Výrobca zodpovedný za prepustenie šarže jeRoche Pharma AG Emil-Barell-Str. 1,
D-79639 Grenzach-Wyhlen
Nemecko
Ak potrebujete akúkoľvek informáciu o tomto lieku kontaktujte, prosím, miestneho zástupcu držiteľa rozhodnutia o registrácii:
België/Belgique/Belgien
N.V. Roche S.A.
Tél/Tel: +32 (0) 2 525 82 11
| Luxembourg/Luxemburg
(Voir/siehe Belgique/Belgien)
|
България
Рош България ЕООД Тел: +359 2 818 44 44
|
Magyarország
Roche (Magyarország) Kft. Tel: +36 - 23 446 800
|
Česká republika
Roche s. r. o.
Tel: +420 - 2 20382111
Malta
(See United Kingdom)
Danmark
Roche a/s
Tlf: +45 - 36 39 99 99
Nederland
Roche Nederland B.V. Tel: +31 (0) 348 438050
Deutschland
Roche Pharma AG Tel: +49 (0) 7624 140
Norge
Roche Norge AS
Tlf: +47 - 22 78 90 00
Eesti
Roche Eesti OÜ
Tel: + 372 - 6 112 401
Österreich
Roche Austria GmbH Tel: +43 (0) 1 27739
Ελλάδα
Roche (Hellas) A.E.
Τηλ: +30 210 61 66 100
Polska
Roche Polska Sp.z o.o. Tel: +48 - 22 345 18 88
España
Roche Farma S.A.
Tel: +34 - 91 324 81 00
Portugal
Roche Farmacêutica Química, Lda
Tel: +351 - 21 425 70 00
France
Roche
Tél: +33 (0) 1 46 40 50 00
România
Roche România S.R.L. Tel: +40 21 206 47 01
Ireland
Roche Products (Ireland) Ltd. Tel: +353 (0) 1 469 0700
Slovenija
Roche farmacevtska družba d.o.o. Tel: +386 - 1 360 26 00
Ísland
Roche a/s
c/o Icepharma hf
Sími: +354 540 8000
Slovenská republika
Roche Slovensko, s.r.o. Tel: +421 - 2 52638201
Italia
Roche S.p.A.
Tel: +39 - 039 2471
Suomi/Finland
Roche Oy
Puh/Tel: +358 (0) 9 525 331
Kύπρος
Γ.Α.Σταμάτης & Σια Λτδ.
Τηλ: +357 - 22 76 62 76
Sverige
Roche AB
Tel: +46 (0) 8 726 1200
Latvija
Roche Latvija SIA Tel: +371 - 7 039831
United Kingdom
Roche Products Ltd.
Tel: +44 (0) 1707 366000
Lietuva
UAB “Roche Lietuva” Tel: +370 5 2546799
Táto písomná informácia pre používateľov bola naposledy schválená v
Tomuto lieku bolo udelené „schválenie s podmienkou“.

To znamená, že sa očakávajú ďalšie doplňujúce informácie týkajúce sa tohto lieku.
Európska lieková agentúra (EMEA) bude každý rok posudzovať nové informácie o lieku, ktoré budú dostupné a podľa potreby aktualizovať túto písomnú informáciu.
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry (EMEA)
Error! Hyperlink reference not valid. tam aj odkazy na ďalšie internetové stránky o zriedkavých ochoreniach a ich liečbe.
AKO SA MÁ POUŽÍVAŤ FUZEONFuzeon vždy používajte presne podľa pokynov svojho lekára. Ak si nie ste niečim istý, overte si to u svojho lekára alebo lekárnika.
Zvyčajná dávka je 90 mg dvakrát denne, podávaná v 1 ml podkožne (tesne pod kožu) do ramena, prednej steny stehna alebo brucha. Každá injekcia sa má podať na iné miesto, než je miesto poslednej injekcie. Nikdy nepodávajte injekciu na miesto, kde je prítomná reakcia po predchádzajúcom vpichu. Nepodávajte Váš liek do materských znamienok, jazvovitého tkaniva, podliatin alebo pupka.
Kedy sa má Fuzeon používaťOptimálne je používať Fuzeon v tom istom čase dňa, ak je to možné. Skúste aký čas Vám bude vyhovovať, pričom si naplánujte dávky tak, že medzi nimi budú rovnaké intervaly. Prvá vec je dobré načasovanie rannej a večernej dávky.
Ďalej je potrebné postupovať krok za krokom podľa príručky pre použitie Vášho lieku. Prosím kontaktujte Vášho lekára alebo lekárnika, ak máte nejaké otázky ohľadne podávania Fuzeonu.
Ako dlho máte používať Fuzeon?Liek máte používať dovtedy, kým Vám lekár neoznámi, že jeho podávanie máte ukončiť. Ak skončíte alebo prerušíte liečbu Fuzeonom, môže sa stať HIV vo Vašej krvi skôr rezistentným než by k tomu došlo pri pravidelnom používaní a bez prerušovaní liečby. HIV vírus vo Vašej krvi sa nakoniec môže stať rezistentným na Fuzeon, čo spôsobí vzostup hladín vírusu v krvi. K tomu dôjde vtedy, keď sa lekár rozhodne ukončiť Vašu liečbu Fuzeonom. Lekár by to mal s Vami v tom čase prediskutovať.
Čo máte robiť, ak ste ľavákObrázky v tejto písomnej informácii ukazujú osoby, ktoré sú pravákmi. Ak ste ľavák/ľaváčka, robte to, čo sa Vám zdá prirodzené. Pravdepodobne sa Vám bude zdať najpohodlnejšie držať striekačku v ľavej ruke a injekčnú liekovku držať medzi palcom a ukazovákom pravej ruky.
Keď máte pri sebe osobu, ktorá Vám pomôžeNiektoré miesta pre podanie injekcie, napríklad nadlaktie, môže byť na začiatku zložité používať. Zabezpečte si, aby bol pri Vás partner, priateľ alebo člen rodiny, ak budete potrebovať pomoc. Aby sa znížilo riziko poranenia ihlou, je vhodné, aby osoba, ktorá Vám pomáha sa zúčastnila školení s Vaším poskytovateľom zdravotníckej starostlivosti.
Tipy pre bezpečnosť● Dôkladne si umyte ruky, aby ste znížili riziko bakteriálnych infekcií. Nedotýkajte sa ničoho
okrem lieku a pomôcok.
● Keď manipulujete so striekačkou, nedotýkajte sa ihly. Nedotýkajte sa vrchnej časti injekčnej liekovky potom, ako ste ju už očistili alkoholovým tampónom.
● Preverte si, či žiadna súčasť Vašej súpravy nebola otvorená. Nepoužívajte tie súčasti, ktoré boli otvorené.

● Nikdy nemiešajte Váš liek s vodou z vodovodu.
● Nikdy nepodávajte injekčne Váš liek spolu s inými liekmi určenými pre injekciu.
● Jediným odporúčaným spôsobom podania injekcie je subkutánne podanie (pod kožu). Fuzeon sa
nesmie podávať intravenózne (priamo do žily) alebo intramuskulárne (priamo do svalu).
● Odhoďte použité injekčné striekačky do určenej nádoby na odpadky, ktorá má vrchnák, aby sa tak zabezpečila bezpečná cesta likvidácie odpadového materiálu. Ak máte nejaké otázky týkajúce sa bezpečnej likvidácie týchto materiálov, kontaktujte Vášho lekára.

 AKO ZAČAŤ
Pripravte si pomôcky
AKO ZAČAŤ
Pripravte si pomôcky
Pripravte si všetky nasledujúce pomôcky, ktoré budete potrebovať na prípravu a podanie si injekcie. Spýtajte sa Vášho lekárnika alebo lekára, kde dostanete vodu na injekciu, 3 ml a 1 ml injekčné striekačky, alkoholové tampóny a nádobu s vrchnákom určenú na odpad:
● Jednu injekčnú liekovku s Fuzeonom
● Jednu injekčnú liekovku s vodou na injekciu
● Jednu 3 ml injekčnú striekačku (väčšia striekačka) s 25 mm ihlou
● Jednu 1 ml injekčnú striekačku (menšia striekačka) s 13 mm ihlou
● 3 alkoholové tampóny
● Nádobu na odpadky s vrchnákom , ktorá umožní bezpečný spôsob likvidácie odpadového materiálu.
Otvorte balenia so striekačkami a snímte viečka z injekčných liekoviek● Odhoďte obaly a viečka z injekčných liekoviek do odpadovej nádoby.
● Položte injekčné striekačky a injekčné liekovky na čisté miesto.
Dôkladne si umyte ruky● Po umytí rúk sa už nedotýkajte ničoho, okrem pomôcok potrebných pre podanie injekcie a miesta injekcie.
Očistite vrchnú časť injekčnej liekovky● Pretrite vrchnú časť každej injekčnej liekovky čerstvým alkoholovým tampónom. Potom nechajte tieto časti vyschnúť.
● Po očistení gumových zátok injekčných liekoviek sa ich už nedotýkajte. Ak sa ich dotknete, je potrebné ich znovu očistiť.
MIEŠANIE FUZEONUNatiahnite vodu na injekciuZoberte
3 ml veľkú striekačku.Odstráňte umelohmotné viečko z injekčnej liekovky a natiahnite 1,1 ml vzduchu.
Prepichnite ihlou striekačky gumový kryt injekčnej liekovky s vodou na injekciu a zatlačte na piest,
čím vpichnete vzduch.
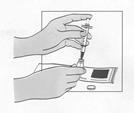


Pretočte injekčnú liekovku zhora nadol. Uistite sa, že koniec ihly je stále pod hladinou vody na injekciu. Tým sa predíde vstupu vzduchových bublín do striekačky.
Piest pomaly ťahajte dovtedy, kým voda na injekciu nedosiahne označenie 1,1 ml.
● Jemne poklepte po striekačke, aby sa vzduchové bubliny dostali navrch.
Ak sa dostalo do striekačky väčšie množstvo vzduchu, jemne zatlačte na piest, aby sa nejaký vzduch dostal naspäť do injekčnej liekovky a potom znova natiahnite vodu na injekciu. Je potrebné, aby bolo v striekačke 1,1 ml vody na injekciu.
● Odstráňte ihlu z injekčnej liekovky,
pričom sa ihly nikdy nedotknite prstami alebo nejakým iným predmetom.● Odhoďte injekčnú liekovku do odpadkov. Injekčná liekovka s vodou na injekciu, je určená len na jednorazové použitie.
Pridanie vody na injekciu k prášku FUZEONU● Jemne potrepte injekčnou liekovkou s Fuzeonom, aby sa prášok uvoľnil.
Držte vodou naplnenú striekačku za telo a zatláčajte ihlu cez gumový vrchnák injekčnej liekovky v miernom uhle.
Pomaly tlačte piest striekačky. Voda by mala pomaly stekať do injekčnej liekovky.
Dávajte si pozor, aby ste vodu nepridali k prášku rýchlo, lebo rýchle pridanie by mohlo spôsobiť spenenie. Ak dôjde k speneniu, môže trvať dlhší čas, kým sa prášok úplne rozpustí.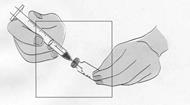
● Keď dodáte požadované množstvo vody na injekciu do injekčnej liekovky s Fuzeonom, odhoďte striekačku do odpadovej nádoby určenej pre takýto odpad.
Miešanie vody na injekciu s práškom Fuzeonu● Jemne poklepkávajte na injekčnú liekovku končekom prsta dovtedy, kým sa prášok začne rozpúšťať.
Nikdy nepretrepávajte injekčnú liekovku, ani ju neprevracajte zhora nadol za účelom premiešania – spôsobilo by to nadmerné penenie. Keď sa začne prášok rozpúšťať, môžete odložiť injekčnú liekovku nabok a počkať, kým sa prášok úplne rozpustí. Rozpúšťanie môže trvať aj 45 minút. Injekčnú liekovku môžete tiež po pridaní vody na injekciu jemne otáčať medzi rukami, a to dovtedy, kým sa úplne prášok nerozpustí. Tým sa môže skrátiť čas potrebný na rozpustenie prášku.
● Ak ste sa náhodou dotkli gumovej zátky, určite ju znovu očistite novým alkoholovým tampónom.


● Nechajte prášok úplne rozpustiť a umožniť vytvoreným bublinám usadiť sa. Ak bubliny v roztoku pretrvávajú, jemne poklepte na stenu injekčnej liekovky, čím napomôžete ich usadeniu.
● Podobne ako u všetkých injekčne podávaných liekov, dôležité je skontrolovať, či sa v roztoku nenachádzajú nejaké častice. Ak si všimnete v roztoku nejaké častice, nepoužite ho. Injekčnú liekovku odhoďte do nádoby s vrchnákom, ktorá je určená na takýto odpad alebo ju vráťte do lekárne. Začnite s novou injekčnou liekovkou s práškom Fuzeonu.
● Hneď po tom, ako sa dávka zmieša s vodou na injekciu, musí sa použiť alebo odložiť do chladničky a použiť do 24 hodín. Pred použitím nechajte roztok ohriať na izbovú teplotu.
● Ak si pripravujete obe denné dávky v tom istom čase, použite na prípravu každej dávky nové striekačky, vodu na injekciu a Fuzeon.
PRÍPRAVA INJEKCIEKde podať injekciu
Miesta, ktoré možno použiť na podanie injekcie, zahŕňajú brucho, hornú časť stehna, a nadlaktie. Injekciu je potrebné podať na iné miesto než je miesto posledného podania injekcie. Nikdy nepodávajte injekciu na miesto, kde pretrváva reakcia z predtým podanej dávky. Liek nepodávajte do materských znamienok, jazvovitého tkaniva, podliatin alebo pupka.
Vyberte si iné miesto, než je miesto posledného vpichu. Potom si skontrolujte miesta, kde by ste mohli
mať reakciu (stlačte kožu, aby ste zistili, či sa tam nenachádza nejaká tvrdá hrčka). Je lepšie sa takýmto miestam vyhnúť. Tiež sa vyhýbajte miestam, ktoré sú dráždené opaskom alebo pásom Vášho oblečenia.
Očistenie miesta podaniaMiesto vybrané pre podanie injekcie dôkladne očistite alkoholovým tampónom, a to krúživým pohybom smerom navonok. Počkajte, kým miesto úplne nevyschne.
Natiahnutie Fuzeonu do 1 ml striekačky● Pretrite znovu vrchnú časť injekčnej liekovky obsahujúcu Fuzeon novým alkoholovým tampónom.
Zoberte si
1 ml malú striekačku. Odstráňte umelohmotné viečko a natiahnite 1 ml vzduchu. Prepichnite ihlou striekačky gumovú zátku injekčnej liekovky s Fuzeonom a zatlačením na piest
podajte do injekčnej liekovky vzduch. Jemne otočte injekčnú liekovku hore dnom.
Dávajte pozor nato, aby bol koniec ihly stále pod hladinou roztoku, čo zabráni vstupu vzduchových bublín do striekačky. Pomaly povyťahujte piest, kým roztok nedosiahne značku 1,0 ml.
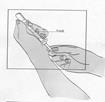



● Poklepte jemne po striekačke, aby bubliny vystúpili navrch.
● Ak sa dostalo do striekačky väčšie množstvo vzduchu, jemne zatlačte na piest, aby sa vzduch
dostal naspäť do injekčnej liekovky a potom znova natiahnite roztok tak, aby sa ho do striekačky dostalo 1,0 ml (alebo akýkoľvek iný objem, ktorý Vám určil lekár). Tento krok môžete opakovať dovtedy, kým nebude v striekačke správne množstvo roztoku.
● Odstráňte striekačku z injekčnej liekovky.
PODANIE INJEKCIE FUZEONUTip: Zdravotnícky pracovník, ktorý sa o Vás stará, Vám môže navrhnúť iné spôsoby podania,ktoré Vám môžu viac vyhovovať.Stlačte si kožnú riasu čo najviac, avšak tak, aby ste sa necítili nepríjemne.
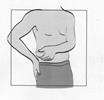
● Prepichnite si kožu v 45-stupňovom uhle.

Keď je ihla vo vnútri, uvoľnite kožu a tou istou rukou si pridržte telo striekačky tak, aby ste zabezpečili jej stabilitu a predišli posunu.
● Pomocou palca stlačte piest, čím podáte liek. Keď podáte celú dávku, vytiahnite ihlu z kože.
● Odhoďte striekačku do odpadovej nádoby s vrchnákom.
● Ak je prítomná krv v mieste podania, prekryte ho náplasťou.
LIKVIDÁCIA POUŽITÝCH POMÔCOKOdhoďte všetky použité injekčné striekačky priamo do odpadovej nádoby s vrchnákom, určenej pre
tento účel. Odpadová nádoba musí byť tesne prikrytá vrchnákom a musí byť uchovávaná mimo dosahu detí. Spýtajte sa Vášho lekára alebo lekárnika, ako máte správne zlikvidovať odpadovú nádobu.
Okrem toho musíte bezpečne zlikvidovať všetky použité alkoholové tampóny a injekčné liekovky, a to aj v prípadoch, keď injekčné liekovky obsahujú nepoužité množstvo lieku alebo vody na injekciu. Injekčné liekovky s Fuzeonom sú len na jednorazové použitie. Použité pomôcky okrem striekačiek (alkoholové tampóny a prázdne injekčné liekovky) sa môžu odhodiť do bežných odpadkov, ak na nich nie je viditeľná krv. Ak je na nich viditeľná krv, odhoďte materiál do odpadovej nádoby s vrchnákom určenej pre tento účel.
Ak máte nejaké otázky alebo obavy o bezpečnosti likvidácie týchto materiálov, láskavo zavolajte
Vášmu lekárovi alebo lekárnikovi.