
ali reprodukčnú toxicitu, vrátane zvýšeného výskytu abnormalít a úmrtí plodu (pozri časť 5.3). Ak pacientka počas užívania Fulvestrant Accord otehotnie, musí byť informovaná o potenciálnom riziku pre plod a potenciálnom riziku potratu.
DojčeniePočas liečby liekom Fulvestrant Accord sa musí dojčenie ukončiť. Fulvestrant Accord sa u dojčiacich samíc potkanov vylučuje do materského mlieka. Nie je známe, či sa fulvestrant vylučuje do ľudského mlieka. Vzhľadom na možnosť závažných nežiaducich reakcií fulvestrantu u dojčených detí je používanie počas dojčenia kontraindikované (pozri časť 4.3).
FertilitaÚčinky fulvestrantu na plodnosť ľudí sa neskúmali.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeFulvestrant nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá alebo obsluhovať stroje.
Vzhľadom na to, že sa počas užívania fulvestrantu veľmi často vyskytli prípady asténie, musí sa venovať zvýšená opatrnosť pacientkam, u ktorých sa vyskytla táto nežiaduca reakcia počas vedenia vozidiel alebo obsluhy strojov.
4.8 Nežiaduce účinkySúhrn bezpečnostného profiluMonoterapiaV tejto časti sa nachádzajú informácie, vychádzajúce zo všetkých nežiaducich reakcií z klinických štúdií, postmarketingových štúdií alebo zo spontánnych hlásení. V súhrnnom súbore údajov z monoterapie fulvestrantom boli najčastejšie hlásenými nežiaducimi reakciami boli reakcie v mieste podania injekcie, asténia, nauzea a zvýšenie hepatálnych enzýmov (ALT, AST, ALP).
V tabuľke 1 boli zistené nasledujúce kategórie frekvencie nežiaducich reakcií (adverse drug reactions, ADRs), ktoré sú založené na združených analýzach bezpečnosti v liečebnej skupine užívajúcej fulvestrant 500 mg v štúdiách porovnávajúcich fulvestrant 500 mg s fulvestrantom 250 mg [CONFIRM (Štúdia D6997C00002), FINDER 1 (Štúdia D6997C00004), FINDER 2 (Štúdia D6997C00006) a NEWEST (Štúdia D6997C00003)], alebo zo samotnej štúdie FALCON (Štúdia D699BC00001), ktorá porovnávala fulvestrant 500 mg s anastrozolom 1 mg. Pri rozdieloch vo frekvenciách pri združených analýzach bezpečnosti a štúdii FALCON sa uvádza najvyššia frekvencia. V tabuľke 1 sú frekvencie založené na všetkých hlásených nežiaducich reakciách bez ohľadu na hodnotenie kauzality skúšajúcim. Medián trvania liečby fulvestrantom 500 mg v združenom súbore údajov (vrátane štúdií uvedených vyššie plus FALCON) bol 6,5 mesiaca.
Tabuľkový zoznam nežiaducich reakciíNižšie uvedené nežiaduce reakcie sú klasifikované podľa frekvencie a triedy orgánových systémov (System Organ Class – SOC). Skupiny frekvencií sú definované nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100). V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
Tabuľka 1 Nežiaduce reakcie na liek hlásené pacientkami liečenými fulvestrantom v monoterapiiNežiaduce reakcie podľa tried orgánových systémov a frekvencie
|
Infekcie a nákazy
| Časté
| Infekcie močových ciest
|
Poruchy krvi a lymfatického systému
| Menej časté
| Znížený počet krvných doštičieke
|
Poruchy imunitného systému
| Veľmi časté
| Hypersenzitívne reakciee
|
Menej časté
| Anafylaktické reakcie
|
Poruchy metabolizmu a výživy
| Časté
| Anorexiaa
|
Poruchy nervového systému
| Časté
| Bolesť hlavy
|
Poruchy ciev
| Veľmi časté
| Návaly teplae
|
Časté
| Venózna tromboembóliaa
|
Poruchy gastrointestinálneho traktu
| Veľmi časté
| Nauzea
|
Časté
| Vracanie, hnačka
|
Poruchy pečene a žlčových ciest
| Veľmi časté
| Zvýšené pečeňové enzýmy (ALT, AST, ALP)a
|
Časté
| Zvýšený bilirubína
|
Menej časté
| Zlyhanie pečenec, f, hepatitídaf, zvýšené gama-GTf
|
Poruchy kože a podkožného tkaniva
| Veľmi časté
| Kožná vyrážkae
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
| Veľmi časté
| Bolesť kĺbov a muskuloskeletálna
bolesťd
|
Časté
| Bolesť chrbtaa
|
Poruchy reprodukčného systému a prsníkov
| Časté
| Vaginálne krvácaniee
|
Menej časté
| Vaginálna moniliázaf, leukoreaf
|
Celkové poruchy a reakcie v mieste podania
| Veľmi časté
| Asténiaa, reakcie v mieste podanie injekcieb
|
Časté
| Periférna neuropatiae, ischiase
|
Menej časté
| Krvácanie v mieste podania injekcief, hematóm v mieste podania injekcief, ischias, neuralgiac, f
|
a Vrátane nežiaducich reakcií, pre ktoré presný rozsah závažnosti užívania fulvestrantu nemôže byť stanovený vzhľadom na základné ochorenie.
b Termín reakcie v mieste podania injekcie nezahŕňa termíny krvácanie v mieste podania injekcie, hematóm v mieste podania injekcie, ischias, neuralgia a periférna neuropatial.
c Udalosť sa nepozorovala vo veľkých klinických štúdiách (CONFIRM, FINDER 1, FINDER 2. NEWEST).
Frekvencia sa vypočítala pomocou hornej hranice 95 % intervalu spoľahlivosti pre odhad bodu. Počíta sa ako 3/560 (kde 560 je počet pacientov vo veľkých klinických štúdiách), čo zodpovedá kategórii frekvencie „menej časté“.
d Zahŕňa: artralgiu a menej častú muskuloskeletálnu bolesť, myalgiu a bolesť v končatinách.
e Kategória frekvencie je rozdielna medzi údajmi zo združených analýz bezpečnosti a štúdiou FALCON.
f ADR sa v štúdii FALCON nepozorovala.
Popis vybraných nežiaducich reakciíPopis uvádzaný nižšie je založený na bezpečnostnej analýze súboru 228 pacientok, ktoré dostali aspoň
jednu (1) dávku fulvestrantu a 232 pacientok, ktoré dostali aspoň jednu (1) dávku anastrozolu vo fáze
3 štúdie FALCON.
Bolesť kĺbov a muskuloskeletálna bolesťV štúdii FALCON bol počet pacientok, ktoré hlásili nežiaducu reakciu bolesť kĺbov a muskuloskeletálnu bolesť, 65 (31,2 %) v skupine s fulvestrantom a 48 (24,1 %) v skupine s anastrozolom. Zo 65 pacientok v skupine s fulvestrantom 40 % (26/65) pacientok hlásilo bolesť kĺbov a muskuloskeletálnu bolesť počas prvého mesiaca liečby a 66,2 % (43/65) pacientok počas prvých 3 mesiacov liečby. Žiadna pacientka nehlásila udalosť stupňa ≥ 3 podľa CTCAE alebo udalosť vyžadujúcu zníženie dávky, prerušenie dávkovania alebo ukončenie liečby z dôvodu týchto nežiaducich reakcií.
Kombinovaná liečba s palbociklibomCelkový bezpečnostný profil fulvestrantu pri použití v kombinácii s palbociklibom je založený na
údajoch od 517 pacientok s HR-pozitívnym, HER2-negatívnym pokročilým alebo metastatickým
karcinómom prsníka v randomizovanej štúdii PALOMA3 (pozri časť 5.1). Najčastejšími (≥ 20 %)
nežiaducimi reakciami akéhokoľvek stupňa, hlásenými u pacientok dostávajúcich fulvestrant
v kombinácii s palbociklibom, boli neutropénia, leukopénia, infekcie, únava, nauzea, anémia,
stomatitída, hnačka a trombocytopénia. Najčastejšími (≥ 2 %) nežiaducimi reakciami stupňa ≥ 3 boli
neutropénia, leukopénia, anémia, infekcie, zvýšená hladina AST, trombocytopénia a únava.
V tabuľke 2 sú uvedené nežiaduce reakcie zo štúdie PALOMA3.
Medián trvania expozície fulvestrantu bol v skupine s fulvestrantom + palbociklibom 11,2 mesiaca
a 4,9 mesiaca v skupine s fulvestrantom + placebo. Medián trvania expozície palbociklibu v skupine
s fulvestrantom + palbociklib bol 10,8 mesiaca.
Tabuľka 2 Nežiaduce reakcie zo štúdie PALOMA3 (N = 517)
Trieda orgánových systémov
Frekvencia
Preferovaný termína
| Fulvestrant + palbociklib (N = 345)
| Fulvestrant +placebo
(N = 172)
|
Všetky stupne n (%)
| Stupeň ≥ 3 n (%)
| Všetky stupne n (%)
| Stupeň ≥ 3 n (%)
|
Infekcie a nákazy
|
Veľmi časté
|
|
|
|
|
Infekcieb
| 163 (47,2)
| 11 (3,2)
| 54 (31,4)
| 5 (2,9)
|
Poruchy krvi a lymfatického systému
|
Veľmi časté
|
|
|
|
|
Neutropéniac
| 287 (83,2)
| 228 (66,1)
| 7 (4,1)
| 1 (0,6)
|
Leukopéniad
| 183 (53,0)
| 105 (30,4)
| 9 (5,2)
| 2 (1,2)
|
Anémiae
|
102 (29,6)
|
12 (3,5)
|
22 (12,8)
|
3 (1,7)
|
Trombocytopéniaf
|
78 (22,6)
|
8 (2,3)
|
0 (0,0)
|
0
|
Menej časté
|
|
|
|
|
Febrilná neutropénia
|
3 (0,9)
|
3 (0,9)
|
1 (0,6)
|
1 (0,6)
|
Poruchy metabolizmu a výživy
|
Veľmi časté
|
|
|
|
|
Znížená chuť do jedla
|
55 (15,9)
|
3 (0,9)
|
14 (8,1)
|
1 (0,6)
|
Poruchy nervového systému
|
Časté
|
|
|
|
|
Dysgeúzia
|
23 (6,7)
|
0
|
5 (2,9)
|
0
|
Poruchy oka
|
Časté
|
|
|
|
|
Zvýšené slzenie
|
22 (6,4)
|
0
|
2 (1,2)
|
0
|
Rozmazané videnie
|
20 (5,8)
|
0
|
3 (1,7)
|
0
|
Suché oko
|
13 (3,8)
|
0
|
3 (1,7)
|
0
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Časté
|
|
|
|
|
Epistaxa
|
23 (6,7)
|
0
|
3 (1,7)
|
0
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté
|
|
|
|
|
Nauzea
|
117 (33,9)
|
0
|
48 (27,9)
|
1 (0,6)
|
Stomatitídag
|
97 (28,1)
|
2 (0,6)
|
22 (12,8)
|
0
|
Hnačka
|
81 (23,5)
|
0
|
33 (19,2)
|
2 (1,2)
|
Vracanie
|
65 (18,8)
|
2 (0,6)
|
26 (15,1)
|
1 (0,6)
|
Poruchy kože a podkožného tkaniva
|
Veľmi časté
|
|
|
|
|
Alopécia
|
62 (18,0)
|
0
|
11 (6,4)
|
0
|
Vyrážkah
|
58 (16,8)
|
2 (0,6)
|
11 (6,4)
|
0
|
Časté
|
|
|
|
|
Suchá koža
|
21 (6,1)
|
0
|
2 (1,2)
|
0
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté
|
|
|
|
|
Únava
|
142 (41,2)
|
8 (2,3)
|
50 (29,1)
|
2 (1,2)
|
Pyrexia
|
44 (12,8)
|
1 (0,3)
|
9 (5,2)
|
0
|
Časté
|
|
|
|
|
Asténia
|
26 (7,5)
|
0
|
9 (5,2)
|
1 (0,6)
|
Laboratórne vyšetrenia
|
Časté
|
|
|
|
|
Zvýšená hladina AST
|
26 (7,5)
|
10 (2,9)
|
9 (5,2)
|
3 (1,7)
|
Zvýšená hladina ALT
|
20 (5,8)
|
6 (1,7)
|
6 (3,5)
|
0
|
ALT = alanínaminotransferáza; AST = aspartátaminotransferáza; N/n = počet pacientov
a Preferované termíny (Preferred Terms, PT) sú uvedené podľa MedDRA 17.1.
b Infekcie zahŕňajú všetky PT, ktoré sú súčasťou triedy orgánových systémov „Infekcie a nákazy”.
c Neutropénia zahŕňa nasledujúce PT: neutropénia, znížený počet neutrofilov.
d Leukopénia zahŕňa nasledujúce PT: leukopénia, znížený počet bielych krviniek.
e Anémia zahŕňa nasledujúce PT: anémia, znížený hemoglobín, znížený hematokrit.
f Trombocytopénia zahŕňa nasledujúce PT: trombocytopénia, znížený počet krvných doštičiek.
g Stomatitída zahŕňa nasledujúce PT: aftózna stomatitída, cheilitída, glositída, glosodýnia, ulcerácia v ústach, zápal sliznice, bolesť v ústach, orofaryngeálny diskomfort, orofaryngeálna bolesť, stomatitída.
h Vyrážka zahŕňa nasledujúce PT: vyrážka, makulopapulárna vyrážka, svrbiaca vyrážka, erytematózna vyrážka, papulárna vyrážka, dermatitída, akneiformná dermatitída, toxická kožná erupcia.
Popis vybraných nežiaducich reakciíNeutropéniaU pacientok, ktoré v štúdii PALOMA3 dostávali fulvestrant v kombinácii s palbociklibom, sa neutropénia akéhokoľvek stupňa hlásila u 287 (83,2 %) pacientok, neutropénia stupňa 3 sa hlásila u 191 (55,4 %) pacientok a neutropénia stupňa 4 sa hlásila u 37 (10,7 %) pacientok. V skupine s fulvestrantom + placebo (n = 172) sa neutropénia akéhokoľvek stupňa hlásila u 7 (4,1 %) pacientok, neutropénia stupňa 3 u 1 (0,6 %) pacientky. V skupine s fulvestrantom + placebo sa nehlásila žiadna neutropénia stupňa 4.
U pacientok dostávajúcich fulvestrant v kombinácii s palbociklibom bol medián času do prvej epizódy neutropénie akéhokoľvek stupňa 15 dní (rozsah: 13–317) a medián trvania neutropénie stupňa ≥ 3 bol 7 dní. Febrilná neutropénia sa hlásila u 0,9% pacientok dostávajúcich fulvestrant v kombinácii s palbociklibom.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 PredávkovanieSú známe ojedinelé hlásenia predávkovania Fulvestrantom Accord. V prípade predávkovania sa odporúča symptomatická podporná liečba. Štúdie na zvieratách udávajú, že okrem účinkov priamo alebo nepriamo spojených s antiestrogénnou aktivitou, sa pri vyšších dávkach fulvestrantu nepreukázali žiadne iné účinky (pozri časť 5.3).
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Endokrinná liečba, Antiestrogény, ATC kód: L02BA03
Mechanizmus účinku a farmakodynamické účinkyFulvestrant je kompetitívny antagonista estrogénového receptora (ER) s afinitou porovnateľnou s estradiolom. Fulvestrant blokuje trofický účinok estrogénov bez akejkoľvek čiastočnej agonistickej (estrogénu podobnej) aktivity. Mechanizmus účinku je spojený s potlačením hladín proteínu estrogénového receptora. Klinické štúdie u postmenopauzálnych žien s primárnou rakovinou prsníka preukázali, že fulvestrant významne znižuje ER proteín v ER pozitívnych nádoroch v porovnaní s placebom. Taktiež sa pozorovalo významné zníženie expresie progesterónového receptora bez agonistického účinku na vnútorný estrogén. Tiež sa preukázalo, že fulvestrant 500 mg znižuje ER a proliferáciu markeru Ki67, vo väčšej miere ako fulvestrant 250 mg v nádoroch prsníka v postmenopauzálnej neoadjuvantnej liečbe.
Klinická účinnosť a bezpečnosť pri pokročilom karcinóme prsníkaMonoterapiaKlinickú štúdiu fázy 3 ukončilo 736 postmenopauzálnych žien s pokročilým karcinómom prsníka, ktoré mali rekurenciu ochorenia počas alebo po adjuvantnej endokrinnej liečbe alebo progresii následnej endokrinnej liečby pokročilého ochorenia. Štúdia zahŕňala 423 pacientok, ktoré recidivovali alebo mali progresiu počas antiestrogénnej liečby (AE podskupina) a 313 pacientok, ktoré recidivovali alebo mali progresiu počas liečby inhibítorom aromatázy (AI podskupina). Táto štúdia porovnávala účinnosť a bezpečnosť fulvestrantu 500 mg (n=362) s fulvestrantom 250 mg (n=374). Prežívanie bez progresie (progression-free survival, PFS) bolo primárnym cieľom, kľúčové sekundárne ciele účinnosti zahŕňali objektívnu mieru odpovede (objective response rate, ORR), mieru klinického prínosu (clinical benefit rate, CBR) a celkové prežívanie (overall survival, OS). Výsledky účinnosti pre CONFIRM štúdiu sú zhrnuté v tabuľke 3.
Tabuľka 3 Prehľad výsledkov primárneho cieľa účinnosti (PFS) a kľúčových sekundárnych cieľov účinnosti v štúdii CONFIRMPremenná
| Typ odhadu;
porovnanie liečby
| Fulvestrant
500 mg
(N = 362)
| Fulvestrant
250 mg
(N = 374)
| Porovnanie medzi skupinami
(fulvestrant 500 mg / fulvestrant 250 mg)
|
Pomer rizika
| 95 % CI
| p-hodnota
|
PFS
| K-M medián
v mesiacoch;
pomer rizika
|
|
|
|
|
|
Všetky pacientky
|
| 6.5
| 5.5
| 0.80
| 0.68, 0.94
| 0.006
|
-AE podskupina (n=423)
| 8.6
| 5.8
| 0.76
| 0.62, 0.94
| 0.013
|
-AI podskupina (n=313)a
| 5.4
| 4.1
| 0.85
| 0.67, 1.08
| 0.195
|
OSb
| K-M medián
v mesiacoch;
pomer rizika
|
|
|
|
|
|
Všetky pacientky
|
| 26.4
| 22.3
| 0.81
| 0.69, 0.96
| 0,016c
|
-AE podskupina (n=423)
| 30.6
| 23.9
| 0.79
| 0.63, 0.99
| 0,038c
|
-AI podskupina (n=313)a
| 24.1
| 20.8
| 0.86
| 0.67, 1.11
| 0,241c
|
Premenná
| Typ
odhadu;
porovnanie
liečby
| Fulvestrant
500 mg
(N = 362)
| Fulvestrant
250 mg
(N = 374)
| Porovnanie medzi skupinami
(fulvestrant 500 mg/fulvestrant 250 mg)
|
Absolútny rozdiel v %
| 95 % CI
|
|
ORRd
| % pacientok
s OR;
absolútny
rozdiel v %
|
|
|
|
|
|
Všetky pacientky
|
| 13.8
| 14.6
| -0.8
| -5.8, 6.3
|
|
-AE podskupina (n=296)
| 18.1
| 19.1
| -1.0
| -8.2, 9.3
|
|
-AI podskupina (n=205)a
| 7.3
| 8.3
| -1.0
| -5.5, 9.8
|
|
CBRe
| % pacientok
s CB;
absolútny
rozdiel v %
|
|
|
|
|
|
Všetky pacientky
|
| 45.6
| 39.6
| 6.0
| -1.1, 13.3
|
|
-AE podskupina (n=423)
| 52.4
| 45.1
| 7.3
| -2.2, 16.6
|
|
-AI podskupina (n=313)a
| 36.2
| 32.3
| 3.9
| -6.1, 15.2
|
|
a Fulvestrant je indikovaný u pacientok, ktoré recidivovali alebo mali progresiu počas antiestrogénnej liečby.
Výsledky v AI podskupine sú nepresvedčivé.
b OS je uvádzané pre finálnu analýzu celkového prežitia pri 75% úplnosti dát.
c Nominálna hodnota p bez úpravy na opakované hodnoty medzi pôvodnou analýzou celkového prežitia pri 50% úplnosti dát a aktualizovanou analýzou celkového prežitia pri 75% úplnosti dát.
d ORR bola stanovená u pacientok, u ktorých bola dostupná základná odpoveď (t.j., u ktorých bolo merateľné základné ochorenie: skupina 240 pacientok na fulvestrante 500 mg a skupina 261 pacientok na fulvestrante 250 mg).
e Pacientky s najlepšou objektívnou odpoveďou kompletnej odpovede, čiastočnou odpoveďou alebo stabilizovaným ochorením ≥ 24 týždňov.
PFS: Prežívanie bez progresie; ORR: Objektívna miera odpovede; OR: Objektívna odpoveď; CBR: Miera klinického prínosu; CB: Klinický prínos; OS: Celkové prežívanie; K-M: Kaplan-Meier; CI: Interval spoľahlivosti; AI: Inhibítor aromatázy; AE: Antiestrogén.
U postmenopauzálnych žien s lokálne pokročilým alebo metastatickým karcinómom prsníka s pozitivitou estrogénových a/alebo progesterónových receptorov, ktoré neboli v minulosti liečené žiadnou hormonálnou liečbou, sa uskutočnila randomizovaná, dvojito zaslepená, „double-dummy“ multicentrická štúdia fázy 3 skúmajúca fulvestrant 500 mg oproti anastrozolu 1 mg. Celkovo bolo postupne randomizovaných 462 pacientok v pomere 1:1 na podávanie fulvestrantu 500 mg alebo na užívanie anastrozolu 1 mg.
Randomizácia bola stratifikovaná podľa typu ochorenia (lokálne pokročilé alebo metastatické), predchádzajúcej chemoterapie pokročilého ochorenia a merateľného ochorenia.
Primárnym cieľom účinnosti v štúdii bolo prežívanie bez progresie (progression-free survival, PFS) hodnotené skúšajúcim pomocou kritérií na hodnotenie odpovede pri solídnych nádoroch (Response Evaluation Criteria in Solid Tumours, RECIST verzia 1.1). Kľúčové sekundárne ciele účinnosti zahŕňali celkové prežívanie (OS) a objektívnu mieru odpovede (ORR).
Medián veku pacientok zaradených do tejto štúdie bol 63 rokov (rozsah 36–90). Väčšina z týchto pacientok (87,0 %) mala metastatické ochorenie na začiatku. Päťdesiatpäť percent (55,0 %) pacientok malo viscerálne metastázy na začiatku. Celkovo dostalo predchádzajúci režim chemoterapie na liečbu pokročilého ochorenia 17,1 % z pacientok; 84,2 % z pacientok malo merateľné ochorenie.
Konzistentné výsledky sa pozorovali naprieč väčšiny vopred špecifikovaných podskupín pacientok. V podskupine pacientok s len neviscerálnymi metastázami (n = 208) bol HR 0,592 (95 % CI: 0,419; 0,837) v skupine s fulvestrantom oproti skupine s anastrozolom. V podskupine pacientok s viscerálnymi metastázami (n = 254) bol HR 0,993 (95 % CI: 0,740; 1,331) v skupine s fulvestrantom oproti skupine s anastrozolom. Výsledky účinnosti zo štúdie FALCON sú uvedené v tabuľke 4 a na obrázku 1.
Tabuľka 4 Súhrn výsledkov primárneho cieľa účinnosti (PFS) a kľúčových sekundárnych cieľov účinnosti (hodnotené skúšajúcim v populácii podľa liečebného zámeru) ─ štúdia FALCON
| Fulvestrant 500 mg
(N = 230)
| Anastrozol 1 mg
(N = 232)
|
Prežívanie bez progresie
|
Počet PFS udalostí (%)
| 143 (62,2 %)
| 166 (71,6 %)
|
PFS pomer rizika (95 % CI)
| HR 0,797 (0,637–0,999)
|
a hodnota p
| p = 0,0486
|
Medián PFS [mesiace (95 % CI)]
| 16,6 (13,8; 21,0)
| 13,8 (12,0; 16,6)
|
Počet OS udalostí*
| 67 (29,1%)
| 75 (32,3%)
|
OS pomer rizika (95 % CI)
| HR 0,875 (0,629–1,217)
|
a hodnota p
| p = 0,4277
|
ORR**
| 89 (46,1 %)
| 88 (44,9 %)
|
ORR Odds Ratio (95 % CI)
| OR 1,074 (0,716–1,614)
|
a hodnota p
| p = 0,7290
|
Medián DoR (mesiace)
| 20,0
| 13,2
|
CBR
| 180 (78,3 %)
| 172 (74,1 %)
|
CBR Odds Ratio (95 % CI)
| OR 1,253 (0,815–1,932)
|
a hodnota p
| p = 0,3045
|
*(31 % úplnosť dát) – nie konečná analýza OS**u pacientok s merateľným ochorením Obrázok 1 Kaplanova-Meierova krivka prežívania bez progresie (hodnotené skúšajúcim v populácii podľa liečebného zámeru) ─ štúdia FALCON
Čas od randomizácie (mesiace)
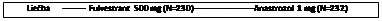
Počet pacientok s rizikom
FUL500
| 230
| 187
| 171
| 150
| 124
| 110
| 96
| 81
| 63
| 44
| 24
| 11
| 2
| 0
|
ANAS1
| 232
| 194
| 162
| 139
| 120
| 102
| 84
| 60
| 45
| 31
| 22
| 10
| 0
| 0
|
Vykonali sa dve klinické štúdie fázy 3 u celkovo 851 postmenopauzálnych žien s pokročilým karcinómom prsníka, u ktorých došlo k návratu ochorenia počas alebo po adjuvantnej endokrinnej liečbe, alebo k progresii ochorenia po endokrinnej liečbe pokročilého ochorenia. Sedemdesiatsedem percent (77%) populácie v štúdii malo karcinóm prsníka s pozitivitou estrogénových receptorov. V týchto štúdiách sa porovnávala bezpečnosť a účinnosť podávania fulvestrantu 250 mg raz do mesiaca s každodenným podávaním 1 mg anastrozolu (inhibítora aromatázy). Celkovo bol fulvestrant v mesačnej dávke 250 mg minimálne rovnako účinný ako anastrozol z hľadiska prežívania bez progresie, objektívnej reakcie a doby do úmrtia. Medzi oboma liečebnými skupinami neboli v konečných ukazovateľoch zaznamenané žiadne štatisticky významné rozdiely. Primárnym cieľom štúdie bolo prežívanie bez progresie. Kombinovaná analýza oboch štúdií preukázala, že k progresii došlo u 83 % pacientok, ktorým sa podával fulvestrant, oproti 85 % pacientok, ktoré užívali anastrozol. Kombinovaná analýza oboch štúdií poukázala na to, že pomer rizika fulvestrantu 250 mg a anastrozolu z hľadiska prežívania bez progresie predstavoval 0,95 (95% CI 0,82 až 1,10). Objektívna miera odpovede bola pre fulvestrant 250 mg 19,2% v porovnaní so 16,5% pre anastrozol. Medián času do úmrtia bol 27,4 mesiacov u pacientok liečených fulvestrantom a 27,6 mesiacov u pacientok liečených anastrozolom. Pomer rizika pre fulvestrant 250 mg k anastrozolu v čase do úmrtia bol 1,01 (95% CI 0,86 až 1,19).
Kombinovaná liečba s palbociklibomU žien s HR-pozitívnym, HER2-negatívnym lokálne pokročilým karcinómom
prsníka nevhodným na resekciu alebo rádioterapiu s kuratívnym zámerom alebo s metastatickým
karcinómom prsníka, nezávisle od ich menopauzálneho stavu, s progresiou ochorenia po
predchádzajúcej endokrinnej liečbe v (neo)adjuvantnom použití alebo použití pri metastatickom
ochorení, sa vykonala medzinárodná, randomizovaná, dvojito zaslepená, multicentrická štúdia fázy 3 s paralelnými skupinami porovnávajúca fulvestrant 500 mg plus palbociklib 125 mg oproti fulvestrantu 500 mg plus placebo.
Celkovo bolo randomizovaných 521 pre/peri- a postmenopauzálnych žien, ktorých ochorenie progredovalo v priebehu 12 mesiacov od ukončenia adjuvantnej endokrinnej liečby alebo počas nej, či v rámci 1 mesiaca po endokrinnej liečbe pokročilého ochorenia, alebo počas nej, v pomere 2:1 do skupín fulvestrant plus palbociklib alebo fulvestrant plus placebo a stratifikovaných podľa zdokumentovanej
citlivosti na predchádzajúcu hormonálnu liečbu, menopauzálneho stavu pri vstupe do štúdie (pre-/perimenopauzálne oproti postmenopauzálnym) a prítomnosti viscerálnych metastáz.
Pre-/perimenopauzálne ženy dostali agonistu LHRH, goserelín. Pacientky s pokročilým/metastatickým,
symptomatickým, viscerálnym rozsevom metastáz, ktoré mali riziko život ohrozujúcich komplikácií
v krátkej dobe (vrátane pacientok s masívnymi nekontrolovanými výpotkami [pleurálny,
perikardiálny, peritoneálny], pľúcnou lymfangitídou a viac ako 50 % postihnutím pečene), neboli
vhodné pre zaradenie do štúdie.
Pacientky pokračovali v užívaní priradenej liečby, kým nedošlo k objektívnej progresii ochorenia,
symptomatickému zhoršeniu, neprijateľnej toxicite, úmrtiu alebo zrušeniu súhlasu, podľa toho, čo sa
vyskytlo ako prvé. Prestup z jednej liečebnej skupiny do druhej nebol povolený.
Rozdelenie pacientok podľa vstupných demografických a prognostických charakteristík do skupiny
fulvestrant plus palbociklib a skupiny fulvestrant plus placebo bolo vyvážené. Medián veku pacientok
zaradených do tejto štúdie bol 57 rokov (rozsah 29 až 88). V každej liečebnej skupine bola väčšina
pacientok bielej rasy s dokumentovanou citlivosťou na predchádzajúcu hormonálnu liečbu a po
menopauze. Približne 20 % pacientok bolo pre-/perimenopauzálnych. Všetky pacientky dostali
predchádzajúcu systémovú liečbu a väčšina pacientok v každej z liečebných skupín dostala
predchádzajúcu chemoterapiu kvôli primárnej diagnóze. Viac ako polovica (62 %) pacientok mala ECOG skóre PS = 0; 60 % malo viscerálne metastázy a 60 % dostalo viac ako 1 predchádzajúcu hormonálnu liečbu kvôli ich primárnej diagnóze.
Primárnym cieľom štúdie bolo skúšajúcim lekárom hodnotené PFS podľa kritérií RECIST 1.1.
Podporné PFS analýzy boli založené na nezávislej centrálnej rádiologickej kontrole. Sekundárne ciele
zahŕňali OR, CBR, OS, bezpečnosť a čas do zhoršenia bolesti (time-to-deterioration, TTD).
Štúdia splnila svoj primárny cieľ predĺženie PFS hodnotené skúšajúcim lekárom pri predbežnej'
analýze vykonanej pri 82 % plánovaných PFS udalostí; výsledky prekročili vopred špecifikovanú
Haybittleovu-Petovu hranicu účinnosti (α = 0,00135), dokazujúc tak štatisticky významné predĺženie PFS
a klinicky významný účinok liečby. Novšia aktualizácia údajov o účinnosti je uvedená v tabuľke 5.
Tabuľka 5 Výsledky účinnosti – štúdia PALOMA3 (hodnotené skúšajúcim v populácii podľa liečebného zámeru)
| Aktualizovaná analýza (ukončenie zberu údajov 23. októbra 2015)
|
Fulvestrant plus palbociklib
(N = 347)
| Fulvestrasnt plus placebo
(N = 174)
|
Prežívanie bez progresie
|
|
Medián [mesiace (95 % CI)]
| 11,2 (9,5; 12,9)
| 4,6 (3,5; 5,6)
|
Pomer rizika (95 % CI) a hodnota p
| 0,497 (0,398; 0,620), p < 0,000001
|
Sekundárne ciele*
|
OR [% (95 % CI)]
| 26,2 (21,7; 31,2)
| 13,8 (9,0; 19,8)
|
OR (merateľné ochorenie) [% (95 % CI)]
| 33,7 (28,1; 39,7)
| 17,4 (11,5; 24,8)
|
DOR (merateľné ochorenie)
[mesiace (95 % CI)]
| 9,2 (7,2; 10,4)
| 7,4 (3,9; NE)
|
CBR [% (95% CI)]
| 68,0 (62,8; 72,9)
| 39,7 (32,3; 47,3)
|
*Výsledky odpovedí založené na potvrdených a nepotvrdených odpovediach.
N = počet pacientok; CI = interval spoľahlivosti; NE = neodhadnuteľné; OR = objektívna odpoveď; CBR = miera klinického prínosu; DOR = doba trvania odpovedi
Obrázok 2. Kaplanova-Meierova krivka prežívania bez progresie ochorenia (hodnotenie skúšajúcim lekárom v populácii podľa liečebného zámeru) – štúdia PALOMA3
PAL+FUL 347
|
276
|
245
|
215
|
189
|
168
|
137
|
69
|
38
|
12
|
2
|
1
|
PCB+FUL 174
|
112
|
83
|
62
|
51
|
43
|
29
|
15
|
11
|
4
|
1
|
|
FUL = fulvestrant; PAL = palbociclib; PCB = placebo.
V skupine fulvestrant plus palbociklib sa vo všetkých podskupinách pacientok definovaných stratifikačnými faktormi a vstupnými charakteristikami pozorovalo zníženie rizika progresie ochorenia alebo úmrtia. Bolo to evidentné u pre/perimenopauzálnych žien (HR 0,46 [95 % CI: 0,28; 0,75])
a postmenopauzálnych žien (HR 0,52 [95 % CI: 0,40; 0,66]) a pacientok s viscerálnymi metastatickými ložiskami (HR 0,50 [95 % CI: 0,38; 0,65]) a pacientok s neviscerálnymi metastatickými ložiskami (HR 0,48 [95 % CI: 0,33; 0,71]). Prínos bol tiež pozorovaný nezávisle od počtu línií predchádzajúcej liečby pre metastatické ochorenie, či bol počet 0 (HR 0,59 [95 % CI: 0,37; 0,93]), 1 (HR 0,46 [95 % CI: 0,32;
0,64]), 2 (HR 0,48 [95 % CI: 0,30; 0,76]) alebo ≥ 3 línie (HR 0,59 [95 % CI: 0,28; 1,22]). Ďalšie
ukazovatele účinnosti (OR a TTR) hodnotené v podskupinách pacientok s viscerálnym ochorením alebo bez neho sú zobrazené v tabuľke 6.
Tabuľka 6 Výsledky účinnosti na viscerálne a neviscerálne ochorenie zo štúdie PALOMA3 (populácia podľa liečebného zámeru)
| Viscerálne ochorenie
| Neviscerálne ochorenie
|
| Fulvestrant plus palbociklib
(N = 206)
| Fulvestrant plus placebo
(N = 105)
| Fulvestrant plus palbociklib
(N = 141)
| Fulvestrant plus placebo
(N = 69)
|
OR [% (95 % CI)]
| 35,0
| 13,3
| 13,5
| 14,5
|
| (28,5; 41,9)
| (7,5; 21,4)
| (8,3; 20,2)
| (7,2; 25,0)
|
TTR*, medián
| 3,8
| 5,4
| 3,7
| 3,6
|
[mesiace (rozsah)]
| (3,5; 16,7)
| (3,5; 16,7)
| (1,9; 13,7)
| (3,4; 3,7)
|
*Výsledky odpovedí založené na potvrdených a nepotvrdených odpovediach.
N = počet pacientok; CI = interval spoľahlivosti; OR = objektívna odpoveď; TTR = čas do prvej odpovede nádoru
Pacientkami hlásené príznaky boli hodnotené pomocou dotazníka kvality života (quality of life questionnaire, QLQ)-C30 Európskej organizácie pre výskum a liečbu rakoviny a jeho modulu rakoviny prsníka (EORTC QLQ BR23). Celkovo vyplnilo dotazník pri vstupe do štúdie a aspoň raz na ďalšej návšteve 335 pacientok v skupine fulvestrant plus palbociklib a 166 pacientok v skupine fulvestrant plus placebo.
Čas do zhoršenia bol vopred špecifikovaný ako čas medzi vstupom do štúdie a prvým výskytom
≥ 10-bodového vzostupu oproti počiatočnej hodnote skóra príznakov bolesti. Pridanie palbociklibu k fulvestrantu viedlo k prínosu, pokiaľ ide o príznaky, pretože významne predĺžilo čas do zhoršenia príznakov bolesti v porovnaní so skupinou fulvestrant plus placebo (medián 8,0 mesiacov oproti 2,8 mesiacov; HR = 0,64 [95 % CI: 0,49; 0,85]; p < 0,001).
Účinky na endometrium po menopauzePredklinické údaje nenaznačujú stimulačný účinok fulvestrantu na endometrium po menopauze (pozri časť 5.3). Dvojtýždňová štúdia u zdravých postmenopauzálnych dobrovoľníčok liečených 20 µg etinylestradiolu denne preukázala, že predliečenie fulvestrantom 250 mg malo za následok signifikantne redukovanú stimuláciu postmenopauzálneho endometria v porovnaní s predliečením placebom, hodnotenú na základe ultrasonografického merania hrúbky endometria.
Neoadjuvantná liečba až 16 týždňov u pacientok s karcinómom prsníka liečených buď fulvestrantom 500 mg alebo fulvestrantom 250 mg neviedla ku klinicky významným zmenám v hrúbke endometria, čo ukazuje na nedostatočný účinok agonistov. Neexistujú žiadne dôkazy o nepriaznivých účinkoch na endometrium u sledovaných pacientok s karcinómom prsníka. Nie sú k dispozícii údaje týkajúce sa endometriálnej morfológie.
V dvoch krátkodobých štúdiách (1 a 12 týždňov) u premenopauzálnych pacientok s benígnym gynekologickým ochorením sa nepozorovali žiadne signifikantné zmeny v hrúbke endometria ultrazvukovým meraním pri porovnaní skupín, ktorým sa podával fulvestrant a placebo.
Účinky na kostiNie sú k dispozícii dlhodobé údaje o účinku fulvestrantu na kosti. Neoadjuvantná liečba až 16 týždňov u pacientok s karcinómom prsníka buď fulvestrantom 500 mg alebo fulvestrantom 250 mg neviedla ku klinicky významným zmenám markerov kostného obratu v sére.
Pediatrická populáciaFulvestrant nie je indikovaný na použitie u detí.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s fulvestrantom vo všetkých podskupinách pediatrickej populácie pri karcinóme prsníka (informácie o použití v pediatrickej populácii, pozri časť 4.2).
Otvorená štúdia fázy 2 skúmala bezpečnosť, účinnosť a farmakokinetiku fulvestrantu u 30 dievčat vo veku od 1 do 8 rokov s progresívnou predčasnou pubertou spojenou s McCune Albrightovým syndrómom (MAS). Detskí pacienti dostali intramuskulárnu dávku fulvestrantu 4 mg/kg mesačne. Táto 12-mesačná štúdia skúmala škálu cieľov MAS a ukázala zníženie frekvencie vaginálneho krvácania a zníženie rýchlosti vzostupu kostného veku. V tejto štúdii bol u detí rovnovážny stav koncentrácie fulvestrantu v súlade s dospelými (pozri časť 5.2). Z tejto malej štúdie sa nezistili žiadne nové vyplývajúce obavy týkajúce sa bezpečnosti, ale 5-ročné údaje zatiaľ nie sú k dispozícii.
5.2 Farmakokinetické vlastnostiAbsorpciaPo podaní fulvestrantu vo forme dlhodobo pôsobiacej intramuskulárnej injekcie sa fulvestrant pomaly vstrebáva a maximálne plazmatické koncentrácie (C
max) sa dosiahnu približne po 5 dňoch. Podaním fulvestrantu v režime 500 mg sa dosiahnu hladiny expozície zodpovedajúce alebo blízke rovnovážnemu stavu počas prvého mesiaca dávkovania (priemer [CV]: AUC 475 [33,4%] ng.dní/ml, C
max 25,1 [35,3%] ng/ml, C
min 16,3 [25,9%] ng/ml). V rovnovážnom stave sa plazmatické koncentrácie fulvestrantu udržiavajú v relatívne úzkom rozmedzí s až približne 3-násobným rozdielom medzi maximálnou a minimálnou koncentráciou. Po intramuskulárnom podaní je expozícia v rozsahu dávok 50 až 500 mg približne úmerná dávke.
DistribúciaFulvestrant sa extenzívne a rýchlo distribuuje. Zjavný veľký distribučný objem v rovnovážnom stave (Vd
ss) je približne 3 až 5 l/kg, čo naznačuje, že distribúcia je väčšinou extravaskulárna. Fulvestrant sa vo vysokej miere (99%) viaže na plazmatické bielkoviny. Hlavnými zložkami väzby sú lipoproteínové frakcie veľmi nízkej denzity (VLDL), nízkej denzity (LDL) a vysokej denzity (HDL). Neuskutočnili sa žiadne interakčné štúdie týkajúce sa kompetitívnej väzby na bielkoviny. Úloha globulínu, ktorý viaže sexuálne hormóny (SHBG), nebola stanovená.
BiotransformáciaMetabolizmus fulvestrantu nebol plne hodnotený, ale zahŕňa kombinácie celého radu možných biotransformačných ciest, ktoré sú analogické cestám endogénnych steroidov. Identifikované metabolity (vrátane metabolitov typu 17-ketón, sulfón, 3-síran, 3- a 17-glukuronid) sú v antiestrogénových modeloch buď menej účinné, alebo vykazujú podobný účinok ako fulvestrant. Skúšky na preparátoch ľudskej pečene a rekombinantných ľudských enzýmoch udávajú, že na oxidácii fulvestrantu sa podieľa z P-450 izoenzýmov iba CYP3A4,
in vivo sa však zdá, že prevládajú cesty nevyužívajúce P-450. Údaje
in vitro naznačujú, že fulvestrant neinhibuje izoenzýmy CYP450.
ElimináciaFulvestrant sa eliminuje predovšetkým v metabolizovanej forme. Hlavnou cestou vylučovania je stolica, močom sa vylučuje menej ako 1%. Fulvestrant má vysoký klírens, 11±1,7 ml/min/kg, čo naznačuje vysoký podiel extrakcie pečeňou. Terminálny polčas (t
1/2) po intramuskulárnom podaní sa riadi rýchlosťou absorpcie a odhaduje sa na 50 dní.
Osobitné skupiny pacientovFarmakokinetická analýza populácie, podľa údajov zo štúdií fázy 3, nezaznamenala pri fulvestrante žiadne rozdiely vo farmakokinetickom profile pokiaľ ide o vek (rozsah 33 až 89 rokov), hmotnosť (40‑127 kg) alebo rasu.
Porucha funkcie obličiekMierna až stredne závažná porucha funkcie obličiek neovplyvnila v žiadnom klinicky významnom rozsahu farmakokinetiku fulvestrantu.
Porucha funkcie pečeneFarmakokinetika fulvestrantu bola hodnotená v klinickej štúdii s podaním jednorazovej dávky pacientkam s miernou až stredne závažnou poruchou funkcie pečene (Childovo-Pughove skóre A a B). Bola použitá vysoká dávka lieku v krátkodobo pôsobiacej intramuskulárnej injekcii. U pacientok s poruchou funkcie pečene bolo až 2,5-násobné zvýšenie AUC v porovnaní so zdravými osobami. Predpokladá sa, že u pacientok, ktorým sa podáva fulvestrant, bude takéto zvýšenie expozície dobre tolerované. Pacientky so závažnou poruchou funkcie pečene (Childovo-Pughove skóre C) neboli hodnotené.
Pediatrická populáciaFarmakokinetika fulvestrantu sa hodnotila v klinickej štúdii u 30 dievčat s progresívnou predčasnou pubertou spojenou s McCune Albrightovým syndrómom (pozri časť 5.1). Detské pacientky boli vo veku 1 až 8 rokov a dostali intramuskulárnu dávku fulvestrantu 4 mg/kg mesačne. Geometrický priemer (smerodajná odchýlka) rovnovážneho stavu koncentrácie (C
min,
ss) a AUC
ss bol 4,2 (0,9) ng/ml a 3 680 (1 020) ng*hod/ml, v uvedenom poradí. Hoci sú zozbierané údaje obmedzené, rovnovážny stav koncentrácie fulvestrantu u detí sa zdá byť v súlade s dospelými.
5.3 Predklinické údaje o bezpečnostiAkútna toxicita fulvestrantu je nízka.
Fulvestrant 250 mg injekčný roztok a iné formy fulvestrantu sa dobre znášali u všetkých zvieracích druhov v štúdiách s podávaním opakovaných dávok. Miestne reakcie vrátane myozitídy a tvorby granulómov v mieste podania injekcie sa pripisovali vehikulu, avšak závažnosť myozitídy u králikov sa pri fulvestrante zvyšovala v porovnaní so skupinou, ktorej bol podávaný fyziologický roztok. V štúdiách toxicity s opakovanými intramuskulárnymi dávkami fulvestrantu potkanom a psom bola antiestrogénová aktivita fulvestrantu zodpovedná za väčšinu prejavených účinkov, a to predovšetkým na ženský reprodukčný systém, ale aj na iné orgány citlivé na hormóny u obidvoch pohlaví. U niektorých psov sa pozorovala arteritída v rade rôznych tkanív po chronickom (12-mesačnom) dávkovaní.
V štúdiách na psoch pri perorálnom a intravenóznom podaní boli pozorované účinky na kardiovaskulárny systém (mierne zvýšenie S‑T segmentu EKG pri perorálnom podaní a zastavenie sínusového uzla u jedného psa pri intravenóznom podaní). Tieto účinky sa vyskytli pri koncentrácii fulvestrantu vyššej ako u pacientok (C
max > 15-krát), a pre bezpečnosť u človeka majú pri podaní klinickej dávky pravdepodobne len obmedzený význam.
Fulvestrant nepreukázal žiadny genotoxický potenciál.
Účinky fulvestrantu na reprodukciu a vývoj embrya/plodu preukázali pri dávkach podobných dávkam klinickým jeho antiestrogénny účinok. U potkanov sa pozoroval reverzibilný pokles plodnosti samíc a prežití embryí, dystokia a zvýšený výskyt abnormalít plodu vrátane tarzálnej flexúry. Fulvestrant podávaný králikom mal za následok potrat. Bolo pozorované zvýšenie hmotnosti placenty a postimplantačná strata plodov. U králikov došlo k zvýšenému výskytu zmien plodu (dorzálny posun panvového pletenca a 27. presakrálneho stavca).
Dvojročná štúdia onkogenicity na potkanoch (intramuskulárne podanie fulvestrantu) ukázala zvýšený výskyt benígnych bunkových nádorov granulózy vaječníkov u potkaních samíc pri vysokých dávkach 10 mg raz za 15 dní a zvýšený výskyt testikulárnych Leydigových bunkových nádorov u samcov. V dvojročnej štúdii onkogenicity na myšiach (perorálne podanie denne) bola zvýšená incidencia zväzkových stromálnych nádorov vaječníkov u samíc (benígnych aj malígnych) v dávkach 150 a 500 mg/kg/deň. S ohľadom na tieto nálezy pre úroveň nulového účinku ('the no-effect level') bola systémová expozícia (AUC) u potkanov približne 1,5-krát vyššia než očakávaná expozícia u žien a 0,8-krát vyššia než expozícia u mužov a u myší približne 0,8-krát vyššia než očakávaná expozícia u mužov či žien. Vyvolanie týchto nádorov zodpovedá farmakologicky vyvolaným endokrinným spätne väzbovým zmenám v hladinách gonadotropínov spôsobených antiestrogénmi u cyklujúcich zvierat. Preto tieto poznatky nie sú považované za dôležité pre použitie fulvestrantu u postmenopauzálnych žien s pokročilým karcinómom prsníka.
Hodnotenie environmentálneho rizika (ERA)Štúdie hodnotenia environmentálneho rizika preukázali, že fulvestrant má potenciál nepriaznivo
ovplyvňovať vodné prostredie (pozri časť 6.6).
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokEtanol (96-percentný)
Benzylalkohol
Benzylbenzoát
Ricínový olej rafinovaný
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti2 roky
6.4 Špeciálne upozornenia na uchovávanieUchovávajte a prepravujte v chlade (2 °C – 8 °C).
Má sa zamedziť teplotným odchýlkam mimo rozsah 2 °C – 8 °C. Vyhnite sa uchovávaniu pri teplote prevyšujúcej 30 °C a presahujúcej 28-dňové obdobie, kde priemerná teplota uchovávania pre tento liek je nižšia ako 25 °C (ale nad rozsah 2 °C - 8 °C). Po teplotných odchýlkach sa má liek okamžite vrátiť do odporúčaných podmienok uchovávania (uchovávanie a preprava v chladničke 2 °C – 8 °C). Teplotné odchýlky majú kumulatívny účinok na kvalitu lieku a 28-dňová lehota sa nesmie prekročiť počas trvania 2 rokov času použiteľnosti lieku Fulvestrant Accord (pozri časť 6.3). Vystavením teplotám nižším ako 2 °C nedôjde k poškodeniu lieku za predpokladu, že nie je uchovávaný pod -20 °C.
Naplnenú injekčnú striekačku uchovávajte v pôvodnom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah baleniaBalenie s naplnenou injekčnou striekačkou obsahuje:
Jedna naplnená injekčná striekačka z číreho skla typu I s koncovým uzáverom a uzáverom piestu a piestom obsahujúca 250 mg fulvestrantu v 5 ml roztoku.
Priložená je tiež bezpečnostná ihla (BD SafetyGlide) na pripojenie k nádobke injekčnej striekačky.
Fulvestrant Accord sa dodáva v balení dvoch naplnených injekčných striekačiek na jedno použitie.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomPokyny na podávanieUpozornenie - Bezpečnostnú ihlu pred použitím neautoklávujte. Počas použitia aj pri likvidácii musia byť ruky stále za ihlou.
Injekčné striekačky sa dodávajú s bezpečnostnou ihlou BD Safety Glide.
POZNÁMKA: Vzhľadom na blízkosť sedacieho nervu je potrebná opatrnosť pri injekčnom podávaní lieku Fulvestrant Accord do dorzogluteálnej oblasti (pozri časť 4.4).
Pre každú z oboch injekčných striekačiek:
- Opatrne vyberte sklenenú injekčnú striekačku z puzdra a skontrolujte, či nie je poškodená.
- Odstráňte obal s pripojeným gumeným viečkom hrotu tak, že otočíte plombou plastového obalu na luerovej koncovke injekčnej striekačky (pozri Obrázok 1).
|
Obrázok 1

|
- Odlepte vonkajší obal bezpečnostnej ihly (BD SafetyGlide). Pripojte bezpečnostnú ihlu k luerovej koncovke injekčnej striekačky (pozri Obrázok 2).
- Otočte ňou tak, aby sa ihla pevne prichytila o luerovú koncovku. Otáčajte ňou, kým pevne nezapadne.
- Priamym pohybom stiahnite z ihly kryt tak, aby sa nepoškodil hrot ihly.
- Preneste naplnenú injekčnú striekačku na miesto podania.
- Odstráňte kryt z ihly.
- Parenterálne roztoky sa musia pred podávaním vizuálne skontrolovať, či neobsahujú častice a či nedošlo k zmene ich zafarbenia.
- Vytlačte z injekčnej striekačky prebytočný plyn.
|   Obrázok 2 Obrázok 2

|
- Podávajte pomaly, intramuskulárne (1-2 minúty/injekcia) do sedacieho svalu (gluteálna oblasť). Na uľahčenie podávania je skosená strana ihly orientovaná k ramenu páčky (pozri obrázok 3).
| Obrázok 3
|
- Po podaní injekcie okamžite aktivujte bezpečnostný mechanizmus zatlačením luerového ramena dopredu, až kým hrot ihly nie je úplne zakrytý (pozri obrázok 4).
POZNÁMKA: Aktivujte mechanizmus smerom od seba a iných. Dávajte pozor na cvaknutie a vizuálne sa presvedčte, že hrot ihly je úplne zakrytý.
|
Obrázok 4

|
LikvidáciaNaplnené injekčné striekačky sú určené
len na jednorazové použitie.
Tento liek môže predstavovať riziko pre vodné prostredie. Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAccord Healthcare Polska Sp. z o.o.
ul. Taśmowa 7
02-677 Warszawa
Poľsko
8. REGISTRAČNÉ ČÍSLA34/0069/19-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 11. marca 2019
10. DÁTUM REVÍZIE TEXTU08/2019