
s ochorením srdca sa majú sledovať na zhoršujúce sa ochorenie. Ak sa vyskytne závažná ortostatická hypotenzia alebo závažné kardiovaskulárne príznaky, liečba sa má ukončiť.
Hyperkalciémia
U normokalcemických pacientok sa po injekcii abaloparatidu pozorovalo prechodné zvýšenie sérových
koncentrácií vápnika. Sérové koncentrácie vápnika dosahujú maximálne hodnoty približne po 4 hodinách a vrátia sa na počiatočnú hodnotu 24 hodín po podaní každej dávky. Preto, ak sa odoberajú krvné vzorky na meranie sérovej hladiny vápnika, má sa to vykonávať približne 24 hodín po poslednej injekcii.
U pacientok bez dodatočných rizikových faktorov pre hyperckalciémiu sa rutinné sledovanie vápnika počas liečby nevyžaduje.
Hyperkalciúria a urolitiáza
Abaloparatid môže spôsobiť hyperkalciúriu. Nie je známe, či môže abaloparatid zhoršiť urolitiázu
u pacientok s aktívnou urolitiázou alebo s urolitiázou v anamnéze. Ak existuje podozrenie na aktívnu urolitiázu alebo hyperkalciúriu, má sa zvážiť meranie vápnika vylučovaného v moči.
Trvanie liečby
Maximálne celkové trvanie liečby abaloparatidom má byť 18 mesiacov. Štúdie na potkanoch naznačujú
zvýšenú frekvenciu výskytu osteosarkómu pri dlhodobom podávaní abaloparatidu (pozri časť 5.3).
Obsah sodíka
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v dávke, t.j. v podstate zanedbateľné množstvo
sodíka.
4.5 Liekové a iné interakcie
S abaloparatidom sa neuskutočnili žiadne špecifické interakčné štúdie. Pri zvážení farmakokinetických
vlastností abaloparatidu sa jeho potenciál pre interakcie považuje za nízky.
Neexistujú žiadne údaje o účinnosti abaloparatidu u pacientok predtým alebo súbežne liečených
bifosfonátmi alebo glukokortikoidmi.
Súbežná liečba vazokatívnymi liekmi môže viesť k predispozícii pre ortostatickú hypotenziu, keďže účinok abaloparatidu znižujúci krvný tlak môže byť zvýšený, pozri časť 4.4.
Sporadické hlásenia prípadov naznačovali, že hyperkalciémia môže viesť k predispozícii pacientok pre digitalisovú toxicitu. Keďže pre abaloparatid sa preukázalo zvýšenie sérovej hladiny vápnika, má sa používať s opatrnosťou u pacientok užívajúcich digitalis.
4.6 Fertilita, gravidita a laktácia
Tento liek nie je indikovaný u žien vo fertilnom veku. Nesmie sa používať u žien, ktoré sú alebo by mohli byť tehotné, ani u dojčiacich žien (pozri časti 4.1 a 4.3).
Gravidita
Eladynos je kontraindikovaný počas gravidity (pozri časť 4.3).
Dojčenie
Nie je známe, či sa abaloparatid vylučuje do ľudského mlieka. Riziko u novorodencov/dojčiat nemôže
byť vylúčené. Eladynos je kontraindikovaný počas dojčenia (pozri časť 4.3).
Fertilita
Nie sú k dispozícii žiadne údaje o účinku abaloparatidu na ľudskú fertilitu. Štúdie na potkanoch
s abaloparatidom nepreukázali žiadne účinky na samčiu fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Abaloparatid nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Po podaní abaloparatidu sa môže vyskytnúť prechodná ortostatická hypotenzia alebo závrat (pozri
časť 4.8). Tieto pacientky nemajú viesť vozidlá ani obsluhovať stroje, až kým príznaky neustúpia.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie hlásenými nežiaducimi liekovými reakciami u pacientok liečených abaloparatidom v štúdii
ACTIVE boli hyperkalciúria (15,6 %), závrat (11,1 %), bolesť chrbta (8,6 %), nevoľnosť (8,5 %), bolesť
hlavy (8,5 %), artralgia (8,4 %), hypertenzia (6,8 %), reakcie v mieste injekcie (6,2 %) a palpitácie
(5,6 %).
Tabuľkový zoznam nežiaducichreakcií
U pacientok v štúdii ACTIVE s abaloparatidom hlásilo 90,3 % pacientok dostávajúcich abaloparatid
a 88,4 % pacientok dostávajúcich placebo aspoň 1 nežiaducu príhodu.
Nežiaduce reakcie súvisiace s používaním abaloparatidu na liečbu osteoporózy v štúdii ACTIVE a pri expozícii po uvedení lieku na trh sú zhrnuté v tabuľke nižšie. Na klasifikáciu nežiaducich reakcií sa použila nasledujúca konvencia MedDRA: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
T
abuľka 1 - Tabuľkový zoznam nežiaducich reakcií
Poruchy imunitného systému
M
enej časté: precitlivenosť
Neznáma frekvencia: anafylaktická reakcia
|
Poruchy metabolizmu a výživy
Č
asté: hyperkalciémia, hyperurikémia
|
Psychické poruchy
Č
asté: nespavosť
|
Poruchy nervového systému
Veľmi časté: závrat
Časté: bolesť hlavy
|
Poruchy srdca a srdcovej činnosti
Č
asté: palpitácie, tachykardia
|
Poruchy ciev
Č
asté: hypertenzia
Menej časté: ortostatická hypotenzia
|
Poruchy gastrointestinálneho traktu
Č
asté: nevoľnosť, bolesť brucha, zápcha, hnačka, vracanie
Menej časté: abdominálna distenzia
|
Poruchy kože a podkožného tkaniva
Č
asté: pruritus, vyrážka
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Č
asté: bolesť chrbta, artralgia, bolesť končatiny, svalové kŕče (chrbát a nohy), bolesť kostí
|
Poruchy obličiek a močových ciest
Veľmi časté: hyperkalciúria
Časté: nefrolitiáza
|
C
elkové poruchy a reakcie v mieste podania
Č
asté: reakcie v mieste injekcie, únava, asténia, malátnosť
Menej časté: bolesť
|
Popis
v
ybraných
nežiaducich
reakcií
Zvýš ená sr dcov á f rek venci a
V štúdii QT bolo priemerné zvýšenie srdcovej frekvencie upravené podľa placeba 14,5 úderov za minútu
(
beats per minute, bpm) 15 minút po podaní lieku. Toto zvýšenie srdcovej frekvencie bolo najvýraznejšie počas prvej hodiny po podaní dávky, ale u niektorých osôb sa pozorovalo až do 6 hodín.
V štúdii ACTIVE sa srdcová frekvencia merala jednu hodinu po podaní dávky pri každej študijnej návšteve, s mediánom zvýšenia srdcovej frekvencie oproti stavu pred podaním dávky 14 bpm u pacientok liečených abaloparatidom v porovnaní so 7 bpm u pacientok, ktoré dostávali placebo. U pacientok so zvýšením srdcovej frekvencie > 20 bpm za 1 hodinu po prvej dávke bol pravdepodobnejší výskyt palpitácií a/alebo zvýšení srdcovej frekvencie > 20 bpm počas ďalšej liečby. Nežiaduce reakcie tachykardia a sínusová tachykardia sa hlásili u 1,6 % pacientok dostávajúcich abaloparatid a 0,4 % pacientok v skupine s placebom.
Ortostatická hypotenziaU žien s postmenopauzálnou osteoporózou sa hlásili nežiaduce reakcie ortostatickej hypotenzie u 1 %
pacientok dostávajúcich abaloparatid a 0,6 % pacientok v skupine s placebom.
Reakcie v mieste injekcie
Abaloparatid môže spôsobiť reakcie v mieste injekcie vrátane podliatiny, erytému, krvácania,
precitlivenosti, bolesti, vyrážky a opuchu v mieste injekcie. Celková frekvencia výskytu v skupine s abaloparatidom bola 5,3 % v porovnaní so 4,0 % v skupine s placebom.
Laboratórne nálezySérová hladina vápnikaAbaloparatid môže spôsobiť prechodné zvýšenia sérových hladín vápnika meraných 4 hodiny po podaní dávky. Celková frekvencia výskytu hyperkalciémie definovanej ako sérová hladina vápnika upravená podľa albumínu ≥ 2,67 mmol/l (alebo ≥ 10,7 mg/dl) bola vyššia v skupine s abaloparatidom (3,3 %)
v porovnaní so skupinou s placebom (0,4 %).
Sérová hladina kyseliny močovejAbaloparatid spôsobil zvýšenie sérových koncentrácií kyseliny močovej. V štúdii ACTIVE sa u 25 %
pacientok v skupine s abaloparatidom s normálnymi počiatočnými koncentráciami kyseliny močovej po začatí liečby koncentrácie zvýšili na hodnoty nad normálnym rozsahom, v porovnaní s 5 % v skupine
s placebom.
Hyperkalciúria a urolitiázaV klinickom skúšaní u žien s postmenopauzálnou osteoporózou bola celková frekvencia výskytu vápnika v moči: pomer kreatinínu > 0,00113 mmol/µmol (alebo > 400 mg/g) vyššia pre abaloparatid v porovnaní
s placebom (20 % oproti 15 %). Urolitiáza sa hlásila u 1,4 % pacientok liečených abaloparatidom
a u 1,2 % pacientok, ktoré dostávali placebo.
ImunogenitaU pacientok dostávajúcich abaloparatid po dobu 18 mesiacov sa u 42,9 % vyvinuli protilátky proti abaloparatidu a u 28,5 % sa vyvinuli neutralizačné protilátky
in vitro. Tvorba protilátok proti abaloparatidu sa spája so zvýšeným klírensom abaloparatidu. Tieto zmeny klírensu môžu súvisieť
s protilátkami proti abaloparatidu ovplyvňujúcimi presné meranie koncentrácií abaloparatidu v plazme. V porovnaní s pacientkami negatívnymi na protilátky sa u pacientok, ktoré boli pozitívne na protilátky
alebo ktoré boli pozitívne na neutralizačné protilátky
in vitro, nepozorovali žiadne klinicky významné rozdiely v bezpečnosti ani účinnosti.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 PredávkovaniePrejavy a príznakyV klinických skúšaniach sa abaloparatid podával subkutánne v jednorazových dávkach až
320 mikrogramov a v opakovaných dávkach až 120 mikrogramov/deň počas 7 dní. Primárnym
nežiaducim účinkom obmedzujúcim dávku bol posturálny závrat.
Účinky predávkovania, ktoré je možné očakávať, zahŕňajú prechodnú hyperkalciúriu, hyperkalciémiu, nevoľnosť, vracanie, závrat, palpitácie, ortostatickú hypotenziu a bolesť hlavy.
V klinickom programe so skorším dizajnom pera sa hlásilo náhodné predávkovanie u pacientky, ktorá dostala 400 mikrogramov v jeden deň (5-krát vyššia ako je odporúčaná klinická dávka). U pacientky sa vyskytla asténia, bolesť hlavy, nevoľnosť a vertigo. V deň predávkovania sa nehodnotila sérová hladina vápnika, avšak nasledujúci deň bola sérová hladina vápnika pacientky v rámci normálneho rozsahu.
Liečba predávkovania
Pre abaloparatid neexistuje žiadne špecifické antidotum. Liečba podozrenia na predávkovanie môže
zahŕňať prechodné prerušenie liečby, sledovanie sérových hladín vápnika a zavedenie vhodných podporných opatrení ako je hydratácia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Homeostatiká vápnika, hormóny príštitných teliesok a analógy, ATC kód: H05AA04
Mechanizmus účinku
Abaloparatid je peptid pozostávajúci z 34 aminokyselín, ktorý je na 41 % homológny s paratyreoidálnym
hormónom [PTH(1-34)] a na 76 % homológny s peptidom príbuzným s paratyreoidálnym hormónom
[PTHrP(1-34)], a je aktivátorom signálnej dráhy receptora PTH1. Abaloparatid stimuluje tvorbu novej kosti na trabekulárnych a kortikálnych kostných povrchoch stimulovaním aktivity osteoblastov.
Abaloparatid spôsobuje prechodné a obmedzené zvýšenia kostnej resorpcie a zvyšuje hustotu kostí. Klinickáúčinnosťabezpečnosť
Účinnosť a bezpečnosť abaloparatidu podávaného jedenkrát denne sa hodnotila v randomizovanej,
multicentrickej, dvojito zaslepenej klinickej štúdii kontrolovanej placebom a otvorenej klinickej štúdii
kontrolovanej aktívnym komparátorom (teriparatidom) (štúdia ACTIVE) počas 18 mesiacov liečby
a 1 mesiaca sledovania u 2 070 žien po menopauze vo veku 50 až 86 rokov (priemerný vek 69 rokov;
15 % bolo vo veku < 65 rokov, 65 % bolo vo veku 65 až ˂ 75 rokov a 20 % bolo vo veku ≥ 75 rokov), ktoré boli zaradené do štúdie a randomizované na liečbu abaloparatidom 80 mikrogramov (N = 696), na placebo (N = 688) alebo na 20 mikrogramov teriparatidu (N = 686). Približne 76 % pacientok boli belošky, 19 % boli Ázijky a 4 % boli černošky. Z celkovej populácie štúdie bolo 28 % hispánskeho pôvodu. Ženy denne užívali doplnkový vápnik (500 až 1 000 mg) a vitamín D (400 až 800 IU). Primárnym cieľovým ukazovateľom v štúdii ACTIVE bola frekvencia výskytu nových zlomenín stavcov u pacientok liečených abaloparatidom oproti placebu.
Počiatočné priemerné T-skóre boli -2,9 v lumbálnej časti chrbtice, -2,2 v krčku femuru a -1,9 v celkovej bedrovej kosti. Na začiatku liečby 42 % pacientok nemalo predchádzajúcu zlomeninu, 23 % pacientok malo aspoň jednu predchádzajúcu zlomeninu stavca a 43 % malo aspoň jednu predchádzajúcu zlomeninu inú ako zlomenina stavca.
Úči nok na nové zl omeni ny st avcov
V štúdii ACTIVE po 18 mesiacoch abaloparatid a teriparatid významne znížili absolútne riziko nových
zlomenín stavcov oproti placebu u pacientok po menopauze s osteoporózou (p < 0,0001; pozri tabuľku 2).
T
abuľka 2 - Skúšanie ACTIVE: účinok* abaloparatidu na riziko nových zlomenín stavcov po
18 mesiacoch
Parameter
|
PBO
(
N = 600)
|
ABL
(
N = 583)
|
TER
(
N = 600)
|
Počet žien so zlomeninou stavca, n (%)
|
25 (4,2)
|
3 (0,5)
|
4 (0,7)
|
Rozdiel v absolútnom riziku oproti placebu† (%) (95 % IS)
|
n/a
|
3,7 (2,0; 5,6)
|
3,5 (1,8; 5,5)
|
*Na základe modifikovanej populácie všetkých randomizovaných pacientok (
Intent to Treat) (pacientky s röntgenovými snímkami chrbtice vo východiskovom stave a po začatí liečby).
†Rozdiel v absolútnom riziku sa vypočítal ako (PBO – ABL) a (PBO – TER).
PBO = placebo, ABL = abaloparatid, TER = teriparatid, IS = Interval spoľahlivosti.
Úči nok na iné zlomeniny ako zlomeniny stavcovV štúdii ACTIVE bola po 19 mesiacoch frekvencia výskytu iných zlomenín ako zlomenín stavcov podobná pre skupiny s abaloparatidom (2,7 %) a teriparatidom (2,0 %) a štatisticky sa neodlišovala od
placeba (3,6 %) (pozri tabuľku 3).
Tabuľka 3 - Skúšanie ACTIVE: čas do výskytu iných zlomenín ako sú zlomeniny stavcov po19 mesiacochParameter
| PBO
(N = 688)
| ABL
(N = 696)
| TER
(N = 686)
|
K-M odhadovaná miera výskytu príhody (%) (95 % IS)
| 3,6 (2,3; 5,4)
| 2,7 (1,6; 4,4)
| 2,0 (1,1; 3,4)
|
Počet pacientok s príhodou n (%)
| 21 (3,1)
| 15 (2,2)
| 12 (1,7)
|
Rozdiel v absolútnom riziku oproti placebu* (%) (95 % IS)
| n/a
| 0,9
(-1,1; 2,9)
| 1,6
(-0,3; 3,5)
|
*Rozdiel v absolútnom riziku sa vypočítal ako (PBO – ABL) a (PBO – TER).
PBO = placebo, ABL = abaloparatid, TER = teriparatid, K-M = Kaplan Meier, IS = Interval spoľahlivosti.
Úči nok na mi ner ál nu hust ot u kostí ( Bone M i ner al Densi ty, BM D) V štúdii ACTIVE abaloparatid významne zvýšil BMD na všetkých meraných anatomických miestach oproti placebu po 6, 12 a 18 mesiacoch. Priemerná percentuálna zmena BMD po 18 mesiacoch bola 9,1 %
oproti 0,5 % v lumbálnej časti chrbtice, 3,3 % oproti 0 % v celkovej bedrovej kosti a 2,7 % oproti -0,4 %
v krčku femuru pre skupinu s abaloparatidom oproti skupine s placebom, v uvedenom poradí (všetky
p < 0,0001). V oblasti ultradistálneho polomeru bola priemerná percentuálna zmena BMD po
18 mesiacoch 1,2 % oproti -1,0 % pre skupinu s abaloparatidom oproti skupine s placebom.
Pre abaloparatid sa preukázali konzistentné zvýšenia meraní BMD nezávisle od veku, rokov od menopauzy, rasovej príslušnosti, geografického regiónu, prítomnosti či neprítomnosti predchádzajúcich zlomenín (stavce, iné ako stavce), závažnosti ochorenia a počiatočnej hodnoty BMD.
Markery kostného obratuU žien po menopauze s osteoporózou preukazoval kostný anabolický marker (s-PINP) 90 % zvýšenie od počiatočnej hodnoty po 1 mesiaci a tento účinok sa udržal počas celého obdobia liečby abaloparatidom.
Marker kostnej resorpcie (s-CTX) nepreukazoval žiadne zvýšenie po 1 mesiaci a prechodné zvýšenie o
22 % od počiatočnej hodnoty po 3 mesiacoch, ktoré sa na konci liečby vrátilo na počiatočnú hodnotu.
Liečba poukončeníliečbyvštúdiiRozšírená štúdiaPo ukončení skúšania ACTIVE bolo 963 pacientok zaradených do skúšania ACTIVExtend, otvorenej, rozšírenej štúdie, v ktorej všetky pacientky dostávali až 24-mesačnú liečbu 70 mg alendronátu (ALN)
týždenne a doplnkový vápnik a vitamín D. To zahŕňalo 494 pacientok, ktoré predtým dostávali placebo
a 469 pacientok, ktoré predtým dostávali abaloparatid. Pacientky, ktoré počas skúšania ACTIVE dostávali teriparatid neboli spôsobilé pre účasť na skúšaní ACTIVExtend. Výsledky zníženia rizika zlomeniny
stavcov po 43 mesiacoch od randomizácie sú uvedené v tabuľke 4.
Účinok na nové zlomeniny stavcov – rozšírená štúdiaV štúdii ACTIVExtend po 43 mesiacoch abaloparatid/ALN významne znížil absolútne riziko nových
zlomenín stavcov oproti placebu/ALN (p < 0,0001; pozri tabuľku 4). Teriparatid s následným podávaním alendronátu sa neskúmal.
Tabuľka 4 - Skúšanie ACTIVExtend: účinok* abaloparatidu/ALN na riziko nových zlomenínstavcov po 43 mesiacoch†Parameter
| PBO/ALN
(N = 489)
| ABL/ALN
(N = 457)
|
Počet žien so zlomeninou stavca, n (%)
| 26 (5,3)
| 4 (0,9)
|
Rozdiel v absolútnom riziku oproti placebu/ALN‡ (%) (95 % IS)
| n/a
| 4,4 (2,3; 6,9)
|
*Na základe modifikovanej populácie všetkých randomizovaných pacientok (
Intent to Treat) (pacientky s röntgenovými snímkami chrbtice vo východiskovom stave a po začatí liečby).
†Podávanie alendronátu sa začalo v 19. mesiaci.
‡ Rozdiel v absolútnom riziku sa vypočítal ako (PBO/ALN – ABL/ALN).
PBO = placebo, ABL = abaloparatid, ALN = alendronát, IS = interval spoľahlivosti.
Účinok na iné zlomeniny ako zlomeniny stavcov – rozšírená štúdiaV štúdii ACTIVExtend po 43 mesiacoch abaloparatid/ALN počtom znížil riziko iných zlomenín ako zlomenín stavcov oproti placebu/ALN. Frekvencia výskytu iných zlomenín ako zlomenín stavcov pre abaloparatid/ALN (4,2 %) nebola štatisticky odlišná v porovnaní s placebom (6,7 %) (pozri tabuľku 5).
Tabuľka 5 - Skúšanie ACTIVExtend: čas do výskytu iných zlomenín ako zlomenín stavcov po43 mesiacoch*Parameter
| PBO/ALN
(N = 494)
| ABL/ALN
(N = 469)
|
K-M odhadovaná miera výskytu príhody (%)
(95 % IS)
| 6,7
(4,8; 9,3)
| 4,2
(2,7; 6,4)
|
Počet pacientok s príhodou
n (%)
| 32 (6,5)
| 19 (4,1)
|
Rozdiel v absolútnom riziku oproti placebu/ALN† (%)
(95 % IS)
| n/a
| 2,5
(-0,4; 5,4)
|
* Podávanie alendronátu sa začalo v 19. mesiaci.
† Rozdiel v absolútnom riziku sa vypočítal ako (PBO/ALN – ABL/ALN).
PBO = placebo, ABL = abaloparatid, ALN = alendronát, K-M = Kaplan Meier, IS = interval spoľahlivosti.
Účinok na minerálnu hustotu kostí (BMD)– rozšírená štúdiaPriemerná percentuálna zmena BMD po 43 mesiacoch bola 14,7 % oproti 6,8 % v lumbálnej časti
chrbtice, 6,3 % oproti 2,9 % v celkovej bedrovej kosti, 5,0 % oproti 1,6 % v krčku femuru a 1,1 % oproti
1,1 % v oblasti ultradistálneho polomeru v skupine s abaloparatidom/ALN oproti skupine s placebom/ALN, v uvedenom poradí.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s abaloparatidom vo
všetkých podskupinách pediatrickej populácie pre liečbu osteoporózy (informácie o použití v pediatrickej
populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Medián (rozsah) času do maximálnej koncentrácie abaloparatidu 80 mikrogramov po subkutánnom
podaní bol 0,5 h (0,25 až 0,52 h). Absolútna biologická dostupnosť abaloparatidu u zdravých jedincov po subkutánnom podaní dávky 80 mikrogramov bola približne 39 %.
Distribúcia
Väzba abaloparatidu na plazmatické proteíny in vitro bola približne 70 %. Distribučný objem bol
približne 45 l.
Biotransformácia
S abaloparatidom sa neuskutočnili žiadne špecifické štúdie metabolizmu alebo vylučovania.
Metabolizmus abaloparatidu je konzistentný s nešpecifickým proteolytickým rozpadom na menšie
peptidové fragmenty, po ktorom nasleduje eliminácia prostredníctvom renálneho klírensu. In vitro štúdie preukázali, že pri klinicky významných koncentráciách abaloparatid neinhibuje ani neindukuje enzýmy cytochrómu P450.
Eliminácia
Priemerný zdanlivý celkový plazmatický klírens pri subkutánnom podaní je 168 l/h u zdravých osôb
a priemerný polčas abaloparatidu je približne 1 h. Peptidové fragmenty sa eliminujú primárne renálnym
vylučovaním. Nie je možné vylúčiť aktívnu sekréciu abaloparatidu v obličkách.
Abaloparatid nie je substrátom renálnych transportérov P-gp, OAT1, OAT3, OCT2, MATE1 ani MATE2K. Okrem toho abaloparatid neinhibuje in vitro v klinicky významných koncentráciách transportéry P-gp, BCRP, OAT1, OAT3, OCT2, OATP1B1 ani OATP1B3.
Linearita
Systémová expozícia abaloparatidu sa vo všeobecnosti zvyšovala so zvyšovaním subkutánnej dávky
v rozsahu od 5 mikrogramov až do 240 mikrogramov. Po zvýšení dávky na 280 mikrogramov
a 320 mikrogramov sa pozoroval všeobecný trend smerom k menej ako dávke úmerným zvýšeniam
a žiadnym ďalším zvýšeniam systémovej expozície abaloparatidu.
Porucha funkcieobličiek
Expozícia abaloparatidu sa zvyšovala so znižujúcim sa CrCl. Osoby s ľahkou, stredne ťažkou a ťažkou
poruchou funkcie obličiek mali zvýšené hodnoty Cmax o 3 %, 28 % a 44 %, v uvedenom poradí, a zvýšené hodnoty AUC o 17 %, 68 % a 113 %, v uvedenom poradí, v porovnaní s osobami s normálnou funkciou obličiek (pozri časti 4.2 a 4.3).
U pacientov podstupujúcich dialýzu z dôvodu chronického zlyhania obličiek sa nevykonali žiadne štúdie.
Porucha funkciepečene
U pacientov s poruchou funkcie pečene sa nevykonali žiadne štúdie. Abaloparatid je peptid a nie je
inhibítorom ani induktorom pečeňových enzýmov metabolizujúcich lieky. Eliminácia prebieha
prostredníctvom proteolytického rozpadu a renálneho vylučovania a nie je pravdepodobné, že porucha funkcie pečene bude mať významný vplyv na expozíciu abaloparatidu. U týchto pacientok nie je potrebná žiadna úprava dávky (pozri časť 4.2).
Staršie pacientky
Počas klinických štúdií zahŕňajúcich ženy po menopauze vo veku od 49 do 86 rokov sa nezaznamenali
žiadne rozdiely farmakokinetických vlastností abaloparatidu súvisiace s vekom.
5.3 Predklinické údaje o bezpečnosti
V 2-ročnej štúdii karcinogenity na potkanoch preukázal abaloparatid zvýšenie celkovej frekvencie výskytu osteosarkómov pri dávkach, ktoré boli na základe porovnaní hodnôt AUC 4-násobne vyššie ako je systémová expozícia pozorovaná u ľudí po subkutánnom podaní dávky 80 mikrogramov. Neoplastické zmeny súvisiace s liečbou abaloparatidom pozostávali zo zvýšenej frekvencie výskytu osteosarkómov
a osteoblastómov závislej od dávky. Frekvencia výskytu a najskorší výskyt nádorov bol podobný
u samcov aj samíc potkanov. Význam týchto nálezov u potkanov pre ľudí nie je jasný, preto sa má u pacientok so zvýšeným rizikom ostesarkómu vyhnúť používaniu abaloparatidu.
V toxikologických štúdiách na potkanoch a opiciach nálezy zahŕňali mineralizáciu mäkkého tkaniva pri dávkach, ktoré boli približne 2 a 3-násobne vyššie ako je expozícia u ľudí pri denných subkutánnych dávkach 80 mikrogramov.
Subkutánne podávanie abaloparatidu psom pri vedomí v dávkach, ktoré boli približne 0,3, 2,4
a 3,8-násobkom expozície u ľudí pri denných subkutánnych dávkach 80 mikrogramov, viedlo
k prechodnému zvýšeniu srdcovej frekvencie závislému od dávky trvajúcemu približne 3 hodiny a malo len nepodstatné účinky na stredný arteriálny krvný tlak. Okrem toho mal abaloparatid nepodstatné účinky
na interval QTc s nevýznamnou tendenciou smerom k zníženiu QTc so zvyšujúcou sa dávkou, čo je
v súlade s jeho minimálnymi účinkami na draslíkový prúd v hERG kanáloch a na Purkyňove vlákna pri klinicky významných koncentráciách.
Abaloparatid nebol v štandardnom súbore testov genotoxický ani mutagénny.
Nevykonali sa žiadne štúdie embryofetálneho vývoja ani pre/postnatálneho vývoja u samíc zvierat, pretože cieľovou skupinou abaloparatidu sú ženy po menopauze. U potkanov sa hodnotili účinky na samčiu fertilitu a nepozoroval sa žiadny vplyv na samčiu fertilitu pri dávkach 27-násobne vyšších ako je expozícia u ľudí pri denných subkutánnych dávkach 80 mikrogramov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
fenol
voda na injekcie
trihydrát octanu sodného (na úpravu pH)
kyselina octová (na úpravu pH)
6.2 InkompatibilityNevykonali sa žiadne štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti3 roky
Po prvom použití alebo po vybratí z chladničky uchovávajte pero pri teplote do 25 °C. Musí sa použiť do
30 dní.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke (2 °C-8 °C). Neuchovávajte v mrazničke.
Podmienky na uchovávanie po vybratí lieku z chladničky, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaNáplň (silikonizované sklo typu I) s piestom (chlórbutylová guma), tesniace viečko (brómbutylové
gumové tesnenie)/hliník zložené do pera na jednorazové použitie.
Jedno naplnené pero obsahuje 1,5 ml roztoku (30 dávok).
Veľkosť balenia: 1 naplnené pero.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomKaždé pero sa má používať len u jednej pacientky. Na každú injekciu sa musí použiť nová sterilná ihla. Pero sa má používať výhradne s 8 mm ihlami 31G. S liekom sa nedodávajú žiadne ihly. Neuchovávajte pero s pripojenou ihlou.
Eladynos sa nesmie použiť, ak je roztok zakalený, sfarbený alebo obsahuje častice.
Pred prvým použitím pomôcky pera si má pacientka prečítať a porozumieť pokynom na použitie pera. Podrobné pokyny na použitie sú priložené k peru v škatuli.
 Podanie injekcie lieku EladynosKrok 1 Skontrolujte pero Eladynos
Podanie injekcie lieku EladynosKrok 1 Skontrolujte pero Eladynos• Pred použitím pera vždy skontrolujte označenie, aby ste sa uistili, že je to správne pero.
• Poznačte si dátum 1. dňa na miesto na to určené na škatuli. Nepoužívajte pero dlhšie ako
30 za sebou nasledujúcich dní.
Pero zlikvidujte 30 dní po prvom použití.
• Stiahnite viečko z pera.
• Skontrolujte náplň Eladynos. Tekutina má byť číra, bezfarebná a bez častíc, ak nie je, liek nepoužívajte. V tekutine môžu byť prítomné malé vzduchové bublinky, to je normálne.
|
K
rok 2 Pripojte ihlu k peru Eladynos
• Z novej ihly odstráňte ochranný papier.
• Zatlačte ihlu s krytom priamo na pero a zakrúťte ju, až kým sa nezaistí. Uistite sa, že ihla je rovná a pri zavádzaní sa neohla. Ak ihla nie je správne pripevnená, pero nebude fungovať. Ihlu príliš nepriťahujte, pretože ju bude ťažké odstrániť.
• Stiahnite vonkajší kryt ihly a odložte si ho na použitie po podaní injekcie.
• Opatrne stiahnite vnútorný kryt ihly a zlikvidujte ho.
|
K
rok 3 Iba 1. deň - testovanie pera Eladynos pred prvou injekciou
• Pero obsahuje liek na 30 dní a malé množstvo na testovanie každého pera jedenkrát, na potvrdenie jeho správneho fungovania.
• Upozornenie: Ak pacientka testuje pero pred každou injekciou, liek v pere sa minie skôr.'
Preto pre každé pero vykonajte krok 3 iba jedenkrát, len 1. deň pred prvou injekciou.
• Od 2. dňa do 30. dňa pero znovu netestujte, prejdite priamo ku kroku 4 na nastavenie dávky na injekciu.
• Otočte dávkovacím gombíkom na pere smerom od seba (v smere hodinových ručičiek), až
kým sa nezastaví. Na okienku zobrazujúcom dávku sa zobrazí zaradené číslo „•80“.
• Držte pero s ihlou smerujúcou nahor.
• Stlačte zelený injekčný gombík až na doraz. Zo špičky ihly vytečie tekutina ako kvapka alebo prúd. Ak sa neobjaví žiadna tekutina, pozri Riešenie problémov v „Pokynoch na použitie“ na konci písomnej informácie pre používateľku.
• Na okienku zobrazujúcom dávku sa zobrazí číslo „•0“.
|
K
rok 4 Nastavte dávku na pere Eladynos
• Otočte bielym gombíkom na pere smerom od seba (v smere hodinových ručičiek), až kým sa gombík nezastaví a na okienku zobrazujúcom dávku sa zobrazí číslo „•80“. Pero je teraz pripravené na injekciu.
|
K
rok 5 Zvoľte a očistite miesto injekcie
• Injekcie sa majú podávať do spodnej časti brucha. Vyhnite sa oblasti 5 cm okolo pupku.
• Pre každú injekciu zvoľte každý deň iné miesto injekcie na bruchu. Injekciu podávajte len
do zdravej kože. Injekciu nepodávajte do oblastí brucha, v ktorých je koža citlivá,
s podliatinou, červená, kde sa koža olupuje alebo je stvrdnutá. Vyhnite sa oblastiam
s jazvami alebo striami.
• Utrite miesto injekcie alkoholovým tampónom a nechajte ho uschnúť.
• Miesta injekcie sa po očistení už nedotýkajte, nesušte ho prúdom vzduchu ani naň
nefúkajte.
• Poznámka: Odporúča sa stisnúť kožu na mieste, kde sa podá injekcia. Potom, ako sa ihla vpichne do kože, sa stisnutie môže uvoľniť.
|
K
rok 6 Podanie injekcie perom Eladynos
• Vpichnite ihlu priamo do kože.
• Stlačte a DRŽTE zelený gombík až kým sa nedokončia VŠETKY body uvedené nižšie
a nezobrazí sa číslo „●0“.
• Držte 10 sekúnd na podanie celej dávky, vytiahnite pero z kože a až POTOM pusťte
gombík.
|
K
rok 7 Odstráňte ihlu z pera
• Opatrne nasaďte vonkajší kryt ihly späť na ihlu. Potom opatrne stlačte vonkajší kryt ihly, až kým nezapadne na miesto a nezaistí sa.
• Odkrúťte ihlu s krytom (ako keď odstraňujete viečko z fľaše). Na odkrútenie ihly
|
s krytom stisnite spodok krytu oproti ihle a otočte ho 8 alebo viackrát a potom jemne
stiahnite, až kým sa ihla s nasadeným krytom neuvoľní.
• Poznámka: Počas odkrúcania ihly netlačte vonkajší kryt ihly smerom nadol.
• Poznámka: Počas odkrúcania ihly máte vidieť zväčšujúcu sa medzeru medzi vonkajším

krytom ihly a perom.
Krok 8 Po podaní injekcie• Pevne
nasaďte späť viečko pera na pero.
• V čase medzi injekciami nechávajte viečko na pere Eladynos.
• Pacientka môže mierne krvácať, to je normálne. Miesto injekcie netrite. Ak sa vyskytne mierne krvácanie, podľa potreby pritlačte vatový tampón alebo gázu na zastavenie krvácania. Pacientka si tiež môže prekryť miesto injekcie malou náplasťou.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIRadius Health (Ireland) Ltd.
13 Classon House
Dundrum Business Park, Dundrum
Dublin D14 W9Y3
Írsko
8. REGISTRAČNÉ ČÍSLOEU/1/22/1706/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Pokyny na použitieNepodávajte injekciu lieku Eladynos, kým vy alebo váš opatrovateľ neabsolvujete školenie od lekára, zdravotnej sestry alebo lekárnika o tom, ako používať pero Eladynos.
NEZAČÍNAJTE podávanie, kým si dôkladne neprečítate písomnú informáciu a tieto pokyny na použitie priložené v škatuli lieku Eladynos. Pri používaní pera Eladynos vždy dôkladne dodržiavajte tieto pokyny.
Ak máte akékoľvek otázky ohľadne používania pera Eladynos, kontaktujte svojho lekára, zdravotnú
sestru alebo lekárnika.
Dôležité informácie pred použitím pera Eladynos• Nezdieľajte ihly s inými osobami. Môžete prenášať závažnú infekciu. Nikdy nezdieľajte vaše pero
Eladynos, ani keď sa vymenila ihla.
• Na každú injekciu použite novú ihlu.
Pomôcky, ktoré budete potrebovať pre každú injekciu pomocou pera Eladynos• 1 ihla
Ihly nie sú dodávané s perom Eladynos. Správne ihly na používanie s perom Eladynos sú 8 mm ihly 31G.
• 1 alkoholový tampón
• 1 vatový tampón alebo gáza
• 1 nádoba na likvidáciu ostrých predmetov na ihly a perá Eladynos. Informácie o likvidácii nájdete v časti 5 písomnej informácie.
Č
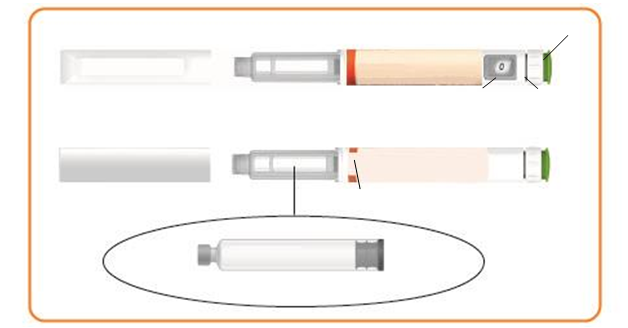
asti pera Eladynos
Zelený injekčný gombík
Viečko pera Držiak liekovej
náplne
Okienko
zobrazujúce dávku
Dávkovací gombík
Lot/EXP
Septum Piest
Lieková náplň
Časti ihly (nedodáva sa s perom) na použitie s peromOchranný papier

Ihla
Vonkajší kryt ihly
Vnútorný kryt ihly
Vnútorná časť ihly
 Podanie injekcie lieku Eladynos
K
rok 1 Skontrolujte pero Eladynos
Podanie injekcie lieku Eladynos
K
rok 1 Skontrolujte pero Eladynos
Umyte si ruky.
Skontrolujte označenie pera, aby ste sa uistili, že je to správne pero.
Skontrolujte dátum exspirácie (EXP) na pere, aby ste sa uistili, že dátum exspirácie neuplynul.

EXP
Poznačte si dátum 1. dňa, aby ste zaistili, že pero nebudete používať dlhšie ako 30 za sebou

nasledujúcich dní.
Stiahnite viečko z pera.
 Skontrolujte pero, vrátane liekovej náplne, či nie je poškodené.
Skontrolujte pero, vrátane liekovej náplne, či nie je poškodené.Tekutina má byť číra, bezfarebná a bez častíc, ak nie je, liek nepoužívajte.
V tekutine môžete vidieť malé vzduchové bublinky. To je normálne.
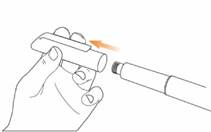
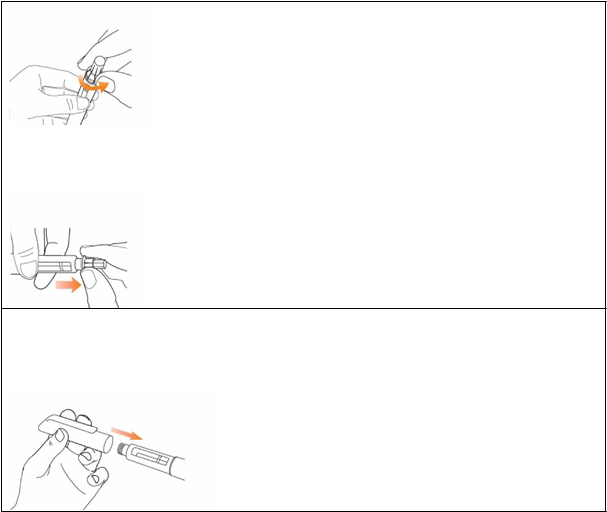
Krok 2 Pripojte ihlu k peru EladynosZ novej ihly odstráňte ochranný papier.
 Zatlačte ihlu s krytom priamo
Zatlačte ihlu s krytom priamo na pero a
zakrúťte ju, až kým sa nezaistí. Uistite sa, že ihla je rovná a pri zavádzaní sa neohla. Ak ihla nie je správne pripevnená, pero nebude fungovať. Ihlu príliš nepriťahujte, pretože ju bude ťažké odstrániť.
V prípade, že sa ihla ohne, pozri nižšie pod „Riešenie problémov“.
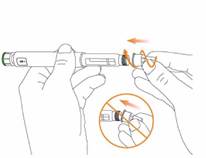
Stiahnite
vonkajší kryt ihly a odložte si ho na použitie po podaní injekcie.

Opatrne stiahnite
vnútorný kryt ihly a zlikvidujte ho.
Krok 3 Iba 1. deň - testovanie pera Eladynos pred prvou injekciouPero obsahuje liek na 30 dní a malé množstvo na testovanie každého pera jedenkrát na potvrdenie
jeho správneho fungovania.
Upozornenie: Ak testujete pero pred každou injekciou, liek v pere sa minie skôr. Preto s každým
perom
vykonajte krok 3 iba v 1. deň pred prvou injekciou.
Od 2. dňa do 30. dňa pero znovu netestujte, prejdite priamo ku kroku 4 na nastavenie dávky na injekciu.
Držte pero ako to je zobrazené, otočte dávkovacím gombíkom na pere smerom od seba, až kým sa
nezastaví.
Na okienku zobrazujúcom dávku
uvidíte číslo „•80“.
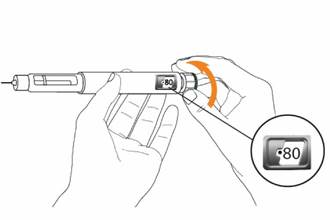
Držte pero s ihlou smerujúcou nahor.

Stlačte zelený injekčný gombík až na doraz.
Máte vidieť tekutinu, ako kvapku alebo prúd, vytekajúcu zo špičky ihly.

Na okienku zobrazujúcom dávku máte vidieť
číslo „●0“.
Poznámka: Ak zo špičky ihly nevytečie žiadna tekutina, pozri časť „Riešenie problémov“.
 Krok 4 Nastavte dávku na pere Eladynos
Krok 4 Nastavte dávku na pere EladynosOtočte bielym gombíkom na pere smerom od seba, až kým sa gombík nezastaví a
na okienkuzobrazujúcom dávku sa nezobrazí číslo „•80“. Pero je teraz pripravené na injekciu.
Poznámka: V prípade, že nemôžete nastaviť pero na „●80“, pozrite nižšie „Riešenie problémov“.
 K
rok 5 Zvoľte a očistite miesto injekcie
K
rok 5 Zvoľte a očistite miesto injekcie
Injekcie sa majú podávať do spodnej časti brucha, ako je zobrazené sivo tieňovanou oblasťou.
Vyhnite sa oblasti 5 cm okolo pupku.
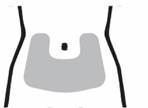
Zvoľte každý deň iné miesto injekcie na bruchu. Injekciu podávajte len do zdravej kože. Injekciu nepodávajte do oblastí, v ktorých je koža citlivá, s podliatinou, červená, kde sa koža olupuje alebo je stvrdnutá. Vyhnite sa oblastiam s jazvami alebo striami.
Utrite miesto injekcie alkoholovým tampónom a nechajte ho uschnúť.
Miesta injekcie sa po očistení už nedotýkajte, nesušte ho prúdom vzduchu ani naň nefúkajte.
Poznámka: Váš lekár, zdravotná sestra alebo lekárnik vám môžu odporučiť, aby ste stisli kožu na mieste, kde sa má podať injekcia.
Potom, ako sa ihla vpichne do kože, sa stisnutie môže uvoľniť.
Krok 6 Podanie injekcie perom EladynosVpichnite ihlu priamo do kože.
 Stlačte a DRŽTE zelený gombík, až
Stlačte a DRŽTE zelený gombík, až kým sa nedokončia
VŠETKY body uvedené nižšie
• zobrazí sa číslo „●0“
• držte 10 sekúnd na podanie celej dávky
• vytiahnite pero z kože
a POTOM pusťte gombík.
Zelený gombík nestláčajte, ak nie je pripojená ihla.

Poznámka: Po vpichnutí perom nehýbte. V prípade, že sa zelený gombík nedá stlačiť alebo sa zastaví pred „●0“, pozrite nižšie „Riešenie problémov“.
Pomaly vytiahnite pero z miesta injekcie vytiahnutím ihly pera priamo smerom von.
Môžete mierne krvácať, je to normálne. Miesto injekcie netrite. Ak sa vyskytne mierne krvácanie, podľa potreby pritlačte na miesto injekcie vatový tampón alebo gázu. Miesto si tiež môžete prekryť malou náplasťou.
Krok 7 Odstráňte ihlu z peraUpozornenie: Na zabránenie poraneniu pichnutím dôkladne dodržiavajte tento krok.
Opatrne nasaďte
vonkajší kryt ihly späť na ihlu. Potom opatrne stlačte vonkajší kryt ihly, až kým
nezapadne na miesto a nezaistí sa.
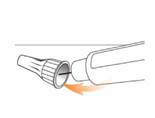 Odkrúťte ihlu s krytom
Odkrúťte ihlu s krytom. Na odkrútenie ihly s krytom stisnite spodok krytu oproti ihle a otočte ho
8 alebo viackrát predtým, ako ho jemne stiahnete, až kým sa ihla s krytom neuvoľní.
Poznámka: Počas odkrúcania ihly netlačte vonkajší kryt ihly smerom nadol.
Poznámka: Počas odkrúcania ihly máte vidieť zväčšujúcu sa medzeru medzi vonkajším krytom ihly
a perom.
Krok 8 Po podaní injekciePevne
nasaďte späť viečko pera na pero Eladynos. V čase medzi injekciami nechávajte viečko na pere.
Riešenie problémovČo mám urobiť, ak sa ihla ohla?• Opatrne odstráňte ohnutú ihlu a na pripojenie novej ihly k peru postupujte podľa kroku 2. Ihla pera má viditeľnú časť, ktorá sa vpichne do kože a skrytú vnútornú časť ihly, ktorá je zasunutá do septa pera.
• Skontrolujte časti ihly pera, pričom venujte osobitnú pozornosť vnútornej časti ihly. Viditeľná časť ihly môže vyzerať rovná, ale vnútorná časť sa mohla pri pripájaní ihly k peru ohnúť.
• Zaistite, aby ste pri pripájaní k peru celú ihlu pera držali rovno na zabránenie ohnutiu vnútornej časti ihly.
Čo mám urobiť, ak zo špičky ihly pri testovaní pera v 1. deň nevytečie žiadna tekutina?• Ak nevidíte vytekať tekutinu z ihly, zostavenie pera nie je kompletné. Ihla môže byť zablokovaná,
ohnutá alebo nesprávne pripojená.
• Na pripojenie novej ihly k peru postupujte podľa kroku 2 a zopakujte krok 3 „Testovanie pera
Eladynos pred prvou injekciou“.
• Ak stále neuvidíte kvapku tekutiny, kontaktujte lekárnika, zdravotnú sestru alebo lekára.
Čo mám urobiť, ak nemôžem otočiť bielym dávkovacím gombíkom na nastavenie pera Eladynos na
„●80“?
• V pere nie je dostatok lieku na podanie celej dávky. Budete potrebovať nové pero.
Čo mám urobiť, ak sa zelený injekčný gombík ťažko stláča?
• V prípade, že sa zelený injekčný gombík nedá stlačiť alebo sa zastaví pred „●0“ na okienku zobrazujúcom dávku, testovanie nového pera nie je kompletné. Ihla môže byť zablokovaná alebo nesprávne pripojená.
• Na pripojenie novej ihly k peru postupujte podľa kroku 2.
• V prípade, že sa zelený injekčný gombík naďalej nedá stlačiť alebo sa zastaví pred „●0“ na okienku
zobrazujúcom dávku, kontaktujte lekárnika, zdravotnú sestru alebo lekára.