nne. U pediatrických pacientov s CML-CP s nehematologickými nežiaducimi reakciami sa má postupovať podľa odporúčaní na zníženie dávky pre hematologické nežiaduce reakcie, ktoré sú opísané vyššie. U pediatrických pacientov s ALL s Ph+ s nehematologickými nežiaducimi reakciami sa má v prípade potreby znížiť dávka o jednu úroveň podľa odporúčaní na zníženie dávky pre hematologické nežiaduce reakcie, ktoré sú opísané vyššie.
Pleurálny výpotokAk je diagnostikovaný pleurálny výpotok, liečba dasatinibom sa má prerušiť až kým bude pacient vyšetrený, asymptomatický alebo sa vráti k pôvodným hodnotám. Ak sa udalosť nezlepší približne počas jedného týždňa, má sa zvážiť postup s použitím diuretík alebo kortikosteroidov alebo oboch súčasne (pozri časti 4.4 a 4.8). Po vymiznutí prvej udalosti sa má zvážiť opätovné začatie liečby dasatinibom v dávke na rovnakej úrovni. Po vymiznutí nasledujúcej udalosti sa má opätovne začať liečba dasatinibom v zníženej dávke o jednu úroveň. Po vymiznutí závažnej udalosti (3. alebo 4. stupňa) môže liečba, ak je to vhodné, pokračovať so zníženou dávkou v závislosti od začiatočnej závažnosti nežiaducej reakcie.
Zníženie dávky pri súbežnom používaní silných inhibítorov CYP3A4Súbežnému používaniu silných inhibítorov CYP3A4 a grapefruitového džúsu s Dasatinibom Zentiva je potrebné sa vyhnúť (pozri časť 4.5). Ak je to možné, má sa vybrať alternatívna súbežná liečba bez alebo s minimálnym potenciálom enzýmovej inhibície. Ak sa Dasatinib Zentiva musí podávať so silným inhibítorom CYP3A4, zvážte zníženie dávky na:
• 40 mg denne u pacientov užívajúcich tabletu dasatinibu 140 mg denne.
• 20 mg denne u pacientov užívajúcich tabletu Dasatinibu Zentiva 100 mg denne.
• 20 mg denne u pacientov užívajúcich tabletu Dasatinibu Zentiva 70 mg denne.
U pacientov užívajúcich 60 mg alebo 40 mg dasatinibu denne zvážte prerušenie podávania dasatinibu pokým sa neukončí liečba inhibítorom CYP3A4 alebo prestavenie na nižšiu dávku s liekovou formou prášok na perorálnu suspenziu. Pred opätovným začatím podávania Dasatinibu Zentiva je potrebné po ukončení podávania inhibítora obdobie na elimináciu liečiva („washout“) približne 1 týždeň.
Predpokladá sa, že tieto znížené dávky dasatinibu upravia plochu pod krivkou (AUC, area under the curve) na rozsah pozorovaný bez inhibítorov CYP3A4; klinické údaje s týmito úpravami dávok u pacientov, ktorí užívajú silné inhibítory CYP3A4, však nie sú dostupné. Ak po znížení dávky dasatinib nie je tolerovaný, buď ukončite liečbu silným inhibítorom CYP3A4, alebo prerušte liečbu dasatinibom pokým sa neukončí liečba inhibítorom. Pred zvýšením dávky dasatinibu je potrebné po ukončení podávania inhibítora obdobie na elimináciu liečiva („washout“) približne 1 týždeň.
Osobitné populácieStarší ľudiaU týchto pacientov sa nepozorovali žiadne klinicky významné farmakokinetické rozdiely súvisiace s vekom. U starších ľudí nie je potrebné osobitné odporúčanie dávkovania.
Porucha funkcie pečenePacienti s ľahkou, stredne ťažkou alebo ťažkou poruchou funkcie pečene môžu dostávať odporúčanú začiatočnú dávku. Dasatinib Zentiva sa však musí používať s opatrnosťou u pacientov s poruchou funkcie pečene (pozri časť 5.2).
Porucha funkcie obličiekNeuskutočnili sa žiadne klinické štúdie s dasatinibom u pacientov so zníženou funkciou obličiek (zo štúdie u pacientov s novodiagnostikovanou chronickou fázou CML boli vylúčení pacienti s koncentráciou kreatinínu v sére > 3-násobok hornej hranice normálneho rozpätia a zo štúdií u pacientov s chronickou fázou CML s rezistenciou alebo intoleranciou na predošlú liečbu imatinibom boli vylúčení pacienti s koncentráciou kreatinínu v sére > 1,5-násobok hornej hranice normálneho rozpätia). Vzhľadom na to, že renálny klírens dasatinibu a jeho metabolitov je < 4 %, u pacientov s renálnou insuficienciou sa neočakáva pokles celkového telesného klírensu.
Spôsob podávaniaDasatinib Zentiva sa musí podávať perorálne.
Filmom obalené tablety sa nesmú drviť, deliť ani žuvať, aby sa zachovala konzistencia dávkovania a minimalizovalo sa riziko dermálnej expozície, musia sa prehltnúť vcelku. Filmom obalené tablety sa nesmú rozpúšťať, pretože expozícia u pacientov užívajúcich rozpustenú tabletu je nižšia ako u tých, ktorí prehĺtajú celú tabletu. Dasatinib vo forme prášku na perorálnu suspenziu je tiež dostupný pre pediatrických pacientov s Ph+ CML-CP a ALL s Ph+ a dospelých pacientov s CML-CP, ktorí nevedia tablety prehĺtať.
Dasatinib Zentiva sa môže užívať s jedlom alebo bez jedla a má sa užívať pravidelne buď ráno alebo večer. Dasatinib Zentiva sa nesmie užívať s grapefruitom alebo grapefruitovým džúsom (pozri časť 4.5).
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Klinicky významné interakcieDasatinib je substrátom a inhibítorom cytochrómu P450 (CYP) 3A4. Z tohto dôvodu existuje možnosť interakcie s inými súbežne podávanými liekmi, ktoré sú metabolizované prevažne prostredníctvom CYP3A4 alebo ktoré modulujú aktivitu CYP3A4 (pozri časť 4.5).
Súbežné užívanie dasatinibu a liekov alebo látok, ktoré silne inhibujú CYP3A4 (napr. ketokonazol, itrakonazol, erytromycín, klaritromycín, ritonavir, telitromycín, grapefruitový džús), môže zvýšiť expozíciu dasatinibu. Z tohto dôvodu sa u pacientov liečených dasatinibom neodporúča súbežné podávanie silného inhibítora CYP3A4 (pozri časť 4.5).
Súbežné užívanie dasatinibu a liekov, ktoré indukujú CYP3A4 (napr. dexametazón, fenytoín, karbamazepín, rifampicín, fenobarbital alebo rastlinné lieky obsahujúce
Hypericum perforatum, známy aj ako ľubovník bodkovaný), môže značne znížiť expozíciu dasatinibu a tým prípadne zvýšiť riziko zlyhania liečby. Preto sa u pacientov liečených dasatinibom má zvoliť súbežné podávanie alternatívnych liekov s menším potenciálom pre indukciu CYP3A4 (pozri časť 4.5).
Súbežné užívanie dasatinibu a substrátu CYP3A4 môže zvýšiť expozíciu substrátu CYP3A4. Z tohto dôvodu je potrebná opatrnosť, ak sa dasatinib podáva súbežne so substrátmi CYP3A4 s úzkym terapeutickým indexom, ako sú astemizol, terfenadín, cisaprid, pimozid, chinidín, bepridil alebo námeľové alkaloidy (ergotamín, dihydroergotamín) (pozri časť 4.5).
Súbežné užívanie dasatinibu a antagonistu histamínových receptorov (H
2) (napr. famotidínu), inhibítora protónovej pumpy (napr. omeprazolu) alebo hydroxidu hlinitého/hydroxidu horečnatého môže znížiť expozíciu dasatinibu. Preto sa H
2-antagonisty a inhibítory protónovej pumpy neodporúčajú a lieky s obsahom hydroxidu hlinitého/hydroxidu horečnatého sa majú podať 2 hodiny pred alebo 2 hodiny po podaní dasatinibu (pozri časť 4.5).
Osobitné populácieNa základe záverov farmakokinetickej štúdie s jednorazovou dávkou pacienti s ľahkou, stredne ťažkou alebo ťažkou poruchou funkcie pečene môžu dostávať odporúčanú začiatočnú dávku (pozri časť 5.2). Z dôvodu obmedzení klinickej štúdie sa odporúča opatrnosť pri podávaní dasatinibu pacientom s poruchou funkcie pečene.
Významné nežiaduce reakcieMyelosupresiaLiečba dasatinibom sa spája s anémiou, neutropéniou a trombocytopéniou. Ich výskyt je skorší a častejší u pacientov v pokročilej fáze chronickej myeloidnej leukémie (CML) alebo s ALL s Ph+ ako u pacientov v chronickej fáze CML. U dospelých pacientov s pokročilou fázou CML alebo s ALL s Ph+ liečených dasatinibom v monoterapii sa kontrola kompletného krvného obrazu (CBC, complete blood counts) musí vykonávať raz za týždeň počas prvých 2 mesiacov a potom raz za mesiac, alebo ak je to klinicky indikované. U dospelých a pediatrických pacientov s chronickou fázou CML sa kontrola kompletného krvného obrazu musí vykonávať raz za 2 týždne počas 12 týždňov, potom raz za 3 mesiace, alebo ak je to klinicky indikované. Myelosupresia je obvykle reverzibilná a zvyčajne bola zvládnutá dočasným prerušením liečby dasatinibom alebo redukciou dávky. U pediatrických pacientov s ALL s Ph+ liečených dasatinibom v kombinácii s chemoterapiou sa má kontrola CBC vykonať pred začatím každého bloku chemoterapie a ak je to klinicky indikované. Počas konsolidačných blokov chemoterapie sa má kontrola CBC vykonať každé 2 dni až do zotavenia (pozri časti 4.2 a 4.8).
KrvácanieU pacientov s chronickou fázou CML (n = 548) malo 5 pacientov (1 %) užívajúcich dasatinib krvácanie 3. alebo 4. stupňa. V klinických štúdiách s pacientmi s pokročilou fázou CML, ktorí užívali odporúčanú dávku dasatinibu (n = 304), sa u 1 % pacientov vyskytlo ťažké krvácanie do centrálneho nervového systému (CNS). Jeden prípad bol smrteľný a spájal sa s trombocytopéniou 4. stupňa podľa Všeobecných kritérií toxicity (Common Toxicity Criteria, CTC). Gastrointestinálne krvácanie 3. alebo 4. stupňa sa vyskytlo u 6 % pacientov s pokročilou fázou CML a obvykle si vyžadovalo prerušenie liečby a podanie transfúzií. Krvácanie iného druhu 3. alebo 4. stupňa sa vyskytlo u 2 % pacientov s pokročilou fázou CML. Väčšina nežiaducich reakcií spojených s krvácaním u týchto pacientov zvyčajne súvisela s trombocytopéniou 3. alebo 4. stupňa (pozri časť 4.8). Okrem toho naznačujú hodnotenia krvných doštičiek
in vitro a
in vivo, že liečba dasatinibom reverzibilne ovplyvňuje aktiváciu krvných doštičiek.
Opatrnosť je potrebná, ak sa u pacientov vyžaduje užívanie liekov, ktoré potláčajú funkciu krvných doštičiek, alebo antikoagulancií.
Retencia tekutínPoužívanie dasatinibu sa spája s retenciou tekutín. V klinickej štúdii fázy III u pacientov s novodiagnostikovanou chronickou fázou CML bola hlásená retencia tekutín 3. alebo 4. stupňa u 13 pacientov (5 %) v skupine liečenej dasatinibom a u 2 pacientov (1 %) v skupine liečenej imatinibom po minimálne 60 mesiacoch následného sledovania (pozri časť 4.8). Zo všetkých pacientov s chronickou fázou CML liečených dasatinibom sa u 32 pacientov (6 %), ktorí dostávali dasatinib v odporúčanej dávke (n = 548), vyskytla závažná retencia tekutín. V klinických štúdiách s pacientmi s pokročilou fázou CML alebo ALL s Ph+, ktorí dostávali dasatinib v odporúčanej dávke (n = 304), bola hlásená retencia tekutín 3. alebo 4. stupňa u 8 % pacientov, zahŕňajúca pleurálny výpotok 3. alebo 4. stupňa hlásený u 7 % pacientov a perikardiálny výpotok 3. alebo 4. stupňa hlásený u 1 % pacientov. U týchto pacientov boli hlásené pľúcny edém 3. alebo 4. stupňa u 1 % pacientov a pľúcna hypertenzia 3. alebo 4. stupňa u 1 % pacientov.
Pacienti, u ktorých vzniknú príznaky svedčiace o pleurálnom výpotku, ako je dyspnoe alebo suchý kašeľ, musia byť vyšetrení pomocou röntgenu hrudníka. Pleurálny výpotok 3. alebo 4. stupňa môže vyžadovať torakocentézu a oxygenoterapiu. Nežiaduce reakcie retencie tekutín boli zvyčajne zvládnuté pomocou podporných opatrení zahŕňajúcich podávanie diuretík a krátkodobého podávania steroidov (pozri časti 4.2 a 4.8). U pacientov vo veku 65 rokov a starších je viac pravdepodobný výskyt pleurálneho výpotku, dyspnoe, kašľa, perikardiálneho výpotku a kongestívneho zlyhania srdca než u mladších pacientov, a preto majú byť starostlivo sledovaní.
Pľúcna arteriálna hypertenzia (PAH)PAH (prekapilárna pľúcna arteriálna hypertenzia potvrdená pravostrannou katetrizáciou srdca) bola hlásená v súvislosti s liečbou dasatinibom (pozri časť 4.8). V týchto prípadoch bola hlásená PAH po začatí liečby dasatinibom, a to aj po viac ako jednom roku liečby.
Pacienti majú byť vyšetrení na prejavy a príznaky základného kardiopulmonálneho ochorenia pred začatím liečby dasatinibom. Na začiatku liečby sa má vykonať echokardiografia u každého pacienta s prítomnými príznakmi srdcového ochorenia a má sa zvážiť u pacientov s rizikovými faktormi srdcového alebo pľúcneho ochorenia. Pacienti, u ktorých sa po začatí liečby vyvinie dyspnoe a únava, majú byť vyšetrení na vylúčenie bežných etiológií zahŕňajúcich pleurálny výpotok, pľúcny edém, anémiu alebo pľúcnu infiltráciu. V súlade s odporúčaniami pre zvládanie nehematologických nežiaducich reakcií (pozri časť 4.2) sa má dávka dasatinibu znížiť alebo sa má liečba prerušiť počas tohto vyšetrenia. Ak sa nenájde vysvetlenie alebo ak po znížení dávky alebo prerušení liečby nedôjde k žiadnemu zlepšeniu, má sa uvažovať o diagnóze PAH. Diagnostický prístup sa má riadiť štandardnými postupmi. Ak sa potvrdí PAH, liečba dasatinibom sa má trvale ukončiť.
Monitorovanie sa má vykonávať podľa štandardných postupov. Zlepšenie hemodynamických a klinických parametrov sa pozorovalo u pacientov liečených dasatinibom s PAH po ukončení liečby dasatinibom.
Predĺženie QT intervaluÚdaje
in vitro svedčia o tom, že dasatinib môže predĺžiť repolarizáciu srdcových komôr (QT interval) (pozri časť 5.3). Z 258 pacientov liečených dasatinibom a z 258 pacientov liečených imatinibom s minimálne 60 mesačným následným sledovaním v štúdii fázy III s novodiagnostikovanou chronickou fázou CML mal 1 pacient (< 1 %) v každej skupine hlásený predĺžený QTc ako nežiaducu reakciu. Medián zmien v QTcF oproti východiskovým hodnotám bol 3,0 ms u pacientov liečených dasatinibom v porovnaní s 8,2 ms u pacientov liečených imatinibom. Jeden pacient (< 1 %) v každej skupine mal QTcF > 500 ms. U 865 pacientov s leukémiou liečených dasatinibom v klinických štúdiách fázy II boli priemerné zmeny oproti východiskovým hodnotám QTc intervalu s korekciou podľa metódy Fridericia (QTcF) 4 – 6 ms; horné 95 % intervaly spoľahlivosti pre všetky priemerné zmeny oproti východiskovým hodnotám boli < 7 ms (pozri časť 4.8).
Z 2 182 pacientov s rezistenciou alebo intoleranciou na predošlú liečbu imatinibom, ktorí užívali dasatinib v klinických štúdiách, malo 15 (1 %) predĺženie QTc hlásené ako nežiaduci účinok. Dvadsaťjeden z týchto pacientov (1 %) malo QTcF > 500 ms.
Dasatinib sa musí podávať s opatrnosťou pacientom, u ktorých došlo alebo u ktorých môže dôjsť k predĺženiu QTc. Patria k nim pacienti s hypokaliémiou alebo hypomagneziémiou, pacienti s vrodeným syndrómom dlhého QT, pacienti užívajúci antiarytmiká alebo iné lieky, ktoré vedú k predĺženiu QT, a pacienti liečení vysokými kumulatívnymi dávkami antracyklínu. Hypokaliémia alebo hypomagneziémia sa majú pred podaním dasatinibu upraviť.
Srdcové nežiaduce reakcieDasatinib sa skúmal v randomizovanej klinickej štúdii s 519 pacientmi s novodiagnostikovanou CML v chronickej fáze, ktorá zahŕňala pacientov s predošlými srdcovým ochoreniami. Srdcové nežiaduce reakcie – kongestívne srdcové zlyhanie/srdcová dysfunkcia, perikardiálny výpotok, arytmie, palpitácie, predĺženie QT intervalu a infarkt myokardu (vrátane úmrtia) – boli hlásené u pacientov užívajúcich dasatinib. Srdcové nežiaduce reakcie boli častejšie u pacientov s rizikovými faktormi alebo so srdcovým ochorením v anamnéze. Pacienti s rizikovými faktormi (napr. hypertenzia, hyperlipidémia, diabetes) alebo srdcovým ochorením v anamnéze (napr. predošlá perkutánna koronárna intervencia, dokázané ochorenie koronárnych artérií) majú byť starostlivo sledovaní na klinické prejavy alebo príznaky zodpovedajúce srdcovej dysfunkcii, ako sú bolesť na hrudníku, dýchavičnosť a potenie.
Ak sa tieto klinické prejavy alebo príznaky vyvinú, lekárom sa odporúča prerušiť podávanie dasatinibu a zvážiť potrebu alternatívnej liečby špecifickej pre CML. Po ich vymiznutí má byť pred obnovením liečby dasatinibom vykonané funkčné posúdenie. Dasatinib môže byť znovu podávaný v pôvodnej dávke pri miernych/stredne závažných nežiaducich reakciách (≤ 2. stupeň) a znovu podávaný v redukovanej dávke pri závažných nežiaducich reakciách (≥ 3. stupeň) (pozri časť 4.2). Pacienti pokračujúci v liečbe majú byť pravidelne monitorovaní.
Pacienti s nekontrolovaným alebo závažným kardiovaskulárnym ochorením neboli zaradení do klinických štúdií.
Trombotická mikroangiopatia (TMA)Inhibítory BCR-ABL-tyrozínkinázy sa spájajú so vznikom trombotickej mikroangiopatie (TMA), čo zahŕňa hlásenia jednotlivých prípadov pre dasatinib (pozri časť 4.8). Ak sa u pacienta, ktorý užíva dasatinib, vyskytnú laboratórne alebo klinické nálezy spájané s TMA, liečba dasatinibom sa má prerušiť a má sa vykonať dôkladné vyhodnotenie TMA vrátane aktivity ADAMTS13 a stanovenia protilátok proti ADAMTS13. Ak sú zvýšené protilátky proti ADAMTS13 v kombinácii s nízkou aktivitou ADAMTS13, v liečbe dasatinibom sa nesmie pokračovať.
Reaktivácia hepatitídy BReaktivácia hepatitídy B u pacientov, ktorí sú chronickými prenášačmi tohto vírusu, sa vyskytla v prípade, že títo pacienti užívali inhibítory BCR-ABL-tyrozínkinázy. Niektoré prípady viedli k akútnemu zlyhaniu pečene alebo k fulminantnej hepatitíde, ktorých výsledkom bola transplantácia pečene alebo úmrtie.
Pacienti majú byť vyšetrení na HBV infekciu pred začatím liečby Dasatinibom Zentiva. Pred začatím liečby u pacientov s pozitívnym sérologickým testom na hepatitídu B (vrátane pacientov s aktívnym ochorením) a u pacientov s pozitívnym testom na HBV infekciu počas liečby je potrebná konzultácia s odborníkmi na ochorenia pečene a liečbu hepatitídy B. Prenášači vírusu HBV, ktorí potrebujú liečbu Dasatinibom Zentiva, majú byť pozorne sledovaní na prejavy a príznaky aktívnej HBV infekcie počas celej liečby a niekoľko mesiacov po ukončení liečby (pozri časť 4.8).
Účinky na rast a vývoj u pediatrických pacientovV pediatrických klinických skúšaniach s dasatinibom u pediatrických pacientov s Ph+ CML v chronickej fáze (Ph+ CML-CP) rezistentnými/intolerantnými na imatinib a s predtým neliečenými pediatrickými pacientmi s Ph+ CML-CP po minimálne 2 rokoch liečby boli hlásené nežiaduce udalosti súvisiace s liečbou spojené s rastom kostí a vývojom u 6 (4,6 %) pacientov, jedna z nich bola závažnej intenzity (spomalenie rastu 3. stupňa). Týchto 6 prípadov zahŕňalo prípady oneskorenej fúzie epifýz, osteopénie, spomalenia rastu a gynekomastie (pozri časť 5.1). Tieto výsledky je ťažké interpretovať v kontexte chronických ochorení, ako je CML, a je potrebné dlhodobé následné sledovanie.
V pediatrických skúšaniach s dasatinibom v kombinácii s chemoterapiou boli u novodiagnostikovaných pediatrických pacientov s ALL s Ph+ po maximálne 2 rokoch liečby hlásené nežiaduce udalosti súvisiace s liečbou spojené s rastom kostí a vývojom u 1 (0,6 %) pacienta. Týmto prípadom bola osteopénia 1. stupňa.
Pomocné látkyTento liek obsahuje monohydrát laktózy. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, celkovým deficitom laktázy alebo glukózo-galaktózovou malabsorpciou nesmú užívať tento liek.
Každá filmom obalená tableta obsahuje menej ako 1 mmol (23 mg) sodíka.
4.5 Liekové a iné interakcie
Liečivá, ktoré môžu zvýšiť plazmatické koncentrácie dasatinibuŠtúdie
in vitro poukazujú na to, že dasatinib je substrátom CYP3A4. Súbežné užívanie dasatinibu a liekov alebo látok, ktoré silne inhibujú CYP3A4 (napr. ketokonazol, itrakonazol, erytromycín, klaritromycín, ritonavir, telitromycín, grapefruitový džús), môže zvýšiť expozíciu dasatinibu. Preto sa u pacientov liečených dasatinibom neodporúča systémové podávanie silného inhibítora CYP3A4 (pozri časť 4.2).
V klinicky relevantných koncentráciách sa v priemere 96 % dasatinibu viaže na plazmatické proteíny na základe
in vitro experimentov. Neboli vykonané štúdie hodnotiace interakcie dasatinibu s inými liekmi viažucimi sa na proteíny. Potenciál pre vytesňovanie a jeho klinická dôležitosť nie sú známe.
Liečivá, ktoré môžu znížiť plazmatické koncentrácie dasatinibuKeď sa dasatinib podával po 8 dňoch, kedy sa raz denne večer podával v dávke 600 mg rifampicín, silný induktor CYP3A4, hodnota AUC dasatinibu sa znížila o 82 %. Iné lieky, ktoré indukujú aktivitu CYP3A4 (napr. dexametazón, fenytoín, karbamazepín, fenobarbital alebo rastlinné lieky obsahujúce
Hypericum perforatum, známy aj ako ľubovník bodkovaný), môžu tiež zvýšiť metabolizmus a znížiť plazmatické koncentrácie dasatinibu. Z tohto dôvodu sa neodporúča súbežné užívanie silných induktorov CYP3A4 s dasatinibom. U pacientov, u ktorých je indikovaný rifampicín alebo iné induktory CYP3A4, sa majú použiť alternatívne lieky s menším potenciálom pre enzýmovú indukciu. Súbežné podávanie dexametazónu, slabého induktora CYP3A4, s dasatinibom je dovolené; predpokladá sa, že AUC dasatinibu sa pri súbežnom podávaní s dexametazónom zníži približne o 25 %, čo pravdepodobne nie je klinicky významné.
Antagonisty H2-histamínového receptora a inhibítory protónovej pumpyDlhodobá supresia sekrécie žalúdočnej kyseliny spôsobená H
2-antagonistami alebo inhibítormi protónovej pumpy (napr. famotidínom a omeprazolom) pravdepodobne zníži expozíciu dasatinibu.V štúdii jednorazovej dávky u zdravých jedincov podanie famotidínu 10 hodín pred jednorazovou dávkou dasatinibu znížilo expozíciu dasatinibu o 61 %. V štúdii so 14 zdravými jedincami sa pri podaní jednorazovej 100 mg dávky dasatinibu 22 hodín po štyroch dňoch podávania 40 mg omeprazolu v rovnovážnom stave znížila hodnota AUC dasatinibu o 43 % a hodnota C
max dasatinibu o 42 %. U pacientov liečených dasatinibom sa má namiesto H
2-antagonistov alebo inhibítorov protónovej pumpy zvážiť použitie antacíd (pozri časť 4.4).
AntacidáPredklinické údaje potvrdzujú, že rozpustnosť dasatinibu závisí od pH. U zdravých jedincov súbežné užívanie antacíd obsahujúcich hydroxid hlinitý/hydroxid horečnatý s dasatinibom znížilo hodnotu AUC jednorazovej dávky dasatinibu o 55 % a C
max o 58 %. Keď však boli antacidá podané 2 hodiny pred jednorazovou dávkou dasatinibu, nepozorovali sa žiadne významné zmeny v koncentrácii ani expozícii dasatinibu. Z tohto dôvodu sa antacidá môžu podať do 2 hodín pred alebo 2 hodiny po podaní dasatinibu (pozri časť 4.4).
Liečivá, ktorých plazmatické koncentrácie môže dasatinib ovplyvniťSúbežné užívanie dasatinibu a substrátu CYP3A4 môže zvýšiť expozíciu substrátu CYP3A4. V štúdii so zdravými jedincami jednorazová 100 mg dávka dasatinibu zvýšila hodnotu AUC simvastatínu, známeho substrátu CYP3A4, o 20 % a hodnotu Cmax simvastatínu o 37 %. Nie je možné vylúčiť, že účinok je väčší po viacerých dávkach dasatinibu. Z tohto dôvodu sa substráty CYP3A4, o ktorých je známe, že majú úzky terapeutický index (napr. astemizol, terfenadín, cisaprid, pimozid, chinidín, bepridil alebo námeľové alkaloidy [ergotamín, dihydroergotamín]), majú podávať s opatrnosťou u pacientov liečených dasatinibom (pozri časť 4.4).
In vitro údaje poukazujú na potenciálne riziko interakcie s CYP2C8 substrátmi, ako sú glitazóny.
Pediatrická populáciaInterakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Ženy vo fertilnom veku/antikoncepcia u mužov a žienSexuálne aktívni muži aj ženy vo fertilnom veku majú počas liečby používať účinnú metódu antikoncepcie.
GraviditaNa základe skúseností u ľudí sa predpokladá, že dasatinib spôsobuje vrodené malformácie vrátane defektov neurálnej trubice a má škodlivé farmakologické účinky na plod, ak sa podáva počas gravidity. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3).
Dasatinib Zentiva sa nemá používať počas gravidity, pokiaľ si klinický stav ženy nevyžaduje liečbu dasatinibom. Ak sa Dasatinib Zentiva použije počas gravidity, pacientka musí byť informovaná o možnom riziku pre plod.
DojčenieExistujú nedostatočné/obmedzené informácie o vylučovaní dasatinibu do materského mlieka u ľudí alebo zvierat. Fyzikálno-chemické a dostupné farmakodynamické/toxikologické údaje o dasatinibe poukazujú na vylučovanie do materského mlieka a nie je možné vylúčiť riziko pre dojčené dieťa.
Počas liečby Dasatinibom Zentiva sa musí dojčenie prerušiť.
FertilitaV štúdiách na zvieratách nebola fertilita samcov a samíc potkanov ovplyvnená liečbou dasatinibom (pozri časť 5.3). Lekári a iní zdravotnícki pracovníci majú prekonzultovať s pacientmi mužského pohlavia primeraného veku možné účinky Dasatinibu Zentiva na fertilitu a táto konzultácia môže zahŕňať zváženie konzervácie spermií.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Dasatinib Zentiva má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti musia byť informovaní, že počas liečby dasatinibom môžu mať nežiaduce reakcie, ako sú závrat alebo rozmazané videnie. Z tohto dôvodu sa im pri vedení vozidla alebo obsluhe strojov má odporučiť opatrnosť.
4.8 Nežiaduce účinky
Prehľad bezpečnostného profiluÚdaje opísané nižšie vyjadrujú expozíciu dasatinibu v monoterapii pri všetkých dávkach testovaných v klinických štúdiách (N = 2 900) zahŕňajúcich 324 dospelých pacientov s novodiagnostikovanou chronickou fázou CML, 2 388 dospelých pacientov rezistentných alebo intolerantných na imatinib s chronickou alebo s pokročilou fázou CML alebo Ph+ ALL a 188 pediatrických pacientov. U 2 712 dospelých pacientov buď s chronickou fázou CML, pokročilou fázou CML alebo Ph+ ALL bol medián trvania liečby 19,2 mesiaca (rozsah 0 až 93,2 mesiaca).
V randomizovanom klinickom skúšaní s pacientmi s novodiagnostikovanou chronickou fázou CML bol medián trvania liečby približne 60 mesiacov. Medián trvania liečby u 1 618 dospelých pacientov s chronickou fázou CML bol 29 mesiacov (rozsah 0 až 92,9 mesiaca). Medián trvania liečby u 1 094 dospelých pacientov s pokročilou fázou CML alebo Ph+ ALL bol 6,2 mesiaca (rozsah 0 až 93,2 mesiaca). U 188 pacientov v pediatrických štúdiách bol medián trvania liečby 26,3 mesiaca (rozsah 0 až 99,6 mesiaca). V podskupine 130 pediatrických pacientov s chronickou fázou CML liečených dasatinibom bol medián trvania liečby 42,3 mesiaca (rozsah 0,1 až 99,6 mesiaca).
Väčšina pacientov liečených dasatinibom mala v určitom čase nežiaduce reakcie. V celkovej populácii 2 712 dospelých jedincov liečených dasatinibom malo 520 (19 %) nežiaduce reakcie, ktoré mali za následok prerušenie liečby.
Celkový bezpečnostný profil dasatinibu v pediatrickej populácii s Ph+ CML-CP bol podobný tomu, ktorý je v dospelej populácii, bez ohľadu na liekovú formu s výnimkou toho, že v pediatrickej populácii nebol hlásený perikardiány výpotok, pleurálny výpotok, pľúcny edém alebo pľúcna hypertenzia. Zo 130 pediatrických jedincov s CML-CP liečených dasatinibom sa u 2 (1,5 %) vyskytli nežiaduce reakcie, ktoré mali za následok ukončenie liečby.
Tabuľkový zoznam nežiaducich reakciíNasledujúce nežiaduce reakcie, s výnimkou laboratórnych anomálií, boli hlásené u pacientov liečených dasatinibom v monoterapii v klinických štúdiách a po uvedení lieku na trh (tabuľka 5). Tieto reakcie sú vymenované podľa tried orgánových systémov a podľa frekvencie. Frekvencie sú definované takto: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); neznáme (nie je možné stanoviť z dostupných údajov po uvedení lieku na trh).
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
Tabuľka 5: Tabuľkový súhrn nežiaducich reakciíInfekcie a nákazy
|
Veľmi časté
| infekcia (vrátane bakteriálnej, vírusovej, plesňovej, nešpecifickej)
|
Časté
| pneumónia (vrátane bakteriálnej, vírusovej a plesňovej), infekcia/zápal horných dýchacích ciest, herpetická vírusová infekcia (vrátane cytomegalovírusu - CMV), infekčná enterokolitída, sepsa (vrátane menej častých prípadov s fatálnymi následkami)
|
Neznáme
| reaktivácia hepatitídy B
|
Poruchy krvi a lymfatického systému
|
Veľmi časté
| myelosupresia (vrátane anémie, neutropénie, trombocytopénie)
|
Časté
| febrilná neutropénia
|
Menej časté
| lymfadenopatia, lymfopénia
|
Zriedkavé
| aplázia červených krviniek
|
Poruchy imunitného systému
|
Menej časté
| hypersenzitivita (vrátane erythema nodosum)
|
Zriedkavé
| anafylaktický šok
|
Poruchy endokrinného systému
|
Menej časté
| hypotyreoidizmus
|
Zriedkavé
| hypertyreoidizmus, tyreoiditída
|
Poruchy metabolizmu a výživy
|
Časté
| poruchy chuti do jedlaa, hyperurikémia
|
Menej časté
| syndróm z rozpadu nádoru, dehydratácia, hypoalbuminémia, hypercholesterolémia
|
Zriedkavé
| diabetes mellitus
|
Psychické poruchy
|
Časté
| depresia, insomnia
|
Menej časté
| úzkosť, stav zmätenosti, afektívna labilita, zníženie libida
|
Poruchy nervového systému
|
Veľmi časté
| bolesť hlavy
|
Časté
| neuropatia (vrátane periférnej neuropatie), závrat, porucha chuti, spavosť
|
Menej časté
| krvácanie do CNS*b, synkopa, tremor, amnézia, porucha rovnováhy
|
Zriedkavé
| cerebrovaskulárna príhoda, prechodný ischemický záchvat, kŕč, očná neuritída, paralýza VII. nervu, demencia, ataxia
|
Poruchy oka
|
Časté
| poruchy videnia (vrátane zrakovej poruchy, rozmazaného videnia a zníženej zrakovej ostrosti), suchosť očí
|
Menej časté
| porucha zraku, konjunktivitída, fotofóbia, zvýšené slzenie
|
Poruchy ucha a labyrintu
|
Časté
| tinitus
|
Menej časté
| strata sluchu, vertigo
|
Poruchy srdca a srdcovej činnosti
|
Časté
| kongestívne srdcové zlyhanie/srdcová dysfunkcia*c, perikardiálny výpotok*, arytmia (vrátane tachykardie), palpitácie
|
Menej časté
| infarkt myokardu (vrátane fatálneho následku)*, QT predĺženie na elektrokardiograme*, perikarditída, ventrikulárna arytmia (vrátane ventrikulárnej tachykardie), angina pectoris, kardiomegália, nezvyčajná T vlna na elektrokardiograme, zvýšený troponín
|
Zriedkavé
| cor pulmonale, myokarditída, akútny koronárny syndróm, zastavenie srdca, predĺženie PR na elektrokardiograme, ischemická choroba srdca, pleuroperikarditída
pleuroperikarditída
|
Neznáme
| fibrilácia predsiení/flutter predsiení
|
Poruchy ciev
|
Veľmi časté
| hemorágia*d
|
Časté
| hypertenzia, začervenanie
|
Menej časté
| hypotenzia, tromboflebitída, trombóza
|
Zriedkavé
| hlboká žilová trombóza, embólia, livedo reticularis
|
Neznáme
| trombotická mikroangiopatia
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Veľmi časté
| pleurálny výpotok*, dyspnoe
|
Časté
| pľúcny edém*, pľúcna hypertenzia*, pľúcna infiltrácia, pneumonitída, kašeľ
|
Menej časté
| pľúcna arteriálna hypertenzia, bronchospazmus, astma
|
Zriedkavé
| pľúcna embólia, syndróm akútnej respiračnej tiesne
|
Neznáme
| intersticiálne ochorenie pľúc
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté
| hnačka, vracanie, nauzea, abdominálna bolesť
|
Časté
| gastrointestinálne krvácanie*, kolitída (vrátane neutropenickej kolitídy), gastritída, zápal sliznice (vrátane mukozitídy/stomatitídy), dyspepsia, abdominálna distenzia, zápcha, porucha mäkkého tkaniva v ústach
|
Menej časté
| pankreatitída (vrátane akútnej pankreatitídy), vred v hornej časti gastrointestinálneho traktu, ezofagitída, ascites*, análna fisúra, dysfágia, gastroezofágové refluxné ochorenie
|
Zriedkavé
| gastroenteropatia zo straty proteínov, ileus, análna fistula
|
Neznáme
| fatálna gastrointestinálna hemorágia*
|
Poruchy pečene a žlčových ciest
|
Menej časté
| hepatitída, cholecystitída, cholestáza
|
Poruchy kože a podkožného tkaniva
|
Veľmi časté
| kožná vyrážkae
|
Časté
| alopécia, dermatitída (vrátane ekzému), pruritus, akné, suchá koža, urtikária, hyperhidróza
hyperhidróza
|
Menej časté
| neutrofilná dermatóza, fotosenzitivita, porucha pigmentácie, panikulitída, kožný vred, bulózne ochorenia, porucha nechtov, syndróm palmárno-plantárnej erytrodyzestézie, porucha vlasov
|
Zriedkavé
| leukocytoklastická vaskulitída, fibróza kože
|
Neznáme
| Stevensov-Johnsonov syndrómf
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
Veľmi časté
| muskuloskeletálna bolesťg
|
Časté
| artralgia, myalgia, svalová slabosť, muskuloskeletálna stuhnutosť, svalový kŕč
|
Menej časté
| rabdomyolýza, osteonekróza, svalový zápal, tendonitída, artritída
|
Zriedkavé
| oneskorená fúzia epifýz,h spomalenie rastuh
|
Poruchy obličiek a močových ciest
|
Menej časté
| poruchy funkcie obličiek (vrátane renálneho zlyhania), časté močenie, proteinúria
|
Neznáme
| nefrotický syndróm
|
Stavy v gravidite, v šestonedelí a perinatálnom období
|
Zriedkavé
| potrat
|
Poruchy reprodukčného systému a prsníkov
|
Menej časté
| gynekomastia, porucha menštruácie
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté
| periférny edémi, únava, pyrexia, edém tvárej
|
Časté
| asténia, bolesť, bolesť na hrudi, generalizovaný edém*k, zimnica
|
Menej časté
| malátnosť, iný povrchový edéml
|
Zriedkavé
| porucha chôdze
|
Laboratórne a funkčné vyšetrenia
|
Časté
| zníženie telesnej hmotnosti, zvýšenie telesnej hmotnosti
|
Menej časté
| zvýšenie kreatínfosfokinázy v krvi, zvýšenie gama-glutamyltransferázy
|
Úrazy, otravy a komplikácie liečebného postupu
|
Časté
| kontúzia
|
a Zahŕňa zníženú chuť do jedla, predčasnú sýtosť, zvýšenú chuť do jedla.
b Zahŕňa krvácanie do centrálneho nervového systému, cerebrálny hematóm, cerebrálne krvácanie, extradurálny hematóm, intrakraniálne krvácanie, hemoragickú cievnu mozgovú príhodu, subarachnoidálne krvácanie, subdurálny hematóm a subdurálne krvácanie.
c Zahŕňa zvýšený mozgový natriuretický peptid, ventrikulárnu dysfunkciu, dysfunkciu ľavej komory, dysfunkciu pravej komory, srdcové zlyhanie, akútne srdcové zlyhanie, chronické srdcové zlyhanie, kongestívne srdcové zlyhanie, kardiomyopatiu, kongestívnu kardiomyopatiu, diastolickú dysfunkciu, zníženú ejekčnú frakciu a ventrikulárne zlyhanie, zlyhanie ľavej komory, zlyhanie pravej komory a ventrikulárnu hypokinézu..
d Okrem gastrointestinálneho krvácania a krvácania do CNS; tieto nežiaduce reakcie sú hlásené pod triedou orgánového systému poruchy gastrointestinálneho traktu alebo pod triedou orgánového systému poruchy nervového systému.
e Zahŕňa liekovú erupciu, erytém, multiformný erytém, erytrózu, exfoliatívnu vyrážku, generalizovaný erytém, genitálnu vyrážku, vyrážky z tepla, mílie, potničky, pustulárnu psoriázu, vyrážku, erytematóznu vyrážku, folikulárnu vyrážku, generalizovanú vyrážku, makulárnu vyrážku, makulo-papulárnu vyrážku, papulárnu vyrážku, pruritickú vyrážku, pustulárnu vyrážku, vezikulárnu vyrážku, kožnú exfoliáciu, kožné podráždenie, toxickú kožnú erupciu, vezikulóznu urtikáriu a vaskulitickú vyrážku.
f Po uvedení lieku na trh boli hlásené jednotlivé prípady Stevensovho-Johnsonovho syndrómu. Nebolo možné určiť, či tieto mukokutánne nežiaduce reakcie priamo súviseli s dasatinibom alebo so súbežne podávaným liekom.
g Muskuloskeletálna bolesť hlásená počas alebo po ukončení liečby.
h Frekvencie hlásené ako časté v pediatrických štúdiách.
i Gravitačný edém, lokalizovaný edém, periférny edém.
j Konjunktiválny edém, edém oka, opuch oka, edém očného viečka, edém tváre, edém pier, makulárny edém, edém úst, orbitálny edém, periorbitálny edém, opuch tváre.
k Nahromadenie tekutín, retencia tekutín, opuch gastrointestinálneho traktu, generalizovaný edém, periférny opuch, edém, edém z dôvodu ochorenia srdca, perinefrický výpotok, edém po chirurgickom výkone, viscerálny edém.
l Opuch genitálií, edém v mieste incízie, genitálny edém, edém pohlavného údu, opuch pohlavného údu, skrotálny edém, opuch kože, opuch semenníkov, opuchy vagíny a pošvy.
* Ďalšie podrobnosti pozri v časti „Opis vybraných nežiaducich reakcií“.
Opis vybraných nežiaducich reakciíMyelosupresiaLiečba Dasatinibom Zentiva sa spája s anémiou, neutropéniou a trombocytopéniou. Ich výskyt je skorší a častejší u pacientov v pokročilej fáze CML alebo s Ph+ ALL ako u pacientov v chronickej fáze CML (pozri časť 4.4).
KrvácanieU pacientov užívajúcich dasatinib boli hlásené nežiaduce reakcie krvácaní súvisiacich s liekom v rozsahu od petechie a epistaxy po gastrointestinálne krvácanie 3. alebo 4. stupňa a krvácanie do CNS (pozri časť 4.4).
Retencia tekutínRôzne nežiaduce reakcie, ako sú pleurálny výpotok, ascites, pľúcny edém a perikardiálny výpotok s povrchovým edémom alebo bez neho, možno súhrnne opísať ako „retenciu tekutín“. V štúdii s novodiagnostikovanou chronickou fázou CML po minimálne 60 mesiacoch následného sledovania zahŕňali nežiaduce reakcie retencie tekutín súvisiace s dasatinibom pleurálny výpotok (28 %), povrchový edém (14 %), pľúcnu hypertenziu (5 %), generalizovaný edém (4 %) a perikardiálny výpotok (4 %). Kongestívne srdcové zlyhanie/dysfunkcia srdca a pľúcny edém boli hlásené u < 2 % pacientov.
V priebehu času bola kumulatívna miera výskytu pleurálneho výpotku súvisiaceho s dasatinibom (všetky stupne) 10 % po 12 mesiacoch, 14 % po 24 mesiacoch, 19 % po 36 mesiacoch, 24 % po 48 mesiacoch a 28 % po 60 mesiacoch. Celkovo 46 pacientov liečených dasatinibom malo rekurentný pleurálny výpotok. Sedemnásť pacientov malo 2 samostatné nežiaduce reakcie, 6 malo 3 nežiaduce reakcie, 18 malo 4 až 8 nežiaducich reakcií a 5 malo > 8 epizód pleurálneho výpotku.
Medián času do prvého pleurálneho výpotku súvisiaceho s dasatinibom 1. alebo 2. stupňa bol 114 týždňov (rozsah: 4 až 299 týždňov). Menej než 10 % pacientov s pleurálnym výpotkom malo závažný (3. alebo 4. stupeň) pleurálny výpotok súvisiaci s dasatinibom. Medián času do prvého výskytu pleurálneho výpotku súvisiaceho s dasatinibom ≥ 3. stupňa bol 175 týždňov (rozsah: 114 až 274 týždňov). Medián trvania pleurálneho výpotku súvisiaceho s dasatinibom (všetky stupne) bol 283 dní (~40 týždňov).
Pleurálny výpotok bol zvyčajne vratný a bol zvládnutý prerušením liečby Dasatinibom Zentiva a použitím diuretík alebo iných vhodných podporných ošetrovacích opatrení (pozri časti 4.2 a 4.4). Medzi pacientmi liečenými dasatinibom s pleurálnym výpotkom súvisiacim s liekom (n=73) malo 45 (62 %) prerušenie liečby a 30 (41 %) malo zníženie dávky. Okrem toho 34 (47 %) dostalo diuretiká, 23 (32 %) dostalo kortikosteroidy a 20 (27 %) dostalo kortikosteroidy aj diuretiká. Deväť (12 %) pacientov podstúpilo terapeutickú torakocentézu.
Šesť percent pacientov liečených dasatinibom prerušilo liečbu z dôvodu pleurálneho výpotku súvisiaceho s liekom. Pleurálny výpotok nezhoršil schopnosť pacienta dosiahnuť odpoveď. Medzi pacientmi s pleurálnym výpotkom liečenými dasatinibom dosiahlo 96 % cCCyR, 82 % dosiahlo MMR a 50 % dosiahlo MR4.5 i napriek prerušeniam liečby alebo úprave dávky.
Pozri v časti 4.4 ďalšie informácie o pacientoch s chronickou fázou CML a s pokročilou fázou CML alebo Ph+ ALL.
Pľúcna arteriálna hypertenzia (PAH)PAH (prekapilárna pľúcna arteriálna hypertenzia potvrdená pravostrannou katetrizáciou srdca) bola hlásená v súvislosti s expozíciou dasatinibom. V týchto prípadoch bola hlásená PAH po začatí liečby dasatinibom, a to aj po viac ako jednom roku liečby. Pacienti s PAH hlásenou počas liečby dasatinibom často užívali súbežné lieky alebo mali komorbidity okrem základného nádorového ochorenia. Zlepšenie hemodynamických a klinických parametrov sa pozorovalo u pacientov liečených dasatinibom s PAH po ukončení liečby dasatinibom.
Predĺženie QT intervaluV štúdii fázy III s pacientmi s novodiagnostikovanou chronickou fázou CML jeden pacient (< 1 %) z pacientov liečených dasatinibom mal QTcF > 500 ms po minimálne 12 mesiacoch následného sledovania (pozri časť 4.4). Po minimálne 60 mesiacoch následného sledovania nebol u žiadnych ďalších pacientov hlásený QTcF > 500 ms.
V 5 klinických štúdiách fázy II s pacientmi s rezistenciou alebo intoleranciou na predchádzajúcu liečbu imatinibom sa vykonalo opakované EKG na začiatku liečby aj počas nej vo vopred určených časových intervaloch, vyhodnotené centrálne pre 865 pacientov liečených dasatinibom 70 mg dvakrát denne. Interval QT bol korigovaný podľa srdcovej frekvencie pomocou Fridericiovej metódy. Vo všetkých časových intervaloch po dávke na 8. deň boli priemerné zmeny oproti východiskovej hodnote intervalu QTcF 4 – 6 ms, so súvisiacim horným 95 % intervalom spoľahlivosti < 7 ms. Z 2 182 pacientov s rezistenciou alebo intoleranciou na predchádzajúcu liečbu imatinibom, ktorí v klinických štúdiách užívali dasatinib, 15 (1 %) pacientov hlásilo predĺženie QTc ako nežiaducu reakciu. Dvadsaťjeden pacientov (1 %) malo QTcF > 500 ms (pozri časť 4.4).
Srdcové nežiaduce reakciePacienti s rizikovými faktormi alebo srdcovým ochorením v anamnéze majú byť starostlivo sledovaní na prejavy alebo príznaky zodpovedajúce srdcovej dysfunkcii a majú byť posúdení a primerane liečení (pozri časť 4.4).
Reaktivácia hepatitídy BV súvislosti s inhibítormi BCR-ABL-tyrozínkinázy bola hlásená reaktivácia hepatitídy B. Niektoré prípady viedli k akútnemu zlyhaniu pečene alebo k fulminantnej hepatitíde, ktorých výsledkom bola transplantácia pečene alebo úmrtie (pozri časť 4.4).
V klinickej štúdii fázy III na optimalizáciu dávky u pacientov s chronickou fázou CML s rezistenciou alebo intoleranciou na predošlú liečbu imatinibom (medián trvania liečby 30 mesiacov) bol výskyt pleurálneho výpotku a kongestívneho srdcového zlyhania/srdcovej dysfunkcie nižší u pacientov liečených dasatinibom dávkou 100 mg jedenkrát denne ako u pacientov liečených dasatinibom dávkou 70 mg dvakrát denne.
Myelosupresia sa vyskytla tiež menej často v skupine liečenej dávkou 100 mg jedenkrát denne (pozri Abnormality laboratórnych testov nižšie). Medián trvania liečby v skupine so 100 mg jedenkrát denne bol 37 mesiacov (rozsah 1 – 91 mesiacov). Kumulatívna miera výskytu vybraných nežiaducich reakcií, ktorá bola hlásená pri odporúčanej začiatočnej dávke 100 mg jedenkrát denne, je uvedená v tabuľke 6a.
Tabuľka 6a: Vybrané nežiaduce reakcie hlásené v štúdii fázy III na optimalizáciu dávky(chronická fáza CML s intoleranciou alebo rezistenciou na imatinib)a
| Minimálne 2-ročné
následné sledovanie
| Minimálne 5-ročné
následné sledovanie
| Minimálne 7-ročné
následné sledovanie
|
| Všetky
stupne
| 3./4.
stupeň
| Všetky
stupne
| 3./4.
stupeň
| Všetky
stupne
| 3./4.
stupeň
|
Preferovaný výraz
| Percento (%) pacientov
|
Hnačka
Retencia tekutín
Povrchový edém
Pleurálny výpotok
Generalizovaný edém
Perikardiálny výpotok
Pľúcna hypertenzia
Krvácanie
Gastrointestinálne krvácanie
| 27
34
18
18
3
2
0
11
2
| 2
4
0
2
0
1
0
1
1
| 28
42
21
24
4
2
0
11
2
| 2
6
0
4
0
1
0
1
1
| 28
48
22
28
4
3
2
12
2
| 2
7
0
5
0
1
1
1
1
|
| | | | | | | | | | |
a Výsledky štúdie fázy III na optimalizáciu dávky hlásené v populácii pri odporúčanej začiatočnej dávke 100 mg jedenkrát denne (n = 165).
V štúdii fázy III na optimalizáciu dávky s pacientmi s pokročilou fázou CML a Ph+ ALL bol medián trvania liečby 14 mesiacov pre akcelerovanú fázu CML, 3 mesiace pre myeloidnú blastovú CML, 4 mesiace pre lymfoidnú blastovú CML a 3 mesiace pre Ph+ ALL. Vybrané nežiaduce reakcie, ktoré boli hlásené pri odporúčanej začiatočnej dávke 140 mg jedenkrát denne, sú uvedené v tabuľke 6b. Schéma dávkovania 70 mg dvakrát denne sa tiež skúmala. Schéma dávkovania 140 mg jedenkrát denne preukázala porovnateľný profil účinnosti voči schéme dávkovania 70 mg dvakrát denne, no s priaznivejším profilom bezpečnosti.
Tabuľka 6b: Vybrané nežiaduce reakcie hlásené v štúdii fázy III na optimalizáciu dávky:pokročilá fáza CML a Ph+ ALLa
| 140 mg jedenkrát denne
n = 304
|
| Všetky stupne
| 3./4. stupeň
|
Preferovaný výraz
| Percento (%) pacientov
|
Hnačka
Retencia tekutín
Povrchový edém
Pleurálny výpotok
Generalizovaný edém
Kongestívne srdcové zlyhanie
/srdcová dysfunkciab
Perikardiálny výpotok
Pľúcny edém
Krvácanie
Gastroinstestinálne krvácanie
| 28
33
15
20
2
1
2
1
23
8
| 3
7
< 1
6
0
0
1
1
8
6
|

a Výsledky štúdie fázy III na optimalizáciu dávky hlásené v populácii s odporúčanou začiatočnou dávkou 140 mg jedenkrát denne (n = 304) pri 2-ročnej finálnej štúdii následného sledovania.
b Vrátane komorovej dysfunkcie, srdcového zlyhania, kongestívneho srdcového zlyhania, kardiomyopatie, kongestívnej kardiomyopatie, diastolickej dysfunkcie, zníženie ejekčnej frakcie a komorového zlyhania.
Vykonali sa naviac dve štúdie s celkovo 161 pediatrickými pacientmi s ALL s Ph+, ktorým sa dasatinib podával v kombinácii s chemoterapiou. V pivotnej štúdii 106 pediatrických pacientov dostalo dasatinib v kombinácii s chemoterapiou s neprerušovanou schémou podávania. V podpornej štúdii s 55 pediatrickými pacientmi 35 pacientov dostávalo dasatinib v kombinácii s chemoterapiou s prerušovanou schémou podávania (dva týždne liečby, po ktorých nasledoval jeden až dva týždne bez liečby) a 20 pacientov dostávalo dasatinib v kombinácii s chemoterapiou s neprerušovanou schémou podávania. U 126 pediatrických pacientov s ALL s Ph+ liečených dasatinibom s neprerušovanou schémou podávania bol medián trvania liečby 23,6 mesiaca (rozsah 1,4 až 33 mesiacov).
Zo 126 pediatrických pacientov s Ph+ ALL s neprerušovanou schémou podávania sa u 2 (1,6 %) vyskytli nežiaduce reakcie vedúce k ukončeniu liečby. Nežiaduce reakcie hlásené v týchto dvoch pediatrických štúdiách s frekvenciou ≥ 10 % u pacientov s neprerušovanou schémou podávania sú uvedené v tabuľke 7. Za zmienku stojí, že pleurálna efúzia bola hlásená u 7 (5,6 %) pacientov v tejto skupine a preto nie je zahrnutá v tabuľke.
Tabuľka 7: Nežiaduce reakcie hlásené u ≥ 10 % pediatrických pacientov s ALL s Ph+ liečených dasatinibom s neprerušovanou schémou podávania v kombinácii s chemoterapiou (N = 126)a Percento (%) pacientov
|
Nežiaduca reakcia
| Všetky stupne
| 3./4. stupeň
|
Febrilná neutropénia
| 27,0
| 26,2
|
Nauzea
| 20,6
| 5,6
|
Vracanie
| 20,6
| 4,8
|
Abdominálna bolesť
| 14,3
| 3,2
|
Hnačka
| 12,7
| 4,8
|
Pyrexia
| 12,7
| 5,6
|
Bolesť hlavy
| 11,1
| 4,8
|
Znížená chuť do jedla
| 10,3
| 4,8
|
Únava
| 10,3
| 0
|
V pivotnej štúdii s celkovo 106 pacientmi dostalo 24 pacientov prášok na perorálnu suspenziu minimálne jedenkrát, 8 z nich dostalo výlučne liekovú formu prášok na perorálnu suspenziu.
Abnormality laboratórnych testov HematológiaV štúdii fázy III boli u pacientov s novodiagnostikovanou chronickou fázou CML užívajúcich dasatinib hlásené tieto laboratórne abnormality 3. a 4. stupňa po minimálne 12 mesiacoch následného sledovania: neutropénia (21 %), trombocytopénia (19 %) a anémia (10 %). Po minimálne 60 mesiacoch následného sledovania boli kumulatívne miery výskytu neutropénie, trombocytopénie a anémie 29 %, 22 % a 13 %, v uvedenom poradí.
U pacientov s novo diagnostikovanou chronickou fázou CML liečených dasatinibom, u ktorých sa vyskytla myelosupresia 3. alebo 4. stupňa, zvyčajne došlo po krátkom prerušení a/alebo znížení dávky k zotaveniu, pričom po minimálne 12 mesiacoch následného sledovania bola liečba trvalo ukončená u 1,6 % pacientov. Po minimálne 60 mesiacoch následného sledovania bola kumulatívna miera trvalého ukončenia liečby z dôvodu myelosupresie 3. alebo 4. stupňa 2,3 %.
U pacientov s CML s rezistenciou alebo intoleranciou na predošlú liečbu imatinibom sa konzistentne vyskytovali cytopénie (trombocytopénia, neutropénia a anémia). Výskyt cytopénií bol však tiež zreteľne závislý od štádia ochorenia. Frekvencia hematologických abnormalít 3. a 4. stupňa je uvedená v tabuľke 8.
Tabuľka 8: Hematologické laboratórne abnormality 3./4. stupňa podľa CTC v klinických štúdiách s pacientmi s rezistenciou alebo intoleranciou na predošlú liečbu imatiniboma
| Chronická fáza
(n = 165)b
| Akcelerovaná fáza
(n = 157)c
| Myeloidná blastová fáza (n = 74)c
| Lymfoidná
blastová fáza a Ph+ ALL (n = 168)c
|
| Percento (%) pacientov
|
Haematologické parametre
|
|
|
|
|
.................. Neutropénia
| 36
| 58
| 77
| 76
|
.................. Trombocytopénia
| 23
| 63
| 78
| 74
|
.................. Anémia
| 13
| 47
| 74
| 44
|
a Výsledky štúdie fázy III na optimalizáciu dávky hlásené počas 2 rokov následného sledovania v rámci štúdie.
b Výsledky štúdie CA180-034 pri odporúčanej začiatočnej dávke 100 mg jedenkrát denne.
c Výsledky štúdie CA180-035 pri odporúčanej začiatočnej dávke 140 mg jedenkrát denne.
Stupne podľa CTC: neutropénia (3. stupňa ≥ 0,5 – < 1,0 × 109/l, 4. stupňa < 0,5 × 109/l); trombocytopénia (3. stupňa ≥ 25 –
< 50 × 109/l, 4. stupňa < 25 × 109/l); anémia (hemoglobín 3. stupňa ≥ 65 – < 80 g/l, 4. stupňa < 65 g/l).
Kumulatívne miery výskytu cytopénie 3. alebo 4. stupňa u pacientov liečených dávkou 100 mg jedenkrát denne boli podobné v 2. a 5. roku vrátane: neutropénie (35 % oproti 36 %), trombocytopénie (23 % oproti 24 %) a anémie (13 % oproti 13 %).
U pacientov, ktorí mali myelosupresiu 3. alebo 4. stupňa, zvyčajne došlo k zotaveniu po krátkom prerušení liečby a/alebo znížení dávky a trvalé ukončenie liečby bolo potrebné u 5 % pacientov. Väčšina pacientov pokračovala v liečbe bez ďalších dôkazov o myelosupresii.
Biochemické vyšetreniaV štúdii s novodiagnostikovanou chronickou fázou CML bola hlásená hypofosfatémia 3. a 4. stupňa u 4 % pacientov liečených dasatinibom a zvýšenie hladín transamináz, kreatinínu a bilirubínu bolo hlásené u ≤ 1 % pacientov po minimálne 12 mesiacoch následného sledovania. Po minimálne 60 mesiacoch následného sledovania bola kumulatívna miera výskytu hypofosfatémie 3. alebo 4. stupňa 7 %, kumulatívna miera výskytu zvýšenia hladín kreatinínu a bilirubínu 3. alebo 4. stupňa bola 1 % a kumulatívna miera výskytu zvýšenia hladín transamináz 3. alebo 4. stupňa zostala na 1 %. Nedošlo k žiadnemu prerušeniu liečby dasatinibom v dôsledku týchto biochemických laboratórnych parametrov.
2-ročné následné sledovanieZvýšenie hladín transamináz alebo bilirubínu 3. alebo 4. stupňa bolo hlásené u 1 % pacientov v chronickej fáze CML (rezistentných alebo intolerantných na imatinib), ale u pacientov v pokročilej fáze CML a u pacientov s Ph+ ALL bolo zvýšenie hladín hlásené so vyššou frekvenciou 1 až 7 %. Zvyčajne sa zvládlo znížením dávky alebo prerušením liečby. V štúdii fázy III na optimalizáciu dávky u pacientov s chronickou fázou CML sa vyskytlo zvýšenie hladín transamináz alebo bilirubínu 3. alebo 4. stupňa u ≤ 1 % pacientov, pričom jeho výskyt bol podobne nízky vo všetkých štyroch liečených skupinách. V štúdii fázy III na optimalizáciu dávky u pacientov s pokročilou fázou CML a Ph+ALL sa vyskytlo zvýšenie hladín transamináz alebo bilirubínu 3. alebo 4. stupňa u 1 % až 5 % pacientov vo všetkých liečených skupinách.
Približne u 5 % pacientov liečených dasatinibom, ktorí mali normálne východiskové hladiny vápnika, vznikla v určitom čase počas štúdie prechodná hypokalciémia 3. alebo 4. stupňa. Znížené hladiny vápnika sa obvykle nespájali s klinickými symptómami. Pacienti, u ktorých vznikla hypokalciémia 3. alebo 4. stupňa, sa často zotavili po perorálnej suplementácii vápnika.
Hypokalciémia 3. alebo 4. stupňa, hypokaliémia a hypofosfatémia sa vyskytli u pacientov vo všetkých fázach CML, ale so zvýšenou frekvenciou u pacientov s myeloidnou alebo lymfoidnou blastovou fázou CML a Ph+ ALL. Zvýšenie hladiny kreatinínu 3. alebo 4. stupňa sa vyskytlo u < 1 % pacientov s chronickou fázou CML a zvýšený výskyt od 1 do 4 % bol hlásený u pacientov s pokročilou fázou CML.
Pediatrická populáciaBezpečnostný profil dasatinibu, ktorý sa podával ako monoterapia u pediatrických pacientov s Ph+ CML-CP, bol porovnateľný s bezpečnostným profilom u dospelých. Bezpečnostný profil dasatinibu, ktorý sa podával v kombinácii s chemoterapiou pediatrickým pacientom s ALL s Ph+, bol konzistentný so známym bezpečnostným profilom dasatinibu u dospelých a s očakávanými účinkami chemoterapie, s výnimkou nižšieho výskytu pleurálneho výpotku u pediatrických pacientov v porovnaní s dospelými.
V pediatrických štúdiách s CML boli miery výskytu laboratórnych abnormalít konzistentné so známym profilom laboratórnych parametrov u dospelých.
V pediatrických štúdiách s ALL boli miery výskytu laboratórnych abnormalít konzistentné so známym profilom laboratórnych parametrov u dospelých, v kontexte liečby pacienta s akútnou leukémiou, ktorý dostáva základný režim chemoterapie.
Osobitné populácieHoci bezpečnostný profil dasatinibu u starších ľudí bol podobný profilu v mladšej populácii, u pacientov vo veku 65 rokov a starších je pravdepodobnejší výskyt často hlásených nežiaducich reakcií, ako sú únava, pleurálny výpotok, dyspnoe, kašeľ, krvácanie do dolnej časti gastrointestinálneho traktu a porucha chuti, a tiež pravdepodobnejší výskyt menej často hlásených nežiaducich reakcií, ako sú abdominálna distenzia, závrat, perikardiálny výpotok, kongestívne srdcové zlyhanie a pokles telesnej hmotnosti, a majú sa starostlivo sledovať (pozri časť 4.4).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 Predávkovanie
Skúsenosti s predávkovaním dasatinibom v klinických štúdiách sú obmedzené na ojedinelé prípady. Najväčšie predávkovanie 280 mg denne počas jedného týždňa bolo hlásené u dvoch pacientov a u oboch došlo k signifikantnému zníženiu počtu trombocytov. Pretože sa dasatinib spája s myelosupresiou 3. alebo 4. stupňa (pozri časť 4.4), pacienti, ktorí užili vyššiu ako odporúčanú dávku, majú byť dôkladne sledovaní na myelosupresiu a má im byť poskytnutá podporná liečba.
5. FarmaKologicKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: cytostatiká, inhibítory proteínkinázy, ATC kód: L01XE06
Farmakodynamické účinkyDasatinib inhibuje aktivitu BCR-ABL-kinázy a kináz rodiny SRC, ako aj niekoľkých ďalších vybraných onkogénnych kináz zahŕňajúcich kinázy c-KIT receptora, efrínového (EPH) receptora a PDGFβ receptora. Dasatinib je silným subnanomolárnym inhibítorom BCR-ABL-kinázy s účinnosťou pri koncentrácii 0,6 - 0,8 nmol/l. Viaže sa na inaktívne aj aktívne konformácie enzýmu BCR-ABL.
Mechanizmus účinkuV podmienkach
in vitro je dasatinib aktívny v leukemických bunkových líniách predstavujúcich varianty ochorenia citlivého a rezistentného na imatinib. Tieto predklinické štúdie ukazujú, že dasatinib môže prekonať rezistenciu na imatinib, ktorá je dôsledkom nadmernej expresie BCR-ABL, mutácií BCR-ABL-kinázovej domény, aktivácie alternatívnych signálnych dráh zahŕňajúcich kinázy rodiny SRC (LYN, HCK) a nadmernej expresie génu pre rezistenciu na viaceré lieky. Dasatinib okrem toho inhibuje kinázy rodiny SCR pri subnanomolárnej koncentrácii.
V samostatných experimentoch
in vivo využívajúcich myšacie modely CML dasatinib zabránil progresii chronickej fázy CML do blastickej fázy a predĺžil prežívanie myší nesúcich ľudské bunkové línie CML kultivované na rôznych miestach, vrátane centrálneho nervového systému.
Klinická účinnosť a bezpečnosťV štúdii fázy I bola hematologická a cytogenetická odpoveď pozorovaná pri všetkých fázach CML a Ph+ ALL u prvých 84 pacientov liečených a následne sledovaných až 27 mesiacov. Odpovede mali trvalý charakter vo všetkých fázach CML a pri Ph+ ALL.
Vykonali sa štyri jednoramenné, nekontrolované, otvorené klinické štúdie fázy II hodnotiace bezpečnosť a účinnosť dasatinibu u pacientov s CML v chronickej, akcelerovanej alebo myeloidnej blastickej fáze, ktorí boli buď rezistentní, alebo intolerantní na imatinib. Jedna randomizovaná, nekomparatívna štúdia sa vykonala u pacientov v chronickej fáze, u ktorých zlyhala úvodná liečba so 400 alebo 600 mg imatinibu. Počiatočná dávka dasatinibu bola 70 mg dvakrát denne. Úpravy dávky boli povolené na zlepšenie účinnosti alebo zvládnutie toxicity (pozri časť 4.2).
Dve randomizované, otvorené klinické štúdie fázy III sa vykonali s cieľom zhodnotiť účinnosť dasatinibu podávaného jedenkrát denne v porovnaní s dasatinibom podávaným dvakrát denne. Okrem toho, jedna otvorená, randomizovaná, porovnávacia štúdia fázy III bola vykonaná u dospelých pacientov s novodiagnostikovanou chronickou fázou CML.
Účinnosť dasatinibu sa zakladá na miere hematologickej a cytogenetickej odpovede.
Trvalý charakter odpovede a odhadovaná miera prežitia poukazujú na ďalší dôkaz o klinickom prínose dasatinibu.
V klinických štúdiách sa hodnotil celkový počet 2 712 pacientov, z ktorých 23 % bolo vo veku ≥ 65 rokov a 5 % bolo vo veku ≥ 75 rokov.
Chronická fáza CML – novodiagnostikovanáMedzinárodná otvorená, multicentrická, randomizovaná, porovnávacia štúdia fázy III sa vykonala s dospelými pacientmi s novodiagnostikovanou chronickou fázou CML. Pacienti boli randomizovaní do skupiny užívajúcich buď dasatinib 100 mg jedenkrát denne, alebo imatinib 400 mg jedenkrát denne. Primárnym koncovým ukazovateľom bola miera potvrdenej kompletnej cytogenetickej odpovede (cCCyR) počas 12 mesiacov. Sekundárne koncové ukazovatele zahŕňali čas v cCCyR (meranie trvania odpovede), čas do cCCyR, mieru veľkej molekulárnej odpovede (MMR), čas do MMR, prežívanie bez progresie (PFS) a celkové prežívanie (OS). Ostatné relevantné výsledky účinnosti zahŕňali mieru CCyR a mieru kompletnej molekulárnej odpovede (CMR). Štúdia prebieha.
Celkovo 519 pacientov bolo randomizovaných do skupín: 259 do skupiny dasatinibu a 260 do skupiny imatinibu. Základné charakteristiky boli dobre vyvážené medzi oboma liečebnými skupinami s ohľadom na vek (medián veku bol 46 rokov pre dasatinibovú skupinu a 49 rokov pre imatinibovú skupinu s 10 % pacientov v dasatinibovej skupine a 11 % pacientov v imatinibovej skupine vo veku 65 rokov alebo starších), pohlavie (ženy 44 % v dasatinibovej skupine a 37 % v imatinibovej skupine), a rasu (kaukazská 51 % v dasatinibovej skupine a 55 % v imatinibovej skupine, ázijská 42 % v dasatinibovej skupine a 37 % imatinibovej skupine). Na začiatku bola distribúcia Hasfordovho skóre podobná v dasatinibom a imatinibom liečenej skupine (nízke riziko: 33 % a 34 %, stredné riziko 48 % a 47 %, vysoké riziko: 19 % a 19 % v dasatinibovej skupine a imatinibovej skupine v uvedenom poradí).
V minimálne 12 mesačnom následnom sledovaní, 85 % pacientov randomizovaných do skupiny s dasatinibom a 81 % pacientov randomizovaných do skupiny s imatinibom stále dostávalo najprv prvolíniovú liečbu.
Prerušenie počas 12 mesiacov z dôvodu progresie ochorenia sa vyskytlo u 3 % pacientov liečených dasatinibom a u 5 % pacientov liečených imatinibom.
V minimálne 60 mesačnom následnom sledovaní, 60 % pacientov randomizovaných do skupiny s dasatinibom a 63 % pacientov randomizovaných do skupiny s imatinibom stále dostávalo prvolíniovú liečbu. Prerušenie liečby počas 60 mesiacov z dôvodu progresie ochorenia sa vyskytlo u 11 % pacientov liečených dasatinibom a u 14 % pacientov liečených imatinibom.
Výsledky účinnosti sú uvedené v tabuľke 9. Štatisticky významne väčší podiel pacientov v dasatinibovej skupine dosiahol cCCyR v priebehu prvých 12 mesiacov liečby v porovnaní s pacientmi v imatinibovej skupine. Účinnosť dasatinibu bola konzistentne preukázaná v rôznych podskupinách, zahŕňajúc vek, pohlavie a východiskové Hasfordove skóre.
Tabuľka 9: Výsledky účinnosti zo štúdie fázy 3 s novodiagnostikovanými pacientmi s chronickou fázou CML
| Dasatinib
N=259
| Imatinib
n=260
| p-hodnota
|
| Miera odpovede (95% CI)
|
|
Cytogenetická odpoveď
v priebehu 12 mesiacov
|
|
|
|
cCCyRa
CCyRb
v priebehu 24mesiacov
cCCyRa
CCyRb
v priebehu 36mesiacov
cCCyRa
CCyRb
v priebehu 48mesiacov
cCCyRa
CCyRb
v priebehu 60mesiacov
cCCyRa
CCyRb
CCyRb
| 76,8% (71,2–81,8)
85,3% (80,4-89,4)
| 66,2% (60,1–71,9)
73,5% (67,7-78,7)
| p< 0,007*
⎯
|
80,3%
|
74,2%
|
⎯
|
87,3%
| 82,3%
| ⎯
|
82,6%
|
77,3%
|
⎯
|
88,0%
| 83,5%
| ⎯
|
82,6%
|
78,5%
|
⎯
|
87,6%
| 83,8%
| ⎯
|
83,0%
|
78,5%
|
⎯
|
88,0%
| 83,8%
| ⎯
|
Veľká molekulárna odpoveďc
|
|
|
|
12 mesiacov
| 52,1% (45,9–58,3)
| 33,8% (28,1–39,9)
| p< 0,00003*
|
24 mesiacov
| 64,5% (58,3-70,3)
| 50% (43,8-56,2)
| ⎯
|
36 mesiacov
| 69,1% (63,1-74,7)
| 56,2% (49,9-62,3)
| ⎯
|
48 mesiacov
| 75,7% (70,0-80,8)
| 62,7% (56,5-68,6)
| ⎯
|
60 mesiacov
| 76,4% (70,8-81,5)
| 64,2% (58,1-70,1)
| p=0,0021
|
| Pomer rizika (HR)
|
|
| počas 12 mesiacov (99,99% CI)
|
|
Čas do cCCyR
| 1,55 (1,0-2,3)
| p< 0,0001*
|
Čas do MMR
| 2,01 (1,2-3,4)
| p< 0,0001*
|
Trvania cCCyR
| 0,7 (0,4-1,4)
| p< 0,035
|
| počas 24 mesiacov (95% CI)
|
|
Čas do cCCyR
| 1,49 (1,22-1,82)
| ⎯
|
Čas do MMR
| 1,69 (1,34-2,12)
| ⎯
|
Trvania cCCyR
| 0,77 (0,55-1,10)
počas 36 mesiacov (95% CI)
| ⎯
|
Čas do cCCyR
| 1,48 (1,22-1,80)
| ⎯
|
Čas do MMR
Trvania cCCyR
Čas do c CCyR
Čas do MMR
Trvania cCCyR
Čas do cCCyR
Čas do MMR
Trvania cCCyR
| 1,59 (1,28-1,99)
0,77 (0,53-1,11)
počas 48 mesiacov (95% CI)
1,45 (1,20-1,77)
1,55 (1,26-1,91)
0,81 (0,56-1,17)
počas 60 mesiacov (95% CI)
1,46 (1,20-1,77)
1,54 (1,25-1,89)
0,79 (0,55-1,13)
| ⎯
⎯
⎯
⎯
⎯
p=0,0001
p<0,0001
p=0,1983
|
a Potvrdená kompletná cytogenetická odpoveď (cCCyR) je definovaná ako odpoveď známa z dvoch po sebe idúcich udalostí (najmenej 28 dní odstup).
b Kompletná cytogenetická odpoveď (CCyR) je založená na jednom cytogenetickom zhodnotení kostnej drene.
c Veľká molekulárna odpoveď (v akomkoľvek čase) bola definovaná ako BCR-ABL podiely ≤ 0,1 % podľa RQ-PCR vo vzorkách periférnej krvi štandardizovaných na Medzinárodnej stupnici. Ide o kumulatívne miery predstavujúce minimálne sledovanie pre stanovený časový rámec.
* Upravené na Hasfordovo skóre a uvedená štatistická významnosť na preddefinovanú nominálnu hodnotu významnosti. CI = interval spoľahlivosti
Po 60 mesačnom následnom sledovaní bol medián času do cCCyR 3,1 mesiaca v dasatinibovej skupine a 5,8 mesiaca v imatinibovej skupine u pacientov s potvrdenou CCyR. Medián času do MMR bol po 60 mesačnom následnom sledovaní 9,3 mesiaca v dasatinibovej skupine a 15,0 mesiacov v imatinibovej skupine pacientov s MMR. Tieto výsledky sú zhodné s tými, ktoré sa zistili po 12, 24 a 36 mesiacoch.
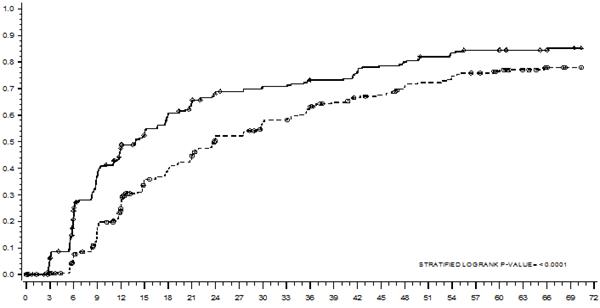
Čas do MMR je zobrazený graficky na Grafe 1. Čas do MMR bol rovnomerne kratší u pacientov liečených dasatinibom v porovnaní s pacientmi liečenými imatinibom.
Graf 1: Odhad času veľkej molekulárnej odpovede (MMR) podľa Kaplana-Meiera

Dasatinib ------ Imatinib
Cenzurovaní Cenzurovaní


SKUPINA # RESPONDÉRI / # RANDOMIZOVANÍ POMER RIZIKA (95% CI)
Dasatinib 198/259
Imatinib 167/260
Dasatinib v porovnaní s imatinibom 1,54 (1,25 – 1,89)
Miery cCCyR v dasatinibom a imatinibom liečenej skupine, v uvedenom poradí, počas 3 mesiacov (54 % a 30 %), počas 6 mesiacov (70 % a 56 %), počas 9 mesiacov (75 % a 63 %), počas 24 mesiacov (80 % a 74 %), počas 36 mesiacov (83 % a 77 %), počas 48 mesiacov (83 % a 79 %) a počas 60 mesiacov (83 % a 79 %) boli zhodné s primárnym koncovým ukazovateľom. Miery MMR v dasatinibom a imatinibom liečenej skupine, v uvedenom poradí počas 3 mesiacov (8 % a 0,4 %), 6 mesiacov (27 % a 8 %), 9 mesiacov (39 % a 18 %), 12 mesiacov (46 % a 28 %), 24 mesiacov (64 % a 46 %), 36 mesiacov (67 % a 55 %), 48 mesiacov (73 % a 60 %) a počas 60 mesiacov (76 % a 64 %) boli tiež zhodné s primárnym koncovým ukazovateľom.
Pomery MMR pri špecifických časových bodoch sú zobrazené graficky na Grafe 2. Pomery MMR boli rovnomerne vyššie u pacientov liečených dasatinibom v porovnaní s pacientmi liečenými imatinibom.
Graf 2: Hodnoty MMR v priebehu času – všetci randomizovaní pacienti v štúdii fázy 3 s novodiagnostikovanými pacientmi v chronickej fáze CML
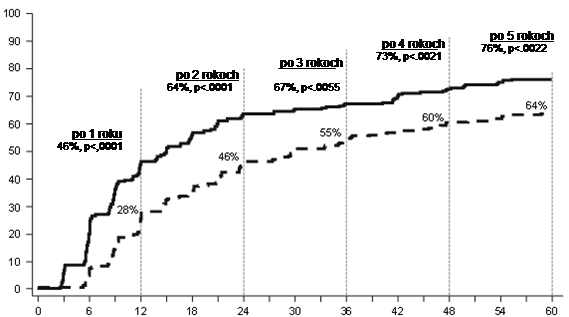

Mesiace od randomizácie
NDasatinib 100 mg jedenkrát denne 259
--------- Imatinib 400 mg jedenkrát denne 260
Podiel pacientov, ktorí dosiahli pomer BCR-ABL ≤0,01 % (4-log zníženie) v akomkoľvek čase bol vyšší v dasatinibom liečenej skupine v porovnaní s imatinibom liečenej skupine (54,1 % proti 45 %). Podiel pacientov, ktorí dosiahli pomer BCR-ABL ≤0,032 % (4,5-log zníženie) v akomkoľvek čase bol vyšší v dasatinibom liečenej skupine v porovnaní s imatinibom liečenej skupine (44 % proti 34 %).
Pomery MR4.5 v priebehu času sú zobrazené graficky na Grafe 3. Pomery MR4.5 boli v priebehu času rovnomerne vyššie u pacientov liečených dasatinibom v porovnaní s pacientmi liečenými imatinibom.
Graf 3: Hodnoty MR4.5 v priebehu času – všetci randomizovaní pacienti v štúdii fázy 3 snovodiagnostikovanými pacientmi v chronickej fáze CML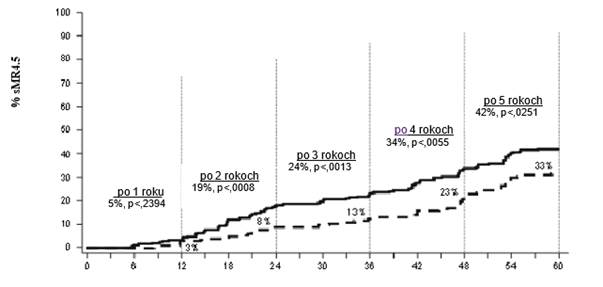 Mesiace od randomizácie N
Mesiace od randomizácie N Dasatinib 100 mg jedenkrát denne 259
--------- Imatinib 400 mg jedenkrát denne 260
Miera MMR v akomkoľvek čase v každej rizikovej skupine určená Hasfordovým skóre bola vyššia v dasatinibom liečenej skupine v porovnaní s imatinibom liečenej skupine (nízke riziko: 90 % a 69 %; stredné riziko: 71 % a 65 %; vysoké riziko: 67 % a 54 %) v uvedenom poradí.
V ďalšej analýze dosiahlo viac pacientov liečených dasatinibom (84 %) skorú molekulárnu odpoveď (definovanú ako hladiny BCR-ABL ≤ 10 % po 3 mesiacoch) v porovnaní s pacientmi liečenými imatinibom (64 %). Pacienti s dosiahnutou skorou molekulárnou odpoveďou mali nižšie riziko transformácie, vyšší pomer prežívania bez progresie (PFS, progression-free survival) a vyšší pomer celkového prežívania (OS, overall survival), ako je uvedené v tabuľke 10.
Tabuľka 10: Pacienti s dasatinibom s BCR-ABL ≤
10 % a > 10 % po 3 mesiacoch
Dasatinib N = 235
| Pacienti s BCR-ABL ≤ 10 % po 3 mesiacoch
| Pacienti s BCR-ABL
> 10 % po 3 mesiacoch
|
Počet pacientov (%)
| 198 (84,3)
| 37 (15,7)
|
Transformácia po 60 mesiacoch,
| 6/198 (3,0)
| 5/37 (13,5)
|
n/N (%)
|
|
|
Pomer PFS po 60 mesiacoch
| 92,0 % (89,6; 95,2)
| 73,8 % (52,0; 86,8)
|
(95 % CI)
|
|
|
Pomer OS po 60 mesiacoch (95 % CI)
| 93,8 % (89,3; 96,4)
| 80,6 % (63,5; 90,2)
|
Hodnoty OS pri špecifických časových bodoch sú zobrazené na Grafe 4. Hodnota OS bola rovnomerne vyššia u pacientov liečených dasatinibom, ktorí dosiahli hladinu BCR-ABL ≤ 10 % po 3 mesiacoch než u tých, ktorí ju nedosiahli.
Graf 4: Grafické znázornenie orientačných bodov celkového prežívania pri dasatinibe pomocou hladiny BCR-ABL (≤ 10% alebo > 10%) po 3 mesiacoch v štúdii fázy 3 s novodiagnostikovanými pacientmi s chronickou fázou CML
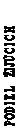

| MESIACE
|
|
Rizikoví pacienti
<=10% 198 198
|
197
|
196
|
195
|
193
|
193
|
191
|
191
|
190
|
188
|
187 187 184 182
|
181
|
180 179 179 177 171 96
|
54 29
|
3
|
0
|
>10% 37 37
| 37
| 35
| 34
| 34
| 34
| 33
| 33
| 31
| 30
| 29 29 29 28
| 28
| 28 27 27 27 26 15
| 10 6
| 0
| 0
|
≤10% ------ >10%

Cenzurovaní

Cenzurovaní
SKUPINA
| # ÚMRTIA / # Pacient, ktorý ukončil štúdiu
| MEDIáN (95% CI)
| POMER RIZIKA (95% CI)
|
≤10%
| 14/198
| .(. - .)
|
|
>10%
| 8/37
| .(. - .)
|
|
|
|
| 0,29 (0,12 – 0,69)
|
Progresia ochorenia bola definovaná ako zvýšenie bielych krviniek napriek zodpovedajúcej liečbe, strata CHR, čiastočná CyR alebo CCyR, progresia do akcelerovanej fázy alebo blastovej fázy alebo smrť. Odhadovaná miera 60-mesačného PFS bola 88,9 % (CI: 84 % – 92,4 %) v dasatinibom a imatinibom liečenej skupine. Zmena na akcelerovanú alebo blastovú fázu po 60 mesiacoch sa vyskytla u niekoľkých dasatinibom liečených pacientov (n=8; 3 %) v porovnaní s pacientmi liečenými imatinibom (n = 15; 5,8 %). Odhadovaná miera 60-mesačného prežitia pre dasatinibom a imatinibom liečených pacientov bola 90,9 % (CI: 86,6 % – 93,8 %) a 89,6 % (CI: 85,2 % – 92,8 %), v uvedenom poradí. Medzi dasatinibom a imatinibom nebol rozdiel v OS (HR 1,01; 95 % CI: 0,58 – 1,73; p= 0,9800) a PFS (HR 1,00, 95 % CI: 0,58 – 1,72, p = 0,9998).
U pacientov, u ktorých sa zaznamenala progresia ochorenia alebo ukončenie liečby dasatinibom alebo imatinibom, sa vykonalo sekvenovanie BCR-ABL na krvných vzorkách od pacientov, u ktorých boli dostupné. V obidvoch liečených ramenách sa pozoroval podobný pomer výskytu mutácií. Mutácie detekované u pacientov liečených dasatinibom boli T315I, F317I/L a V299L. V ramene liečenom imatinibom sa detegovalo iné spektrum mutácií. Na základe
in vitro údajov sa dasatinib neprejavuje ako účinný voči mutácii T315I.
Chronická fáza CML – Rezistencia alebo intolerancia na predošlú liečbu imatinibomVykonali sa dve klinické štúdie s pacientmi rezistentnými alebo intolerantnými na imatinib; koncovým ukazovateľom primárnej účinnosti v týchto štúdiách bola veľká cytogenetická odpoveď (MCyR).
1. štúdiaOtvorená, randomizovaná, nekomparatívna, multicentrická štúdia sa vykonala s pacientmi, u ktorých zlyhala úvodná liečba so 400 alebo 600 mg imatinibu. Boli randomizovaní (2:1) buď do skupiny s dasatinibom (70 mg dvakrát denne) alebo s imatinibom (400 mg dvakrát denne). Prechod do alternatívnej liečebnej skupiny bol povolený vtedy, ak pacienti vykazovali prejavy progresie ochorenia alebo intoleranciu, ktorú nebolo možné zvládnuť úpravou dávky. Primárny koncový ukazovateľ bol MCyR po 12 týždňoch. Sú dostupné výsledky u 150 pacientov: 101 pacientov bolo randomizovaných do skupiny s dasatinibom a 49 pacientov do skupiny s imatinibom (všetci pacienti boli rezistentní na imatinib). Medián času od stanovenia diagnózy po randomizáciu bol 64 mesiacov v skupine s dasatinibom a 52 mesiacov v skupine s imatinibom.
Všetci pacienti boli po predošlej intenzívnej liečbe. Predošlá úplná hematologická odpoveď (CHR) na imatinib sa dosiahla u 93 % z celkovej populácie pacientov. Predošlá MCyR na imatinib sa dosiahla u 28 % pacientov v skupine s dasatinibom a u 29 % pacientov v skupine s imatinibom.
Medián trvania liečby bol 23 mesiacov pre skupinu s dasatinibom (pričom dosiaľ bolo 44 % pacientov liečených počas > 24 mesiacov) a 3 mesiace pre skupinu s imatinibom (pričom dosiaľ bolo 10 % pacientov liečených počas > 24 mesiacov). Pred prechodom do druhej skupiny liečby dosiahlo CHR v skupine s dasatinibom deväťdesiattri percent pacientov a v skupine s imatinibom 82 % pacientov.
Počas 3 mesiacov sledovania došlo k MCyR častejšie v skupine s dasatinibom (36 %) ako v skupine s imatinibom (29 %). Pozoruhodné je, že v skupine s dasatinibom hlásilo úplnú cytogenetickú odpoveď (CCyR) 22 % pacientov, pričom v skupine s imatinibom dosiahlo CCyR len 8 %. Pri dlhšej liečbe a sledovaní (medián 24 mesiacov) sa MCyR dosiahla u 53 % pacientov liečených dasatinibom (CCyR u 44 %) a u 33 % pacientov liečených imatinibom (CCyR u 18 %) pred prechodom do druhej skupiny. Medzi pacientmi, ktorí užívali imatinib v dávke 400 mg pred vstupom do štúdie, MCyR dosiahlo 61 % pacientov v ramene s dasatinibom a 50 % v ramene s imatinibom.
Na základe Kaplanových-Meierových odhadov bol pomer pacientov, ktorí si udržali MCyR počas 1 roka 92 % (95 % CI: [85 % – 100 %]) pre dasatinib (CCyR 97 %, 95 % CI: [92 % – 100 %]) a 74 % (95 % CI: [49 % – 100 %]) pre imatinib (CCyR 100 %). Pomer pacientov, ktorí si udržali MCyR počas 18 mesiacov bol 90 % (95 % CI: [82 % – 98%]) pre dasatinib (CCyR 94%, 95 % CI: [87% – 100 %]) a 74 % (95 % CI: [49 % – 100 %]) pre imatinib (CCyR 100 %).'
Na základe Kaplanových-Meierových odhadov bol pomer pacientov, ktorí prežívali bez progresie (PFS) počas 1 roka 91 % (95 % CI: [85 % – 97 %]) pre dasatinib a 73 % (95 % CI: [54 % – 91 %]) pre imatinib. Pomer pacientov, ktorí prežívali bez progresie počas 2 rokov bol 86 % (95 % CI: [78 % – 93 %]) pre dasatinib a 65 % (95 % CI: [43 % – 87 %]) pre imatinib.
Z celkového počtu 43 % pacientov v skupine s dasatinibom a 82 % pacientov v skupine s imatinibom došlo k zlyhaniu liečby, ktoré bolo definované ako progresia ochorenia alebo prechod do druhej skupiny liečby (nedostatočná odpoveď, intolerancia skúšaného lieku, atď.).
Výskyt veľkej cytogenetickej odpovede (definovaný ako BCR-ABL/kontrola transkriptov ≤ 0,1 % pomocou RQ-PCR vo vzorke periférnej krvi) pred prechodom do druhej skupiny bol 29 % pre dasatinib a 12 % pre imatinib.
2. štúdiaOtvorená, multicentrická štúdia s jednou skupinou sa vykonala s pacientmi rezistentnými alebo intolerantnými na imatinib (napr. pacienti, ktorí majú skúsenosť so signifikantnou toxicitou počas liečby imatinibom, ktorý vylučuje ďalšiu liečbu).
Dasatinib 70 mg dvakrát denne užívalo celkovo 387 pacientov (288 rezistentní a 99 intolerantní na imatinib). Medián času od stanovenia diagnózy po začiatok liečby bol 61 mesiacov. Väčšina pacientov (53 %) dostala predošlú liečbu imatinibom trvajúcu viac ako 3 roky. Väčšina rezistentných pacientov (72 %) užívala > 600 mg imatinibu. Okrem imatinibu dostalo 35 % pacientov aj predošlú cytotoxickú chemoterapiu, 65 % dostalo predošlú liečbu interferónom a 10 % bolo po predošlej transplantácii kmeňových buniek. Tridsaťosem percent pacientov malo na začiatku liečby mutácie, o ktorých je známe, že vyvolávajú rezistenciu na imatinib. Medián trvania liečby dasatinibom bol 24 mesiacov, pričom dosiaľ bolo 51 % pacientov liečených počas > 24 mesiacov. Výsledky účinnosti sú uvedené v tabuľke 11. MCyR sa dosiahla u 55 % pacientov rezistentných na imatinib a 82 % pacientov intolerantných na imatinib. Pri minimálne 24-mesačnom sledovaní malo len 21 z 240 pacientov, ktorí dosiahli MCyR, progresiu ochorenia a nedosiahli medián trvania MCyR.
Na základe Kaplanových-Meierových odhadov si 95 % (95 % CI: [92 % – 98 %]) pacientov udržalo MCyR počas 1 roka a 88 % (95 % CI: [83 % – 93 %]) si udržalo MCyR počas 2 rokov. Pomer pacientov, ktorí si udržali CCyR počas roka bol 97 % (95 % CI: [94 % – 99 %]) a počas 2 rokov bol 90 % (95 % CI: [86 % – 95 %]). Štyridsaťdva percent pacientov rezistentných na imatinib bez predchádzajúcej MCyR na imatinib (n= 188) dosiahlo MCyR s dasatinibom.
Vyskytlo sa 45 odlišných BCR-ABL mutácií u 38 % pacientov zaradených do tejto štúdie. Úplná hematologická odpoveď alebo MCyR bola dosiahnutá u pacientov majúcich množstvo BCR-ABL mutácií súvisiacich s rezistenciou na imatinib okrem T315I. Podiel MCyR v 2. roku bol podobný či pacienti mali akúkoľvek základnú BCR-ABL mutáciu, P-loop mutáciu alebo nemali mutáciu (63 %, 61 % a 62 %).
Medzi pacientmi rezistentnými na imatinib bol odhadovaný pomer PFS 88 % (95 % CI: [84 % – 92 %]) v 1. roku a 75 % (95 % CI: [69 % – 81 %]) v 2 roku. Medzi pacientmi intolerantnými na imatinib bol odhadovaný pomer PFS 98 % (95 % CI: [95 % – 100 %]) v 1. roku a 94 % (95 % CI: [88 % – 99 %]) v 2 roku.
Pomer veľkej molekulárnej odpovede po 24 mesiacoch bol 45 % (35 % pre imatinib rezistentných pacientov a 74 % pre imatinib intolerantných pacientov).
Akcelerovaná fáza CMLOtvorená, multicentrická štúdia s jednou skupinou sa vykonala s pacientmi intolerantnými alebo rezistentnými na imatinib. Dasatinib 70 mg dvakrát denne užívalo celkovo 174 pacientov (161 rezistentní a 13 intolerantní na imatinib). Medián času od stanovenia diagnózy po začiatok liečby bol 82 mesiacov. Medián trvania liečby dasatinibom bol 14 mesiacov, pričom dosiaľ bolo 31 % pacientov liečených počas > 24 mesiacov. Pomer veľkej molekulárnej odpovede (hodnotený u 41 pacientov s CCyR) po 24 mesiacoch bol 46 %. Ďalšie výsledky účinnosti sú uvedené v tabuľke 11.
Myeloidná blastická fáza CMLOtvorená, multicentrická štúdia s jednou skupinou sa vykonala s pacientmi intolerantnými alebo rezistentnými na imatinib. Dasatinib 70 mg dvakrát denne užívalo celkovo 109 pacientov (99 rezistentní a 10 intolerantní na imatinib). Medián času od stanovenia diagnózy po začiatok liečby bol 48 mesiacov. Medián trvania liečby dasatinibom bol 3,5 mesiacov, pričom dosiaľ bolo 12 % pacientov liečených počas > 24 mesiacov. Pomer veľkej molekulárnej odpovede (hodnotený u 19 pacientov s CCyR) po 24 mesiacoch bol 68 %. Ďalšie výsledky účinnosti sú uvedené v tabuľke 11.
Lymfoidná blastická fáza CML a Ph+ ALLOtvorená multicentrická štúdia s jedným ramenom sa vykonala s pacientmi v lymfoidnej blastickej fáze CML alebo s Ph+ ALL, ktorí boli rezistentní alebo intolerantní na predošlú liečbu imatinibom. Dasatinib 70 mg dvakrát denne užívalo celkovo 48 pacientov v lymfoidnej blastickej fáze CML (42 rezistentní a 6 intolerantní na imatinib). Medián času od stanovenia diagnózy po začiatok liečby bol 28 mesiacov. Medián trvania liečby dasatinibom bol 3 mesiace, pričom dosiaľ boli 2 % pacientov liečených počas > 24 mesiacov. Pomer veľkej molekulárnej odpovede (všetkých 22 liečených pacientov s CCyR) po 24 mesiacoch bol 50 %. Okrem toho dasatinib 70 mg dvakrát denne užívalo spolu 46 pacientov s Ph+ ALL (44 rezistentní a 2 intolerantní na imatinib). Medián času od stanovenia diagnózy po začiatok liečby bol 18 mesiacov. Medián trvania liečby dasatinibom bol 3 mesiace, pričom dosiaľ bolo 7 % pacientov liečených počas > 24 mesiacov. Miera veľkej molekulárnej odpovede (všetkých 25 liečených pacientov s CCyR) po 24 mesiacoch bola 52 %. Výsledky účinnosti sú uvedené v tabuľke 11. Za zmienku stojí, že veľká hematologická odpoveď (MaHR) bola dosiahnutá rýchlo (väčšinou do 35 dní od prvého podania dasatinibu u pacientov v lymfoidnej blastickej fáze CML, a do 55 dní od prvého podania dasatinibu u pacientov s Ph+ ALL).
Tabuľka 11: Účinnosť dasatinibu v klinickej štúdii fázy II s jedným ramenoma
Chronická fáza
(n= 387)
|
Akcelerovaná fáza (n= 174)
|
Myeloidná blastová fáza (n= 109)
| Lymfoidnáblastová fáza
(n= 48)
|
Ph+ALL
(n= 46)
|
Pomer hematologickej odpovedeb (%)
|
|
|
|
|
MaHR (95% CI)
|
| n/a
| 64% (57-72)
| 33% (24-43)
| 35% (22-51)
| 41% (27-57)
|
CHR (95% CI)
|
| 91% (88-94)
| 50% (42-58)
| 26% (18-35)
| 29% (17-44)
| 35% (21-50)
|
NEL (95% CI)
|
| n/a
| 14% (10-21)
| 7% (3-14)
| 6% (1-17)
| 7% (1-18)
|
Trvanie MaHR (%; Kaplanove-Meierove odhady)
|
1. rok
|
| n/a
| 79% (71-87)
| 71% (55-87)
| 29% (3-56)
| 32% (8-56)
|
2. rok
|
| n/a
| 60% (50-70)
| 41% (21-60)
| 10% (0-28)
| 24% (2-47)
|
Cytogenetická odpoveďc (%)
|
|
|
|
|
MCyR (95% CI)
|
| 62% (57-67)
| 40% (33-48)
| 34% (25-44)
| 52% (37-67)
| 57% (41-71)
|
CCyR (95% CI)
|
| 54% (48-59)
| 33% (26-41)
| 27% (19-36)
| 46% (31-61)
| 54% (39-69)
|
Prežívanie (%; Kaplanove-Meierove odhady)
|
Bez progresie
1. rok
|
|
91% (88-94)
|
64% (57-72)
|
35% (25-45)
|
14% (3-25)
|
21% (9-34)
|
2. rok
|
| 80% (75-84)
| 46% (38-54)
| 20% (11-29)
| 5% (0-13)
| 12% (2-23)
|
Celkovo
|
|
|
|
|
|
|
1. rok
|
| 97% (95-99)
| 83% (77-89)
| 48% (38-59)
| 30% (14-47)
| 35% (20-51)
|
2. rok
|
| 94% (91-97)
| 72% (64-79)
| 38% (27-50)
| 26% (10-42)
| 31% (16-47)
|
Údaje uvedené v tabuľke sú zo štúdií so začiatočnou dávkou 70 mg dvakrát denne. Informácie o odporúčanej začiatočnej dávke pozri v časti 4.2.
a Čísla uvedené tučným písmom sú výsledky primárnych koncových ukazovateľov.
b Kritériá hematologickej odpovede (všetky odpovede boli potvrdené po 4 týždňoch): veľká hematologická odpoveď: (MaHR) = úplná hematologická odpoveď (CHR) + žiadna prítomnosť leukémie (NEL).
CHR (chronická CML): WBC ≤ zdravotníckeho zariadenia ULN, trombocyty < 450 000/mm
3, bez blastov alebo promyelocytov v periférnej krvi, < 5% myelocytov plus metamyelocyty v periférnej krvi, bazofily v periférnej krvi < 20% a žiadne extramedulárne postihnutie.
CHR (pokročilá CML/Ph+ ALL): WBC ≤ ULN v danom zariadení, ANC ≥ 1 000/mm3, trombocyty ≥ 100 000/mm3, bez blastov alebo promyelocytov v periférnej krvi, blasty v kostnej dreni ≤ 5 %, < 5 % myelocytov plus metamyelocytov v periférnej krvi, bazofily v periférnej krvi < 20 % a žiadne extramedulárne postihnutie.
NEL: rovnaké kritériá ako pre CHR, ale ANC ≥ 500/mm3 a < 1 000/mm3 alebo trombocyty ≥ 20 000/mm3 a ≤ 100 000/mm3.
c Kritériá cytogenetickej odpovede: úplná (0 % Ph+ metafázy) alebo čiastočná (> 0 % – 35 %). MCyR (0 % – 35 %) zahŕňa úplné aj čiastočné odpovede.
n/a = neaplikovateľné; CI = interval spoľahlivosti; ULN = horná hranica referenčného rozpätia.
Výsledok u pacientov s transplantáciou kostnej drene po liečbe dasatinibom nie je úplne zhodnotený.
Klinické štúdie fázy III u pacientov s CML v chronickej, akcelerovanej alebo myeloidnej blastovej fáze aPh+ ALL, ktorí boli rezistentní alebo intolerantní voči imatinibuDve randomizované, otvorené štúdie sa vykonali na zhodnotenie účinnosti dasatinibu podávaného jedenkrát denne v porovnaní s dasatinibom podávaným dvakrát denne. Výsledky uvedené nižšie sú založené na minimálne dvojročnom a sedemročnom následnom sledovaní po začatí liečby dasatinibom.
1. štúdiaV štúdii s chronickou fázou CML bola MCyR primárnym koncovým ukazovateľom u pacientov rezistentných na imatinib. MCyR bola hlavným sekundárnym koncovým ukazovateľom pri celkovej dennej dávke u pacientov rezistentných na imatinib. Ďalšie sekundárne koncové ukazovatele zahŕňali trvania MCyR, PFS a celkového prežitia. Z celkového počtu 670 pacientov, z ktorých bolo 497 rezistentných na imatinib, boli pacienti v skupinách randomizovaní na dasatinib v dávke 100 mg jedenkrát denne, 140 mg jedenkrát denne, 50 mg dvakrát denne alebo 70 mg dvakrát denne. Medián trvania liečby všetkých pacientov stále liečených s minimálne 5-ročným následným sledovaním (n=205) bol 59 mesiacov (rozpätie 28 – 66 mesiacov). Medián trvania liečby všetkých pacientov po 7- ročnom následnom sledovaní bol 29,8 mesiaca (rozpätie < 1 – 92,9 mesiaca).
Účinnosť sa dosiahla vo všetkých skupinách liečených dasatinibom v dávkovacej schéme jedenkrát denne dokazujúc porovnateľnú účinnosť (nie horšiu) dávkovacej schémy dvakrát denne primárneho koncového ukazovateľa účinnosti (rozdiel v MCyR 1,9 %, 95 % interval spoľahlivosti [-6,8 % – 10,6 %]); schéma dávkovania 100 mg jedenkrát denne však potvrdila zlepšenú bezpečnosť a znášanlivosť. Výsledky účinnosti sú uvedené v tabuľkách 12 a 13.
Tabuľka 12: Účinnosť dasatinibu v štúdii fázy III optimalizácie dávky: rezistencia alebo intolerancia na imatinib, chronická fáza CML (2-ročné výsledky)aVšetci pacienti
| n=167
|
Pacienti rezistentní na imatinib
| n=124
|
Pomer hematologickej odpovedeb (%) (95% CI)
|
|
CHR
| 92% (86–95)
|
Cytogenická odpoveďc(%) (95% CI)
|
|
MCyR
Všetci pacienti
Pacienti rezistentní na imatinib
CCyR
Všetci pacienti
Pacienti rezistentní na imatinib
|
63% (56–71)
59% (50–68)
50% (42–58)
44% (35–53)
|
Veľká molekulárna odpoveď u pacientov, ktorí dosiahli CCyRd (%) (95% CI)
|
Všetci pacienti
| 69% (58–79)
|
Pacienti rezistentní na imatinib
| 72% (58–83)
|
a Výsledky hlásené pri odporúčanej začiatočnej dávke 100 mg jedenkrát denne.
b Kritéria hematologickej odpovede (všetky odpovede potvrdené po 4 týždňoch): Kompletná hematologická odpoveď (CHR) (chronická CML): WBC ≤ ULN zdravotníckeho zariadenia, trombocyty < 450 000/mm
3, žiadne blasty alebo promyelocyty v periférnej krvi, <5 % myelocytov plus metamyelocytov v periférnej krvi, bazofily v periférnej krvi < 20 % a žiadne extramedulárne postihnutia.
c Kritéria cytogenetickej odpovede: úplná (0 % Ph+ metafáza) alebo čiastočná (> 0 %–35 %). MCyR (0 %–35 %) zahŕňa úplné aj čiastočné odpovede.
d Kritéria veľkej molekulárnej odpovede: Definované ako BCR-ABL/kontrola transkriptov ≤ 0,1 % pomocou RQ-PCR vo vzorkách periférnej krvi.
Tabuľka 13: Dlhodobá účinnosť dasatinibu v štúdii fázy 3 optimalizácie dávky: rezistencia alebo intolerancia na imatinib, pacienti s chronickou fázou CMLaMinimálne obdobie následného sledovania
| 1 rok
| 2 roky
| 5 rokov
| 7 rokov
|
Veľká molekulárna odpoveď
|
|
|
|
|
Všetci pacienti
| NA
| 37% (57/154)
| 44% (71/160)
| 46% (73/160)
|
Pacienti rezistentní na imatinib
| NA
| 35% (41/117)
| 42% (50/120)
| 43% (51/120)
|
Pacienti intolerantní na imatinib
| NA
| 43% (16/37)
| 53% (21/40)
| 55% (22/40)
|
Prežívanie bez progresie ochoreniab
|
Všetci pacienti
| 90% (86; 95)
| 80% (73; 87)
| 51% (41; 60)
| 42% (33; 51)
|
Pacienti rezistentní na imatinib
| 88% (82; 94)
| 77% (68; 85)
| 49% (39; 59)
| 39% (29; 49)
|
Pacienti intolerantní na imatinib
| 97% (92; 100)
| 87% (76; 99)
| 56% (37; 76)
| 51% (32; 67)
|
Celkové prežívanie
|
|
|
|
|
Všetci pacienti
| 96% (93; 99)
| 91% (86; 96)
| 78% (72; 85)
| 65% (56; 72)
|
Pacienti rezistentní na imatinib
| 94% (90; 98)
| 89% (84; 95)
| 77% (69; 85)
| 63% (53; 71)
|
Pacienti intolerantní na imatinib
| 100% (100; 100)
| 95% (88; 100)
| 82% (70; 94)
| 70% (52; 82)
|
a Výsledky hlásené pri odporúčanej začiatočnej dávke 100 mg jedenkrát denne.
b Progresia bola definovaná ako zvýšenie počtu WBC, strata CHR alebo MCyR, ≥ 30 % zvýšenie v Ph+ metafáze, potvrdená AP/BP ochorenia alebo smrť. PFS bolo analyzované na princípe úmyslu liečiť (intent-to-treat) a pacienti boli následne sledovaní do udalosti vrátane dodatočnej liečby.
Na základe Kaplanových-Meierových odhadov bol pomer pacientov liečených dasatinibom v dávke 100 mg jedenkrát denne, ktorí si udržali MCyR počas 18 mesiacov 93 % (95 % CI: [88 % – 98 %]).
Účinnosť bola tiež hodnotená u pacientov, ktorí boli intolerantní na imatinib. V tejto populácii pacientov, ktorí užívali 100 mg jedenkrát denne bola MCyR dosiahnutá u 77 % a CCyR u 67 %.
2. štúdiaV štúdii s pokročilou fázou CML a Ph+ ALL bola MaHR primárnym koncovým ukazovateľom. Spolu 611 pacientov bolo randomizovaných buď do skupiny s dasatinibom v dávke 140 mg jedenkrát denne alebo do skupiny s dasatinibom 70 mg dvakrát denne. Medián trvania liečby bol približne 6 mesiacov (rozsah 0,03 – 31 mesiacov).
Dávkovacia schéma jedenkrát denne preukázala porovnateľnú účinnosť (neinferioritu) s dávkovacou schémou dvakrát denne z hľadiska primárneho koncového ukazovateľa účinnosti (rozdiel v MaHR 0,8 %, 95 % interval spoľahlivosti [-7,1 % – 8,7 %]); dávkovacia schéma 140 mg jedenkrát denne však preukázala lepšiu bezpečnosť a znášanlivosť. Miery odpovede sú uvedené v tabuľke 14.
Tabuľka 14: Účinnosť dasatinibu v štúdii fázy III na optimalizáciu dávky: pokročilá fáza CML a Ph+ ALL (výsledky po 2 rokoch)a
| Akcelerovaná fáza
(n= 158)
| Myeloidná blastová fáza
(n= 75)
| Lymfoidná blastová fáza
(n= 33)
| Ph+ALL
(n= 40)
|
MaHRb
(95% CI)
| 66%
(59-74)
| 28%
(18-40)
| 42%
(26-61)
| 38%
(23-54)
|
CHRb
(95% CI)
| 47%
(40-56)
| 17%
(10-28)
| 21%
(9-39)
| 33%
(19-49)
|
NELb
(95% CI)
| 19%
(13-26)
| 11%
(5-20)
| 21%
(9-39)
| 5%
(1-17)
|
MCyRc
(95% CI)
| 39%
(31-47)
| 28%
18-40)
| 52%
(34-69)
| 70%
(54-83)
|
CCyR
(95% CI)
| 32%
(25-40)
| 17%
(10-28)
| 39%
(23-58)
| 50%
(34-66)
|
a Výsledky hlásené pri odporúčanej začiatočnej dávke 140 mg jedenkrát denne (pozri časť 4.2).
b Kritériá hematologickej odpovede (všetky odpovede boli potvrdené po 4 týždňoch): veľká hematologická odpoveď: (MaHR) = úplná hematologická odpoveď (CHR) + žiadna prítomnosť leukémie (NEL).
CHR: WBC ≤ ULN v danom zariadení, ANC ≥ 1 000/mm
3, trombocyty ≥ 100 000/mm
3, žiadne blasty alebo promyelocyty v periférnej krvi, blasty v kostnej dreni ≤ 5 %, < 5 % myelocytov plus metamyelocytov v periférnej krvi, bazofily v periférnej krvi < 20 % a žiadne extramedulárne postihnutie.
NEL: rovnaké kritériá ako pre CHR, ale ANC ≥ 500/mm
3 a < 1 000/mm
3 alebo trombocyty ≥ 20 000/mm
3 a ≤ 100 000/mm
3.
c MCyR zahŕňa úplné (0 % Ph+ metafáza) aj čiastočné (> 0 % – 35 %) odpovede.
CI = interval spoľahlivosti; ULN = horná hranica referenčného rozpätia.
U pacientov s akcelerovanou fázou CML liečených s dávkovacím režimom 140 mg jedenkrát denne sa nedosiahol medián trvania MaHR a medián celkového prežívania a medián PFS bol 25 mesiacov.
U pacientov s myeloidnou blastovou fázou CML liečených s dávkovacím režimom 140 mg jedenkrát denne bol medián trvania MaHR 8 mesiacov, medián PFS bol 4 mesiace a medián celkového prežívania bol 8 mesiacov. U pacientov s lymfoidnou blastovou fázou CML liečených s dávkovacím režimom 140 mg jedenkrát denne bol medián trvania MaHR 5 mesiacov, medián PFS bol 5 mesiacov a medián celkového prežívania bol 11 mesiacov.
Medián trvania MaHR u pacientov s Ph+ALL liečených s dávkovacím režimom 140 mg jedenkrát denne bol 5 mesiacov, medián prežívania bez progresie (PFS) bol 4 mesiace a medián celkového prežívania bol 7 mesiacov.
Pediatrická populáciaPediatrickí pacienti s CMLZo 130 pacientov s chronickou fázou CML (CML‑CP) liečených v dvoch pediatrických štúdiách, v otvorenom, nerandomizovanom klinickom skúšaní s nastavovaním dávky I. fázy a v otvorenom, nerandomizovanom klinickom skúšaní II. fázy, bolo 84 pacientov (výhradne z klinického skúšania II. fázy) novodiagnostikovaných s CML‑CP a 46 pacientov (17 z klinického skúšania I. fázy a 29 z klinického skúšania II. fázy) bolo rezistentných alebo intolerantných na predchádzajúcu liečbu imatinibom. Deväťdesiatsedem zo 130 pediatrických pacientov s CML-CP sa liečilo tabletami dasatinibu v dávke 60 mg/m
2 jedenkrát denne (maximálna dávka 100 mg jedenkrát denne u pacientov s vysokým BSA). Pacienti sa liečili až do progresie ochorenia alebo do neakcetovateľnej toxicity.
Kľúčové koncové ukazovatele účinnosti boli: kompletná cytogenetická odpoveď (CCyR), veľká cytogenetická odpoveď (MCyR) a veľká molekulárna odpoveď (MMR). Výsledky sú uvedené v tabuľke 15.
Tabuľka 15: Účinnosť dasatinibu u pediatrických pacientov s CML-CP
Kumulatívna odpoveď v priebehu času s obdobím minimálneho následného sledovania
| 3 mesiace
| 6 mesiacov
| 12mesiacov
| 24mesiacov
|
CCyR
|
|
|
|
|
(95%CI)
|
|
|
|
|
Novodiagnostikovaní
| 43,1%
| 66,7%
| 96,1%
| 96,1%
|
(N = 51)a
| (29,3; 57,8)
| (52,1; 79,2)
| (86,5; 99,5)
| (86,5; 99,5)
|
Predtým imatinib
| 45,7%
| 71,7%
| 78,3%
| 82,6%
|
(N = 46)b
| (30,9; 61,0)
| (56,5; 84,0)
| (63,6; 89,1)
| (68,6; 92,2)
|
MCyR
|
|
|
|
|
(95%CI)
|
|
|
|
|
Novo diagnostikovaní
| 60,8%
| 90,2%
| 98,0%
| 98,0%
|
(N = 51)a
| (46,1; 74,2)
| (78,6; 96;7)
| (89,6; 100)
| (89,6; 100)
|
Predtým imatinib
| 60,9%
| 82,6%
| 89,1%
| 89,1%
|
(N = 46)b
| (45,4; 74.9)
| (68,6; 92,2)
| (76,4; 96,4)
| (76,4; 96,4)
|
MMR
|
|
|
|
|
(95%CI)
|
|
|
|
|
Novo diagnostikovaní
| 7,8%
| 31,4%
| 56,9%
| 74,5%
|
(N = 51)a
| (2,2; 18,9)
| (19,1; 45,9)
| (42,2; 70,7)
| (60,4; 85,7)
|
Predtým imatinib
| 15,2%
| 26,1%
| 39,1%
| 52,2%
|
(N = 46)b
| (6,3; 28,9)
| (14,3; 41,1)
| (25,1; 54,6)
| (36,9; 67,1)
|
a Pacienti z pediatrickej štúdie II. fázy s novodiagnostikovanou CML-CP, ktorí užívali liekovú formu perorálne tablety
b Pacienti z pediatrických štúdií I. fázy a II. fázy rezistentní alebo intolerantní na imatinib s CML-CP, ktorí užívali perorálnu tabletovú formu
V pediatrickej štúdii I. fázy po minimálne 7 rokoch následného sledovania bol u 17 pacientov rezistentných alebo intolerantných na imatinib s CML-CP medián trvania PFS 53,6 mesiaca a miera OS bola 82,4 %.
V pediatrickej štúdii II. fázy bola u pacientov, ktorí užívali liekovú formu tablety odhadnutá 24-mesačná miera PFS u 51 pacientov s novodiagnostikovanou CML-CP 94,0 % (82,6; 98,0) a 81,7 % (61,4; 92,0) u 29 pacientov s CML-CP s rezistenciou/intoleranciou na imatinib. Po 24 mesiacoch následného sledovania bolo OS u novodiagnostikovaných pacientov 100 % a 96,6 % u pacientov rezistentných alebo intolerantných na imatinib.
V pediatrickej štúdii II. fázy progredoval do blastovej fázy CML 1 novodiagnostikovaný pacient a 2 pacienti rezistentní alebo intolerantní na imatinib.
33 novodiagnostikovaných pediatrických pacientov s CML-CP dostalo dasatinib prášok na perorálnu suspenziu v dávke 72 mg/m
2. Táto dávka predstavuje o 30 % nižšiu expozíciu v porovnaní s odporúčanou dávkou. U týchto pacientov boli po 12 mesiacoch CCyR: 87,9 % [95 % CI: (71,8-96,6)] a MMR: 45,5 % [95 % CI: (28,1-63,6)].
U pediatrických pacientov s CML-CP, liečených dasatinibom, predtým vystavených expozícii imatinibu, boli na konci liečby detegované mutácie: T315A, E255K a F317L. E255K a F317L však boli detegované aj pred liečbou. Na konci liečby neboli detegované žiadne mutácie u novodiagnostikovaných pacientov s CML-CP.
Pediatrickí pacienti s ALLÚčinnosť dasatinibu v kombinácii s chemoterapiou sa hodnotila v pivotnej štúdii s pediatrickými pacientmi vo veku od jedného roka s novodiagnostikovanou ALL s Ph+.
V tejto multicentrickej, historicky kontrolovanej štúdii fázy II s dasatinibom pridaným k štandardnej chemoterapii dostávalo 106 pediatrických pacientov s novodiagnostikovanou ALL s Ph+, z ktorých 104 pacientov malo potvrdenú ALL s Ph+, dasatinib v dennej dávke 60 mg/m
2 s nepretržitou schémou podávania počas až 24 mesiacov v kombinácii s chemoterapiou. Osemdesiatdva pacientov dostávalo výlučne tablety dasatinibu a 24 pacientov dostalo dasatinib prášok na perorálnu suspenziu minimálne jedenkrát, 8 z nich dostávalo výlučne dasatinib prášok na perorálnu suspenziu. Základný režim chemoterapie bol rovnaký ako v skúšaní AIEOP-BFM ALL 2000 (protokol chemoterapeutického štandardu chemoterapie s viacerými látkami). Primárnym koncovým ukazovateľom účinnosti bolo trojročné prežívanie bez udalosti (EFS), ktoré bolo 65,5 % (55,5; 73,7).
Miera negativity minimálnej reziduálnej choroby (MRD, minimal residual disease) hodnotená pomocou prestavby Ig/TCR bola na konci konsolidácie 71,7 % u všetkých liečených pacientov. Keď táto miera vychádzala z údajov o 85 pacientoch s hodnotiteľnými posudkami Ig/TCR, odhad bol 89,4 %. Miery negativity MRD na konci indukcie a konsolidácie podľa meraní pomocou prietokovej cytometrie boli 66,0 % a 84,0 %, v uvedenom poradí.
5.2 Farmakokinetické vlastnosti
Farmakokinetika dasatinibu sa hodnotila u 229 dospelých zdravých jedincov a u 84 pacientov.
AbsorpciaDasatinib sa u pacientov po perorálnom podaní rýchlo vstrebáva, pričom maximálne koncentrácie sa dosiahnu medzi 0,5 – 3 hodinami. Po perorálnom podaní je vzostup priemernej expozície (AUCτ) približne úmerný prírastku dávky v celom rozmedzí dávok od 25 mg do 120 mg dvakrát denne. U pacientov je celkový priemerný terminálny polčas dasatinibu približne 5 – 6 hodín.
Údaje od zdravých jedincov, ktorým sa podala jednorazová 100 mg dávka dasatinibu 30 minút po jedle s vysokým obsahom tuku, poukázali na 14 % zvýšenie priemernej hodnoty AUC dasatinibu. Požitie jedla s nízkym obsahom tuku 30 minút pred užitím dasatinibu viedlo k 21 % zvýšeniu priemernej hodnoty AUC dasatinibu. Pozorované vplyvy jedla nepredstavujú klinicky významné zmeny v expozícii.
DistribúciaU pacientov má dasatinib veľký zdanlivý distribučný objem (2 505 l), koeficient zmeny (CV% 93 %), čo svedčí o tom, že liek sa v rozsiahlej miere distribuuje v extravaskulárnom priestore. Pri klinicky významných koncentráciách dasatinibu bola väzba na plazmatické bielkoviny približne 96 % na základe
in vitro experimentov.
BiotransformáciaDasatinib sa u ľudí v rozsiahlej miere metabolizuje, pričom do tvorby metabolitov sú zapojené viaceré enzýmy. U zdravých jedincov, ktorým bolo podaných 100 mg dasatinibu označeného [
14C], predstavoval nezmenený dasatinib 29 % cirkulujúcej rádioaktivity v plazme. Plazmatická koncentrácia a
in vitro meraná aktivita svedčia o tom, že nie je pravdepodobné, že metabolity dasatinibu majú významnú úlohu v pozorovanej farmakológii lieku. CYP3A4 je hlavným enzýmom zodpovedným za metabolizmus dasatinibu.
ElimináciaPriemerný terminálny polčas dasatinibu je 3 hodiny až 5 hodín. Priemerný zdanlivý perorálny klírens je 363,8 l/h (CV% 81,3 %).
Prevláda vylučovanie stolicou, prevažne vo forme metabolitov. Po jednorazovej perorálnej dávke dasatinibu označeného [
14C] sa približne 89 % dávky vylúčilo do 10 dní, pričom 4 % rádioaktivity sa zistili v moči a 85 % rádioaktivity sa zistilo v stolici. Nezmenený dasatinib predstavoval 0,1 % dávky v moči a 19 % dávky v stolici, pričom zvyšok dávky bol vo forme metabolitov.
Porucha funkcie pečene a obličiekVplyv poruchy funkcie pečene na farmakokinetiku jednorazovej dávky dasatinibu bol hodnotený u 8 jedincov so stredne závažnou poruchou funkcie pečene, ktorí užili dávku 50 mg, a u 5 jedincov so závažnou poruchou funkcie pečene, ktorí užili dávku 20 mg, v porovnaní so zodpovedajúcimi zdravými jedincami, ktorí užili dávku 70 mg dasatinibu. Priemerná C
max dasatinibu upravená na dávku 70 mg sa znížila o 47 % a AUC o 8 % u jedincov so stredne závažnou poruchou funkcie pečene v porovnaní s osobami s normálnou funkciou pečene. U jedincov so závažnou poruchou funkcie pečene sa priemerná C
max upravená na dávku 70 mg znížila o 43 % a AUC o 28 % v porovnaní s osobami s normálnou funkciou pečene (pozri časti 4.2 a 4.4).
Dasatinib a jeho metabolity sú v minimálnej miere vylučované obličkami.
Pediatrická populáciaFarmakokinetika dasatinibu sa hodnotila u 104 pediatrických pacientov s leukémiou alebo solídnymi nádormi (72 dostalo tabletovú liekovú formu a 32 dostalo prášok na perorálnu suspenziu).
V pediatrickej farmakokinetickej štúdii sa u 21 pacientov s CP-CML a u 16 pacientov s ALL s Ph+ zdá byť expozícia dasatinibu v normalizovanej dávke podobná (C
avg, C
min a C
max).
Farmakokinetika tabletovej liekovej formy dasatinibu sa hodnotila u 72 pediatrických pacientov s recidívou leukémie alebo s refraktérnou leukémiou alebo so solídnymi nádormi s perorálnou dávkou v rozsahu od 60 do 120 mg/m
2 jedenkrát denne a 50 až 110 mg/m
2 dvakrát denne. Údaje dvoch štúdii boli spojené a potvrdili, že sa dasatinib rýchlo absorboval. Pri všetkých hladinách dávok a vekových skupinách sa pozoroval priemerný T
max medzi 0,5 a 6 hodinami a priemerný polčas v rozsahu od 2 do 5 hodín. PK dasatinibu vykazovala úmernosť k dávke so zvýšením expozície v súvislosti s dávkou, ktorá bola pozorovaná u pediatrických pacientov. Medzi deťmi a dospievajúcimi sa nepozorovali žiadne signifikantné rozdiely v PK dasatinibu. Pri rôznych hladinách dávok sa geometrické priemery C
max normalizovanej dávky dasatinibu, AUC (0-T) a AUC (INF) zdali byť u detí a dospievajúcich podobné. PPK simulácia na základe modelu predpovedala, že odporúčané dávkovanie pre tablety odstupňované podľa telesnej hmotnosti a opísané v časti 4.2 poskytne podľa predpokladu expozíciu podobnú tablete s dávkou 60 mg/m
2. Tieto údaje sa majú zohľadniť, ak pacienti menia liečbu z tabliet na prášok na perorálnu suspenziu alebo naopak.
5.3 Predklinické údaje o bezpečnosti
Profil predklinickej bezpečnosti dasatinibu sa hodnotil v sérii štúdií
in vitro a
in vivo na myšiach, potkanoch, opiciach a králikoch.
Primárna toxicita sa vyskytla v gastrointestinálnom, hematopoetickom a lymfoidnom systéme. Gastrointestinálna toxicita predstavovala obmedzenie pre dávku u potkanov a opíc, keďže črevo bolo stabilne hlavným cieľovým orgánom. U potkanov boli minimálne až mierne poklesy v parametroch erytrocytov sprevádzané zmenami kostnej drene; u opíc sa podobné zmeny vyskytli s nižšou incidenciou. Lymfoidná toxicita u potkanov pozostávala z lymfoidnej deplécie lymfatických uzlín, sleziny a týmusu a zníženej hmotnosti lymfoidných orgánov. Zmeny v gastrointestinálnom, hematopoetickom a lymfoidnom systéme boli reverzibilné po ukončení liečby.
Obličkové zmeny u opíc liečených až 9 mesiacov sa obmedzovali na zvýšenie prirodzenej mineralizácie v obličkách. Kožné krvácanie bolo pozorované v štúdii akútnej jednorazovej perorálnej dávky u opíc, ale nebolo pozorované v štúdiách opakovanej dávky ani u opíc ani u potkanov. U potkanov dasatinib inhiboval agregáciu trombocytov
in vitro a predĺžil čas krvácania z kutikuly
in vivo, ale nevyvolal spontánne krvácanie.
Aktivita dasatinibu
in vitro v teste hERG a teste na Purkyňových vláknach svedčí o možnom predĺžení repolarizácie srdcových komôr (QT interval). V štúdii s jednorazovou dávkou
in vivo na opiciach, ktoré boli pri vedomí a sledované telemetricky, však neboli žiadne zmeny v QT intervale, ani v tvare vlny na EKG.
Dasatinib nebol mutagénny v testoch
in vitro na bakteriálnych bunkách (Amesov test) a nebol genotoxický v teste
in vivo na potkaních mikronukleoch. Dasatinib mal klastogénny účinok
in vitro na deliace sa ovariálne bunky čínskeho škrečka (CHO).
Dasatinib neovplyvnil obvyklú samčiu alebo samičiu fertilitu potkanov v konvenčnej štúdii fertility a v štúdii včasného embryofetálneho vývoja, ale indukoval embryoletalitu v dávkach blížiacich sa klinickej expozícii u ľudí. V štúdiách embryofetálneho vývoja podobne spôsobil dasatinib embryoletalitu, ktorá bola spojená so zníženou veľkosťou vrhu u potkanov, ako aj zmeny skeletu plodu u potkanov aj králikov. Tieto účinky sa vyskytovali pri dávkach, ktoré nespôsobovali toxické prejavy u matky, naznačujúc, že dasatinib je látka so selektívnou toxicitou na reprodukciu od uhniezdenia do dokončenia organogenézy.
U myší vyvolal dasatinib imunosupresiu, ktorá súvisela s dávkou a bola účinne zvládnutá znížením dávky a/alebo zmenami dávkovacej schémy. Dasatinib mal fototoxický potenciál v teste fototoxicity
in vitro zameranom na prenikanie neutrálnej červene do myších fibroblastov. Dasatinib sa považoval za nefototoxický
in vivo po jednorazovom perorálnom podaní samiciam bezsrstej myši v expozíciách zodpovedajúcich nanajvýš 3-násobnej expozícii u ľudí po podaní odporúčanej terapeutickej dávky (vychádzajúcej z AUC).
V dvojročnej štúdii karcinogenity sa potkanom podávali perorálne dávky dasatinibu 0,3; 1 a 3 mg/kg/deň. Najvyššia dávka viedla k plazmatickej expozícii (AUC) vo všeobecnosti ekvivalentnej expozícii u ľudí pri odporúčanom rozsahu začiatočných dávok od 100 mg do 140 mg denne. Zistilo sa štatisticky významné zvýšenie celkovej incidencie skvamocelulárnych karcinómov a papilómov v maternici a krčku maternice u samičiek s vysokou dávkou a adenómu prostaty u samcov s nízkou dávkou. Významnosť nálezov zo štúdie karcinogenity na potkanoch pre ľudí nie je známa.
6. FarmaceuticKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tabletyMonohydrát laktózy (200)
Mikrokryštalická celulóza (101 a 102)
Sodná soľ kroskarmelózy
Hydroxypropylcelulóza (MW 80 000)
Stearan horečnatý
Obal tabletyMonohydrát laktózy
Hypromelóza (15 mPas)
Oxid titaničitý (E171)
Triacetín
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
oPA/Al/PVC/Al blistre
HDPE nádoba s polypropylénovým (PP) detským bezpečnostným uzáverom.
Dasatinib Zentiva 50 mg a 70 mg filmom obalené tabletyŠkatule obsahujúce 60 filmom obalených tabliet v blistroch alebo škatule obsahujúce 60 x 1 filmom obalenú tabletu v blistroch s jednotlivými dávkami. Škatule obsahujúce nádoby so 60 filmom obalenými tabletami.
Dasatinib Zentiva 100 mg filmom obalené tabletyŠkatule obsahujúce 30 filmom obalených tabliet v blistroch alebo škatule obsahujúce 30 x 1 filmom obalenú tabletu v blistroch s jednotlivými dávkami. Škatule obsahujúce nádoby s 30 filmom obalenými tabletami.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Filmom obalené tablety pozostávajú z jadra tablety, ktoré je obklopené filmovým obalom, aby sa zabránilo vystaveniu zdravotníckych pracovníkov liečivu. Pri manipulácii s tabletami, ktoré sú neúmyselne rozdrvené alebo zlomené, sa na náležitú likvidáciu odporúča použiť latexové alebo nitrilové rukavice, aby sa minimalizovalo riziko kožnej expozície.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRáCII
Zentiva, k. s., U kabelovny 130, 102 37 Praha, Česká republika
8. REGISTRAČNÉ ČÍSLA
Dasatinib Zentiva 50 mg filmom obalené tablety: 44/0296/19-S
Dasatinib Zentiva 70 mg filmom obalené tablety: 44/0297/19-S
Dasatinib Zentiva 100 mg filmom obalené tablety: 44/0298/19-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRáCIE
10. DÁTUM REVíZIE TEXTU
09/2019