
traktu
Príznaky ako bolesť a citlivosť brucha, horúčka, pretrvávajúca zápcha, hnačka s neutropéniou alebo
bez nej, môžu byť prvotnými prejavmi závažnej gastrointestinálnej toxicity a musia sa bezodkladne
vyhodnotiť a náležite liečiť. Môže byť potrebné liečbu kabazitaxelom odložiť alebo ukončiť.
Riziko nauzey, vracania, hnačky a dehydratácie
Ak sa u pacientov po podaní kabazitaxelu vyskytne hnačka, môžu byť liečení bežne používanými liekmi proti hnačke. Je potrebné urobiť príslušné opatrenia na rehydratáciu pacientov. Častejšie sa
hnačka môže vyskytnúť u pacientov, ktorí absolvovali rádioterapiu v oblasti brucha a panvy.
Dehydratácia je častejšia u pacientov vo veku 65 rokov alebo starších. Je potrebné urobiť príslušné opatrenia na rehydratáciu pacientov a monitorovať a upravovať hladiny elektrolytov v sére,
predovšetkým draslíka. Pri hnačke ≥ 3. stupňa môže byť potrebné liečbu odložiť alebo znížiť dávku
(pozri časť 4.2). Ak sa u pacientov vyskytla nauzea alebo vracanie, môžu byť liečený bežne používanými antiemetikami.
Riziko závažných gastrointestinálnych reakcií
U pacientov liečených kabazitaxelom boli hlásené gastrointestinálne (GI) krvácanie a perforácia, ileus, kolitída, vrátane fatálnych prípadov (pozri časť 4.8). Opatrnosť sa odporúča najmä pri liečbe pacientov
s rizikom vývoja gastrointestinálnych komplikácií: u pacientov s neutropéniou, u starších pacientov,
u pacientov súčasne užívajúcich NSAID, s antiagregačnou alebo antikoagulačnou liečbou
a u pacientov, ktorí majú v anamnéze rádioterapiu panvy alebo gastrointestinálne ochorenie ako je ulcerácia alebo GI krvácanie.
Periférnaneuropatia
U pacientov liečených kabazitaxelom sa pozorovali prípady periférnej neuropatie, periférnej senzorickej neuropatie (napr. parestézia, dyzestézia) a periférnej motorickej neuropatie. Pacientov liečených kabazitaxelom je potrebné poučiť, aby pred pokračovaním liečby informovali svojho lekára o výskyte príznakov neuropatie ako sú bolesť, pálenie, brnenie, necitlivosť alebo slabosť. Lekár má pred každou liečbou posúdiť prítomnosť alebo zhoršenie neuropatie. Liečba sa musí odložiť až kým sa príznaky nezlepšia. Ak pretrváva periférna neuropatia > 2. stupňa, dávka kabazitaxelu sa má znížiť
z 25 mg/m2 na 20 mg/m2 (pozri časť 4.2).
Anémia
U pacientov liečených kabazitaxelom sa pozorovala anémia (pozri časť 4.8). Pred začatím liečby
kabazitaxelom sa má skontrolovať hemoglobín a hematokrit a zistiť, či pacienti vykazujú prejavy
a príznaky anémie alebo straty krvi. U pacientov s hemoglobínom < 10 g/dl sa odporúča opatrnosť
a v klinicky indikovaných prípadoch sa majú urobiť vhodné opatrenia.
Riziko renálnehozlyhania
Prípady poruchy funkcie obličiek boli hlásené v súvislosti so sepsou, závažnou dehydratáciou spôsobenou hnačkou, vracaním a obštrukčnou uropatiou. Bolo pozorované zlyhanie obličiek, vrátane fatálnych prípadov. V prípade výskytu je potrebné pacientov intenzívne liečiť a urobiť príslušné opatrenia na identifikáciu príčiny.
Počas liečby kabazitaxelom sa má zabezpečiť adekvátna hydratácia. Pacient musí byť poučený, aby ihneď oznámil výraznú zmenu v dennom objeme moču. Koncentráciu kreatinínu v sére je nutné
zmerať na začiatku liečby, pri každom krvnom obraze a vždy, keď pacient oznámi zmenu v objeme
moču. Liečba kabazitaxelom sa má ukončiť v prípade akéhokoľvek zhoršenia funkcie až zlyhania obličiek ≥ 3. stupeň podľa CTCAE 4.0.
Respiračnéporuchy
Boli hlásené prípady intersticiálnej pneumónie/pneumonitídy a intersticiálneho ochorenia pľúc, ktoré môžu byť spojené s fatálnymi následkami (pozri časť 4.8).
Pokiaľ sa rozvinú nové alebo sa zhoršia súčasné pľúcne príznaky, pacienti majú byť starostlivo
sledovaní, ihneď vyšetrení a vhodným spôsobom liečení. Odporúča sa prerušiť liečbu kabazitaxelom do tej doby, kým nebude stanovená diagnóza. Včasné použitie podporných opatrení môže pomôcť
zlepšiť stav. Prínosy opätovného nasadenia liečby kabazitaxelom sa musia starostlivo zhodnotiť.
R
i
z
i
k
o srdcovej arytmie
Hlásili sa srdcové arytmie, najčastejšie tachykardia a atriálna fibrilácia (pozri časť 4.8).
Staršie osoby
Starší pacienti (≥ 65 rokov) majú zvýšenú pravdepodobnosť výskytu nežiaducich reakcií vrátane neutropénie a febrilnej neutropénie (pozri časť 4.8).
Pacienti s poruchou funkcie pečene
Liečba Cabazitaxelom Fresenius Kabi je kontraindikovaná u pacientov so závažnou poruchou funkcie
pečene (celkový bilirubín > 3-násobok ULN) (pozri časti 4.3 a 5.2).
Dávka sa má znížiť pacientom s miernou poruchou funkcie pečene (celkový bilirubín > 1 až ≤ 1,5-
násobok ULN alebo AST > 1,5-násobok ULN) (pozri časti 4.2 a 5.2).
Interakcie
Je potrebné vyhnúť sa súbežnému podávaniu silných CYP3A inhibítorov, pretože môžu zvýšiť plazmatické koncentrácie kabazitaxelu (pozri časti 4.2 a 4.5). Ak nie je možné vyhnúť sa súbežnému
podávaniu so silným CYP3A inhibítorom, má sa zvážiť starostlivé sledovanie toxicity a zníženie
dávky kabazitaxelu (pozri časti 4.2 a 4.5).
Je potrebné vyhnúť sa súbežnému podávaniu silných CYP3A induktorov, pretože môžu znížiť plazmatické koncentrácie kabazitaxelu (pozri časti 4.2 a 4.5).
Pomocnélátky
Tento liek obsahuje 395 mg etanolu (alkoholu) v 1 ml, čo zodpovedá 39,5 % m/V. Množstvo
v 2,25 ml dávke zodpovedá 23 ml piva alebo 9 ml vína.
Dávka 45 mg tohto lieku podávaná dospelému s telesnou hmotnosťou 70 kg vedie k expozícii
12,7 mg/kg etanolom a môže spôsobiť zvýšenie koncentrácie alkoholu v krvi (blood alcohol concentration, BAC) o približne 2,12 mg/100 ml
4.5 Liekové a iné interakcie
In vitro štúdie ukázali, že kabazitaxel je metabolizovaný predovšetkým prostredníctvom CYP3A
(80 % až 90 %) (pozri časť 5.2).
InhibítoryCYP3A
Opakované podávanie ketokonazolu (400 mg raz denne), silného CYP3A inhibítora, viedlo k 20 %
zníženiu klírensu kabazitaxelu zodpovedajúcemu 25 % nárastu AUC. Preto je nutné vyhnúť sa súbežnému podávaniu silných CYP3A inhibítorov (napr. ketokonazol, itrakonazol, klaritromycín,
indinavir, nefazodón, nelfinavir, ritonavir, sakvinavir, telitromycín, vorikonazol), keďže sa môže
vyskytnúť zvýšenie plazmatických koncentrácií kabazitaxelu (pozri časti 4.2 a 4.4).
Súbežné podávanie aprepitantu, stredne silného CYP3A inhibítora, neovplyvnilo klírens kabazitaxelu.
Induktory CYP3A
Opakované podávanie rifampicínu (600 mg raz denne), silného CYP3A induktora, viedlo k 21 % zvýšeniu klírensu kabazitaxelu zodpovedajúcemu 17 % zníženiu AUC. Preto je nutné vyhnúť sa súbežnému podávaniu silných CYP3A induktorov (napr. fenytoín, karbamazepín, rifampicín, rifabutín, rifapentín, fenobarbital), keďže sa môže vyskytnúť zníženie plazmatických koncentrácií kabazitaxelu (pozri časti 4.2 a 4.4). Pacienti tiež nemajú užívať ľubovník bodkovaný (Hypericum perforatum).
OATP1B1
Kabazitaxel preukázal in vitro inhibíciu transportných proteínov organických aniónových transportných polypeptidov OATP1B1. Riziko interakcie so substrátmi OATP1B1 (napr. statíny,
valsartan, repaglinid) existuje najmä počas trvania infúzie (1 hodina) a až do 20 minút po ukončení infúzie. Pred podaním substrátov OATP1B1 sa odporúča dodržať časový odstup 12 hodín pred
O
č
k
ovania
Podávanie živých alebo atenuovaných vakcín pacientom, ktorí sú imunokompromitovaní chemoterapiou, môže mať za následok závažné alebo fatálne infekcie. U pacientov dostávajúcich kabazitaxel je potrebné zabrániť očkovaniu živými atenuovanými vakcínami. Môžu sa podávať mŕtve alebo inaktivované vakcíny, avšak odpoveď na očkovanie môže byť v tomto prípade znížená.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii údaje o použití kabazitaxelu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu pri maternotoxických dávkach (pozri časť 5.3) a že kabazitaxel prechádza cez placentárnu bariéru (pozri časť 5.3). Rovnako ako aj iné cytostatiká, kabazitaxel môže poškodiť plod u exponovaných gravidných žien.
Gravidným ženám a ženám vo fertilnom veku, ktoré nepoužívajú účinnú antikoncepciu, sa používanie
kabazitaxelu neodporúča.
Dojčenie
Dostupné farmakokinetické údaje u zvierat ukázali, že kabazitaxel a jeho metabolity sa vylučujú do mlieka (pozri časť 5.3). Nie je možné vylúčiť riziko u dojčených detí.
Kabazitaxel sa nemá používať počas dojčenia.
Fertilita
Štúdie na zvieratách ukázali, že kabazitaxel ovplyvňuje reprodukčný systém samcov potkanov a psov
bez akéhokoľvek funkčného účinku na fertilitu (pozri časť 5.3). Avšak, ak sa vezme do úvahy farmakologická aktivita taxánov, ich genotoxický potenciál a účinok niektorých látok z tejto triedy na fertilitu v štúdiách na zvieratách, nie je možné vylúčiť účinok na mužskú fertilitu u ľudí.
Kvôli potenciálnym účinkom na mužské gaméty a potenciálnej expozícii spermy musia muži liečení kabazitaxelom počas liečby a ešte 6 mesiacov po podaní poslednej dávky kabazitaxelu používať účinnú antikoncepciu. Kvôli potenciálnej expozícii spermy musia muži liečení kabazitaxelom počas liečby zabrániť kontaktu druhých osôb s ejakulátom. Mužov treba poučiť, aby sa ešte pred liečbou poradili o možnosti konzervácie spermií.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Kabazitaxel má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje, pretože môže spôsobovať únavu a závraty. Pacientov treba poučiť, aby neviedli vozidlá a neobsluhovali stroje, ak pocítia počas liečby tieto nežiaduce účinky.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Bezpečnosť kabazitaxelu v kombinácii s prednizónom alebo prednizolónom bola hodnotená v 3
randomizovaných, otvorených, kontrolovaných štúdiách (TROPIC, PROSELICA a CARD), celkovo u 1 092 pacientov s metastatickým kastračne rezistentným karcinómom prostaty, ktorí boli liečení dávkou 25 mg/m2 kabazitaxelu raz za 3 týždne. Pacienti dostávali kabazitaxel v mediáne 6 až 7 cyklov.
Frekvencia výskytu nežiaducich reakcií vyplývajúca zo súhrnnej analýzy týchto 3 klinických skúšaní je uvedená nižšie a v tabuľke.
Najčastejšie nežiaduce reakcie všetkých stupňov boli anémia (99,0 %), leukopénia (93,0 %), neutropénia (87,9 %), trombocytopénia (41,1 %), hnačka (42,1 %), únava (25,0 %) a asténia (15,4 %). Najčastejšie nežiaduce reakcie ≥ 3. stupňa vyskytujúce sa u najmenej 5 % pacientov boli neutropénia (73,1 %), leukopénia (59,5 %), anémia (12,0 %), febrilná neutropénia (8,0 %) a hnačka (4,7 %).
Liečba bola kvôli nežiaducim reakciám ukončená u pacientov dostávajúcich kabazitaxel s podobnou
frekvenciou naprieč 3 štúdiami (18,3 % v štúdii TROPIC, 19,5 % v štúdii PROSELICA a 19,8 % v štúdii CARD). Najčastejšími nežiaducimi reakciami (> 1,0 %), ktoré viedli k ukončeniu liečby kabazitaxelom, boli hematúria, únava a neutropénia.
Tabuľkovýzoznam nežiaducichreakciíNežiaduce reakcie rozdelené do tried podľa orgánových systémov MedDRA s uvedením frekvencie ich výskytu sú uvedené v tabuľke 2. V rámci každej skupiny s rovnakou frekvenciou sú nežiaduce reakcie zoradené podľa klesajúcej závažnosti. Intenzita nežiaducich reakcií je odstupňovaná podľa CTCAE 4.0 (stupeň ≥ 3 = G ≥ 3). Frekvencie výskytu sú určené podľa všetkých stupňov a definované ako: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé
(≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000); neznáme (z dostupných údajov).
Tabuľka 2: Hlásené nežiaduce reakcie a hematologické abnormality pri kabazitaxeli v kombinácii
s prednizónom alebo prednizolónom zo súhrnnej analýzy (n = 1 092)
Trieda orgánového
systému
| Nežiaduca reakcia
| Všetky stupne n (%)
| Stupeň > 3
n (%)
|
|
| Veľmi časté
| Časté
| Menej
časté
|
|
Infekcie a nákazy
| neutropenická
infekcia/sepsa*
|
| 48 (4,4)
|
| 42 (3,8)
|
septický šok
|
|
| 10 (0,9)
| 10 (0,9)
|
sepsa
|
| 13 (1,2)
|
| 13 (1,2)
|
celulitída
|
|
| 8 (0,7)
| 3 (0,3)
|
infekcie
močových ciest
|
| 103 (9,4)
|
| 19 (1,7)
|
chrípka
|
| 22 (2,0)
|
| 0
|
cystitída
|
| 22 (2,0)
|
| 2 (0,2)
|
infekcie horných
dýchacích ciest
|
| 23 (2,1)
|
| 0
|
pásový opar
|
| 14 (1,3)
|
| 0
|
kandidóza
|
| 11 (1,0)
|
| 1 (< 0,1)
|
Poruchy krvi
a lymfatického systému
| neutropéniaa*
| 950 (87,9)
|
|
| 790 (73,1)
|
anémiaa
| 1 073 (99,0)
|
|
| 130 (12,0)
|
leukopéniaa
| 1 008 (93,0)
|
|
| 645 (59,5)
|
trombocytopéniaa
| 478 (44,1)
|
|
| 44 (4,1)
|
febrilná
neutropénia
|
| 87 (8,0)
|
| 87 (8,0)
|
Poruchy imunitného
systému
| hypersenzitivita
|
|
| 7 (0,6)
| 0
|
Poruchy metabolizmu a výživy
| znížená chuť do
jedla
| 192 (17,6)
|
|
| 11 (1,0)
|
dehydratácia
|
| 27 (2,5)
|
| 11 (1,0)
|
hyperglykémia
|
| 11 (1,0)
|
| 7 (0,6)
|
hypokaliémia
|
|
| 8 (0,7)
| 2 (0,2)
|
Psychické poruchy
| nespavosť
|
| 45 (4,1)
|
| 0
|
úzkosť
|
| 13 (1,2)
|
| 0
|
stav zmätenosti
|
| 12 (1,1)
|
| 2 (0,2)
|
Poruchy nervového systému
| dysgeuzia
|
| 64 (5,9)
|
| 0
|
porucha chuti
|
| 56 (5,1)
|
| 0
|
periférna
neuropatia
|
| 40 (3,7)
|
| 2 (0,2)
|
|
periférna
senzorická
neuropatia
|
|
89 (8,2)
|
|
6 (0,5)
|
polyneuropatia
|
|
|
9 (0,8)
|
2 (0,2)
|
parestézia
|
|
46 (4,2)
|
|
0
|
hypestézia
|
|
18 (1,6)
|
|
1 (< 0,1)
|
závrat
|
|
63 (5,8)
|
|
0
|
bolesť hlavy
|
|
56 (5,1)
|
|
1 (< 0,1)
|
letargia
|
|
15 (1,4)
|
|
1 (< 0,1)
|
ischias
|
|
|
9 (0,8)
|
1 (< 0,1)
|
Poruchy oka
|
konjunktivitída
|
|
11 (1,0)
|
|
0
|
zvýšená
lakrimácia
|
|
22 (2,0)
|
|
0
|
Poruchy ucha a labyrintu
|
tinitus
|
|
|
7 (0,6)
|
0
|
vertigo
|
|
15 (1,4)
|
|
1 (< 0,1)
|
Poruchy srdca
a srdcovej činnosti*
|
atriálna fibrilácia
|
|
14 (1,3)
|
|
5 (0,5)
|
tachykardia
|
|
11 (1,0)
|
|
1 (< 0,1)
|
Poruchy ciev
|
hypotenzia
|
|
38 (3,5)
|
|
5 (0,5)
|
hlboká žilová
trombóza
|
|
12 (1,1)
|
|
9 (0,8)
|
hypertenzia
|
|
29 (2,7)
|
|
12 (1,1)
|
ortostatická
hypotenzia
|
|
|
6 (0,5)
|
1 (< 0,1)
|
návaly tepla
|
|
23 (2,1)
|
|
1 (< 0,1)
|
sčervenanie
pokožky
|
|
|
9 (0,8)
|
0
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
dyspnoe
|
|
97 (8,9)
|
|
9 (0,8)
|
kašeľ
|
|
79 (7,2)
|
|
0
|
orofaryngeálna
bolesť
|
|
26 (2,4)
|
|
1 (< 0,1)
|
pneumónia
|
|
26 (2,4)
|
|
16 (1,5)
|
pľúcna embólia
|
|
30 (2,7)
|
|
23 (2,1)
|
Poruchy gastrointestinálneho traktu
|
hnačka
|
460 (42,1)
|
|
|
51 (4,7)
|
nauzea
|
347 (31,8)
|
|
|
14 (1,3)
|
vracanie
|
207 (19,0)
|
|
|
14 (1,3)
|
zápcha
|
202 (18,5)
|
|
|
8 (0,7)
|
bolesť brucha
|
|
105 (9,6)
|
|
15 (1,4)
|
dyspepsia
|
|
53 (4,9)
|
|
0
|
bolesť v hornej
časti brucha
|
|
46 (4,2)
|
|
1 (< 0,1)
|
hemoroidy
|
|
22 (2,0)
|
|
0
|
gastroezofágový
reflux
|
|
26 (2,4)
|
|
1 (< 0,1)
|
krvácanie
z konečníka
|
|
14 (1,3)
|
|
4 (0,4)
|
sucho v ústach
|
|
19 (1,7)
|
|
2 (0,2)
|
abdominálna
distenzia
|
|
14 (1,3)
|
|
1 (< 0,1)
|
stomatitída
|
|
46 (4,2)
|
|
2 (0,2)
|
ileus*
|
|
|
7 (0,6)
|
5 (0,5)
|
gastritída
|
|
|
10 (0,9)
|
0
|
kolitída*
|
|
|
10 (0,9)
|
5 (0,5)
|
gastrointestinálna
perforácia
|
|
|
3 (0,3)
|
1 (< 0,1)
|
Poruchy kože a podkožného tkaniva
|
gastrointestinálna
hemorágia
alopécia suchá koža erytém
poruchy nechtov bolesť chrbta artralgia
bolesť
|
166 (15,2)
|
80 (7,3)
23 (2,1)
18 (1,6)
88 (8,1)
76 (7,0)
|
2 (0,2)
8 (0,7)
|
1 (< 0,1)
0
0
0
24 (2,2)
9 (0,8)
9 (0,8)
|
Poruchy kostrovej
|
v končatinách
|
|
|
|
|
a svalovej sústavy
|
svalové kŕče
|
|
51 (4,7)
|
|
0
|
a spojivového
|
myalgia
|
|
40 (3,7)
|
|
2 (0,2)
|
tkaniva
|
muskuloskeletálna
|
|
34 (3,1)
|
|
3 (0,3)
|
|
bolesť na hrudníku
|
|
|
|
|
|
svalová slabosť
|
|
31 (2,8)
|
|
1 (0,2)
|
|
bolesť v trieslach
|
|
17 (1,6)
|
|
5 (0,5)
|
|
akútne zlyhanie
|
|
21 (1,9)
|
|
14 (1,3)
|
|
obličiek
|
|
|
|
|
|
zlyhanie obličiek
|
|
|
8 (0,7)
|
6 (0,5)
|
|
dyzúria
|
|
52 (4,8)
|
|
0
|
|
obličková kolika
|
|
14 (1,3)
|
|
2 (0,2)
|
hematúria
polakizúria hydronefróza retencia moču inkontinencia moču obštrukcia močovodov
|
205 (18,8)
|
26 (2,4)
25 (2,3)
36 (3,3)
22 (2,0)
|
8 (0,7)
|
33 (3,0)
2 (0,2)
13 (1,2)
4 (0,4)
0
6 (0,5)
|
bolesť panvy
|
|
20 (1,8)
|
|
5 (0,5)
|
únava
|
333 (30,5)
|
|
|
42 (3,8)
|
asténia
|
227 (20,8)
|
|
|
32 (2,9)
|
pyrexia
|
|
90 (8,2)
|
|
5 (0,5)
|
periférny edém
|
|
96 (8,8)
|
|
2 (0,2)
|
zápal slizníc
|
|
23 (2,1)
|
|
1 (< 0,1)
|
bolesť
|
|
36 (3,3)
|
|
7 (0,6)
|
bolesť na hrudníku
|
|
11 (1,0)
|
|
2 (0,2)
|
edém
|
|
|
8 (0,7)
|
1 (< 0,1)
|
zimnica
|
|
12 (1,1)
|
|
0
|
malátnosť
|
|
21 (1,9)
|
|
0
|
úbytok hmotnosti
|
|
81 (7,4)
|
|
0
|
zvýšená hladina
|
|
13 (1,2)
|
|
1 (< 0,1)
|
aspartátaminotran
|
|
|
|
|
sferázy
|
|
|
|
|
zvýšená hladina
|
|
|
7 (0,6)
|
1 (< 0,1)0
|
transamináz
|
|
|
|
|
|
|
Poruchy obličiek
a močových ciest
Poruchy
reprodukčného systému a prsníkov
Celkové poruchy
a reakcie v mieste podania
Laboratórne
a funkčné vyšetrenia
a na základe laboratórnych hodnôt
* podrobnejšie informácie pozri v časti nižšie
O
pis vybranýchnežiaducichúčinkov
Neutropénia a pridružené klinické udalosti
Ukázalo sa, že používanie G-CSF limituje výskyt a závažnosť neutropénie (pozri časti 4.2 a 4.4).
Na základe laboratórnych údajov sa výskyt neutropénie ≥ 3. stupňa pohyboval v závislosti od použitia G-CSF od 44,7 % do 76,7 %, pričom najnižší výskyt bol hlásený pri použití profylaxie G-CSF. Podobne sa výskyt febrilnej neutropénie ≥ 3. stupňa pohyboval od 3,2 % do 8,6 %.
Neutropenické komplikácie (vrátane febrilnej neutropénie, neutropenickej infekcie/sepsy
a neutropenickej kolitídy), ktoré v niektorých prípadoch viedli k fatálnemu koncu, boli hlásené
u 4,0 % pacientov, keď sa použila primárna profylaxia G-CSF a inak u 12,8 % pacientov.
Poruchy srdca a arytmie
V súhrnnej analýze boli udalosti spojené so srdcom hlásené u 5,5 % pacientov, z ktorých 1,1 % malo
srdcové arytmie ≥ 3. stupňa. Výskyt tachykardie pri kabazitaxeli bol 1,0 %, z ktorého menej ako 0,1 % bolo ≥ 3. stupňa. Výskyt atriálnej fibrilácie bol 1,3 %. Udalosti srdcového zlyhania boli hlásené u 2 pacientov (0,2 %), jeden z nich zomrel. Fatálna ventrikulárna fibrilácia bola hlásená u 1 pacienta
(0,3 %) a zástava srdca u 3 pacientov (0,5 %). Žiadna nebola investigátorom posúdená ako súvisiaca
s liekom.
Hematúria
Frekvencia výskytu hematúrie všetkých stupňov závažnosti bola v súhrnnej analýze 18,8 % pri dávke
25 mg/m2 (pozri časť 5.1). Zavádzajúce príčiny, ak boli zdokumentované, ako napríklad progresia ochorenia, prístrojové vyšetrenie, infekcia alebo antikoagulačná liečba/liečba NSAID/liečba kyselinou
acetylsalicylovou, boli identifikované v takmer polovici prípadov.
Ďalšie laboratórne abnormality
V súhrnnej analýze na základe laboratórnych abnormalít bol výskyt anémie ≥ 3. stupňa 12,0 %,
zvýšené hladiny AST 1,3 %, ALT 1,0 % a bilirubínu 0,5 %.
Poruchy gastrointestinálneho traktu
Pozorovaná bola kolitída (vrátane enterokolitídy a neutropenickej enterokolitídy) a gastritída. Hlásilo sa aj gastrointestinálne krvácanie, gastrointestinálna perforácia a ileus (intestinálna obštrukcia) (pozri časť 4.4).
Respiračné poruchy
Prípady intersticiálnej pneumónie/pneumonitídy a intersticiálneho ochorenia pľúc, niekedy fatálne, boli hlásené s neznámou frekvenciou výskytu (nie je možné odhadnúť z dostupných údajov) (pozri časť 4.4).
Poruchy obličiek a močových ciest
Menej často bola hlásená cystitída, vrátane hemoragickej cystitídy, spôsobená recall fenoménom po liečbe ožarovaním.
Pediatrickápopulácia
Pozri časť 4.2.
Iné osobitné skupiny pacientov
Staršie osoby
Z 1 092 pacientov, ktorí boli v štúdiách karcinómu prostaty liečení kabazitaxelom 25 mg/m2, bolo 755 pacientov vo veku 65 rokov alebo starších a z nich 238 starších ako 75 rokov. Nasledujúce nehematologické nežiaduce reakcie boli hlásené v pomere ≥ 5 % vyššom u pacientov vo veku 65
rokov a starších v porovnaní s mladšími pacientmi: únava (33,5 % oproti 23,7 %), asténia (23,7 %
oproti 14,2 %), zápcha (20,4 % oproti 14,2 %) a dyspnoe (10,3 % oproti 5,6 %) v uvedenom poradí. Výskyt neutropénie (90,9 % oproti 81,2 %) a trombocytopénie (48,8 % oproti 36,1 %) bol tiež vyšší
stupňa a febrilná neutropénia boli hlásené s najvyššou mierou rozdielov medzi obidvomi vekovými skupinami (o 14 % a 4 % vyššie u pacientov vo veku ≥ 65 rokov v porovnaní s pacientmi < 65 rokov, v uvedenom poradí) (pozri časti 4.2 a 4.4).
Hláseniepodozrenína nežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNie je známe žiadne antidotum pre kabazitaxel. Predpokladané komplikácie z predávkovania sú exacerbácia nežiaducich reakcií, ako útlm kostnej drene a poruchy gastrointestinálneho traktu.
V prípade predávkovania musí pacient zostať na špecializovanom pracovisku a byť pozorne
monitorovaný. Ihneď po zistení, že došlo k predávkovaniu, musí pacient dostávať terapeutické dávky
G-CSF. Podľa okolností treba začať ďalšie vhodné symptomatické opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: cytostatiká, taxány, ATC kód: L01CD04
MechanizmusúčinkuKabazitaxel je antineoplastická látka, ktorá narušuje v bunkách mikrotubulárnu sieť. Kabazitaxel sa viaže na tubulín a podporuje zabudovávanie tubulínu do mikrotubulov a zároveň inhibuje ich
depolymerizáciu. Toto vedie k stabilizácii mikrotubulov a výsledkom je inhibícia mitotických
a medzifázových bunkových funkcií.
FarmakodynamickéúčinkyKabazitaxel preukázal široké spektrum protinádorovej aktivity voči pokročilým ľudským nádorom, ktoré boli xenotransplantované myšiam. Kabazitaxel je aktívny v nádoroch senzitívnych na docetaxel. Navyše kabazitaxel preukázal aktivitu v modeloch nádorov nesenzitívnych na chemoterapiu vrátane docetaxelu.
Klinickáúčinnosťa bezpečnosťÚčinnosť a bezpečnosť kabazitaxelu v kombinácii s prednizónom alebo prednizolónom boli hodnotené
v randomizovanej, otvorenej, medzinárodnej, multicentrovej štúdii fázy III (štúdia EFC6193)
u pacientov s metastatickým kastračne rezistentným karcinómom prostaty, ktorí boli
v predchádzajúcom období liečení režimom obsahujúcim docetaxel.
Primárnym koncovým ukazovateľom účinnosti v štúdii bolo celkové prežívanie (
Overall Survival, OS). Sekundárne koncové ukazovatele zahŕňali čas prežívania bez progresie [
progression free survival, PFS (definovaný ako čas od randomizácie do progresie nádoru, progresie prostatického špecifického antigénu (
prostatic specific antigen, PSA), progresie bolesti alebo do úmrtia z rôznych príčin, podľa toho, čo sa objavilo skôr], mieru odpovede nádoru (
Tumour Response Rate) s použitím kritérií na hodnotenie odpovede pri solídnych nádoroch (
Response Evaluation Criteria in Solid Tumours, RECIST), progresiu PSA (definovaná ako ≥ 25 % nárast PSA bez odpovede alebo > 50 % pri PSA
s odpoveďou), PSA odpoveď (pokles hladín PSA v sére aspoň o 50 %), progresiu bolesti
[vyhodnotené podľa škály intenzity prítomnej bolesti (
Present Pain Intensity, PPI) z McGillovho- Melzackovho dotazníka bolesti a podľa analgetického skóre (
Analgesic Score, AS)] a odpoveď bolesti (definovaná ako viac ako 2 bodový pokles zo vstupného mediánu PPI bez súčasného zvýšenia v AS, alebo pokles ≥ 50 % v užívaní analgetík z priemernej počiatočnej hodnoty AS bez súčasného zvýšenia bolesti).
Celkovo bolo randomizovaných 755 pacientov dostávajúcich buď 25 mg/m2 kabazitaxelu intravenózne každé 3 týždne v maximálne 10 cykloch s 10 mg prednizónu alebo prednizolónu denne perorálne (n=378), alebo dostávajúcich 12 mg/m2 mitoxantrónu intravenózne každé 3 týždne v maximálne 10 cykloch s 10 mg prednizónu alebo prednizolónu denne perorálne (n=377).
Do štúdie boli zaradení pacienti starší ako 18 rokov s metastatickým kastračne rezistentným karcinómom prostaty buď merateľným prostredníctvom kritérií RECIST alebo nemerateľným typom so zvýšenými hladinami PSA alebo vznikom nových lézií a výkonnostným stavom 0 až 2 podľa
Eastern Cooperative Oncology Group (ECOG). Pacienti museli mať hladinu neutrofilov > 1 500/mm3,
krvných doštičiek > 100 000/mm3, hemoglobínu > 10 g/dl, kreatinínu < 1,5-násobok ULN, celkového bilirubínu < 1-násobok ULN, AST a ALT < 1,5-násobok ULN.
Pacienti s osobnou anamnézou kongestívneho zlyhávania srdca alebo infarktu myokardu počas posledných 6 mesiacov alebo pacienti s nekontrolovanou srdcovou arytmiou, anginou pectoris, a/alebo hypertenziou neboli zaradení do štúdie.
Demografické charakteristiky vrátane veku, rasy a výkonnostného stavu ECOG (0 až 2), boli
vyvážené medzi obidvomi liečebnými skupinami štúdie. V skupine s kabazitaxelom bol priemerný vek
68 rokov (od 42 do 92) a zastúpenie podľa rasy bolo 83,9 % belochov, 6,9 % aziatov, 5,3 % černochov
a 4 % iných.
V skupine s kabazitaxelom bol medián počtu cyklov 6 a v skupine s mitoxantrónom 4. Počet pacientov, ktorí dokončili liečbu v rámci štúdie (10 cyklov) bol 29,4 % v skupine s kabazitaxelom a 13,5 % v skupine s komparátorom.
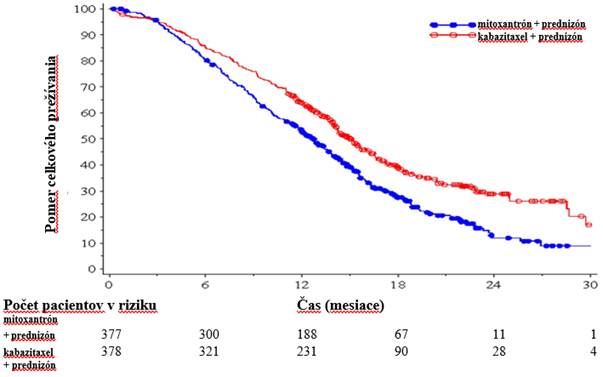
Celkové prežívanie bolo štatisticky významne dlhšie pri kabazitaxeli (15,1 mesiacov) v porovnaní
s mitoxantrónom (12,7 mesiacov), s 30 % znížením rizika úmrtia v porovnaní s mitoxantrónom (pozri tabuľku 3 a graf 1).
Podskupina 59 pacientov dostávala predtým kumulatívnu dávku docetaxelu < 225 mg/m² (29 pacientov v skupine s kabazitaxelom, 30 pacientov v skupine s mitoxantrónom). V tejto skupine pacientov nebol žiadny významný rozdiel v celkovom prežívaní pacientov (HR (95% IS) 0,96 (0,49 - 1,86)).
Tabuľka 3 – Účinnosť kabazitaxelu v štúdii EFC6193 v liečbe pacientov s metastatickým kastračne rezistentným karcinómom prostaty
| kabazitaxel
+ prednizón
n = 378
| mitoxantrón
+ prednizón
n = 377
|
Celkové prežívanie
|
Počet úmrtí (%)
| 234 (61,9 %)
| 279 (74 %)
|
Medián prežívania (mesiace) (95% IS)
| 15,1 (14,1 – 16,3)
| 12,7 (11,6 – 13,7)
|
Pomer rizika (Hazard Ratio, HR)1 (95% IS)
| 0,70 (0,59 – 0,83)
|
p-hodnota
| < 0,0001
|
1HR odhadnutý pomocou Coxovho modelu; hodnota HR nižšia ako 1 v prospech kabazitaxelu
Graf 1: Kaplan-Meierove krivky celkového prežívania (EFC6193)
V skupine s kabazitaxelom bolo zlepšenie prežívania bez progresie v porovnaní so skupinou
s mitoxantrónom, 2,8 (2,4 – 3,0) mesiaca oproti 1,4 (1,4 – 1,7) mesiaca v uvedenom poradí, HR (95%
IS) 0,74 (0,64 – 0,86), p < 0,0001.
U pacientov v skupine s kabazitaxelom bola štatisticky významne vyššia miera odpovede nádoru, a to
14,4 % (95% IS: 9,6 – 19,3) v porovnaní so 4,4 % (95% IS: 1,6 – 7,2) u pacientov v skupine s mitoxantrónom, p = 0,0005.
Sekundárne koncové ukazovatele PSA boli pozitívne v skupine s kabazitaxelom. Medián progresie PSA bol 6,4 mesiacov (95% IS: 5,1 – 7,3) u pacientov v skupine s kabazitaxelom v porovnaní s 3,1 mesiacov (95% IS: 2,2 – 4,4) v skupine s mitoxantrónom, HR 0,75 mesiaca (95% IS: 0,63 – 0,90),
p = 0,0010. PSA odpoveď bola 39,2 % u pacientov v skupine s kabazitaxelom (95% IS: 33,9 – 44,5)
oproti 17,8 % pacientov, ktorým bol podávaný mitoxantrón (95% IS: 13,7 – 22,0), p = 0,0002.
V progresii bolesti a v odpovedi na bolesť nebol medzi oboma skupinami štatisticky významný
rozdiel.
V neinferiórnej, multicentrovej, multinárodnej, randomizovanej otvorenej štúdii (štúdia EFC11785) fázy III bolo randomizovaných 1 200 pacientov s metastatickým kastračne rezistentným karcinómom prostaty, v minulosti liečených režimom obsahujúcim docetaxel, ktorí dostávali buď dávku kabazitaxelu 25 mg/m2 (n = 602) alebo 20 mg/m2 (n = 598). Primárnym koncovým ukazovateľom účinnosti bolo celkové prežívanie (
overall survival, OS).
Štúdia splnila svoj primárny cieľ preukázania neinferiority kabazitaxelu 20 mg/m2 v porovnaní
s 25 mg/m2 (pozri tabuľku 4). Štatisticky významne vyššie percento (p < 0,001) pacientov preukázalo
PSA odpoveď v skupine s 25 mg/m2 (42,9 %) oproti skupine s 20 mg/m2 (29,5 %). Bolo pozorované štatisticky významne vyššie riziko progresie PSA u pacientov s dávkou 20 mg/m2, oproti dávke
25 mg/m2 (HR 1,195; 95% IS: 1,025 až 1,393). Neboli zistené žiadne štatistické rozdiely v súvislosti
s ďalšími sekundárnymi koncovými ukazovateľmi (PFS, odpoveď nádoru a odpoveď na bolesť, progresia nádoru a bolesti a štyri podkategórie FACT-P).
Tabuľka 4 – Celkové prežívanie v štúdii EFC11785, v skupine s kabazitaxelom 25 mg/m2 oproti skupine s kabazitaxelom 20 mg/m2 (analýza pri zámere liečiť,
Intent-to-treat analysis) – primárny koncový ukazovateľ účinnosti
'
| CBZ20 + PRED
n = 598
| CBZ25 + PRED
n = 602
|
Celkové prežívanie
|
Počet úmrtí, n (%)
| 497 (83,1 %)
| 501 (83,2 %)
|
Medián prežívania (95% IS) (mesiace)
| 13,4 (12,19 až 14,88)
| 14,5 (13,47 až 15,28)
|
Pomer rizikaa
|
|
|
oproti CBZ25 + PRED
| 1,024
| -
|
1-stranná 98,89 % UIS
| 1,184
| -
|
1-stranná 95 % LIS
| 0,922
| -
|
CBZ20 = kabazitaxel 20 mg/m2, CBZ25 = kabazitaxel 25 mg/m2, PRED = prednizón/prednizolón, IS
= interval spoľahlivosti (
confidence interval), LIS = dolná hranica intervalu spoľahlivosti (
lower bound of the confidence interval), UIS = horná hranica intervalu spoľahlivosti (
upper bound of theconfidence interval)
aPomer rizika sa odhaduje použitím Coxovho regresného modelu proporcionálneho rizika. Pomer rizika < 1 indikuje nižšie riziko kabazitaxelu 20 mg/m2 oproti 25 mg/m2.
Bezpečnostný profil kabazitaxelu 25 mg/m2 pozorovaný v štúdii EFC11785 bol kvalitatívne
a kvantitatívne podobný tomu, ktorý bol pozorovaný v štúdii EFC6193. Štúdia EFC11785 preukázala lepší bezpečnostný profil pre dávku kabazitaxelu 20 mg/m2.

Tabuľka 5 – Súhrn bezpečnostných údajov v skupine s kabazitaxelom 25 mg/m2 oproti skupine s kabazitaxelom 20 mg/m2 v štúdii EFC11785
C
B
Z
20
+
P
R
ED
n = 580
C
B
Z
25
+
P
R
ED
n = 595

Medián počtu cyklov/
medián trvania liečby
6/18 týždňov 7/ 21 týždňov
Počet pacientov so zníženou dávkou
n (%)
od 20 do 15 mg/m2: 58 (10,0 %)
od 15 do 12 mg/m2: 9 (1,6 %)
od 25 do 20 mg/m2: 128 (21,5 %)
od 20 do 15 mg/m2: 19 (3,2 %)
od 15 do 12 mg/m2: 1 (0,2 %)
V
šetky stupne nežiaducich reakcií
a
(
%
)
hnačka
|
30,7
|
39,8
|
nauzea
|
24,5
|
32,1
|
únava
|
24,7
|
27,1
|
hematúria
|
14,1
|
20,8
|
asténia
|
15,3
|
19,7
|
znížená chuť do jedla
|
13,1
|
18,5
|
vracanie
|
14,5
|
18,2
|
zápcha
|
17,6
|
18,0
|
bolesť chrbta
|
11,0
|
13,9
|
klinická neutropénia
|
3,1
|
10,9
|
infekcie močového traktu
|
6,9
|
10,8
|
periférna senzorická
|
6,6
|
10,6
|
neuropatia
|
|
|
dysgeuzia
|
7,1
|
10,6
|
N
ežiaduce reakcie ≥ 3. stupňa
b (%)
klinická neutropénia
| 2,4
| 9,6
|
febrilná neutropénia
| 2,1
| 9,2
|
 Hematologické abnormalityc
Hematologické abnormalityc (%)
neutropénia ≥ 3. stupňa
| 41,8
| 73,3
|
anémia ≥ 3. stupňa
| 9,9
| 13,7
|
trombocytopénia ≥ 3. stupňa
| 2,6
| 4,2
|
CBZ20 = kabazitaxel 20 mg/m2, CBZ25 = kabazitaxel 25 mg/m2, PRED = prednizón/prednizolón
aNežiaduce reakcie všetkých stupňov s výskytom vyšším ako 10 %
bNežiaduce reakcie ≥ 3. stupňa s výskytom vyšším ako 5 %
cZaložené na laboratórnych hodnotách
V prospektívnej, medzinárodnej, randomizovanej a otvorenej štúdii fázy IV s aktívnym komparátorom (štúdia LPS14201/CARD) bolo 255 pacientov s metastatickým kastračne rezistentným karcinómom prostaty (
metastatic castration resistant prostate cancer, mCRPC) predtým liečených režimom obsahujúcim docetaxel a liekmi zameranými na AR (abiraterón alebo enzalutamid, s progresiou ochorenia do 12 mesiacov od začiatku liečby) v akomkoľvek poradí, randomizovaných tak, aby dostávali buď kabazitaxel 25 mg/m2 každé 3 týždne plus prednizón/prednizolón 10 mg denne (n =
129) alebo lieky zamerané na AR (abiraterón 1 000 mg jedenkrát denne plus prednizón/prednizolón
5 mg dvakrát denne alebo enzalutamid 160 mg jedenkrát denne) (n = 126). Primárnym koncovým ukazovateľom bolo rádiografické prežívanie bez progresie (rPFS), ako ho definovala pracovná skupina pre rakovinu prostaty-2 (
Prostate Cancer Working Group- 2, PCWG2). Sekundárne koncové ukazovatele zahŕňali celkové prežívanie, prežívanie bez progresie, PSA odpoveď a odpoveď nádoru.
Demografické údaje a charakteristiky ochorenia boli medzi liečebnými skupinami vyvážené. Na začiatku bol celkový medián veku 70 rokov, 95 % pacientov malo ECOG PS 0 až 1 a medián Gleason skóre bol 8. Šesťdesiatjeden percent (61 %) pacientov podstúpilo predchádzajúcu liečbu liekom zameraným na AR po predchádzajúcej liečbe docetaxelom.
Štúdia splnila svoj primárny koncový ukazovateľ: rPFS bol signifikantne dlhší pri kabazitaxeli
v porovnaní s liekom zameraným na AR (8,0 mesiacov oproti 3,7 v uvedenom poradí), so znížením rizika rádiografickej progresie o 46 % v porovnaní s liekom zameraným na AR (pozri tabuľku 6
a obrázok 2).

Tabuľka 6 – Účinnosť kabazitaxelu v štúdii CARD v liečbe pacientov s metastatickým kastračne rezistentným karcinómom prostaty (
intent to-treat analýza) – rádiografické prežívanie bez progresie (rPFS)
kabazitaxel
+ prednizón/prednizolón
+ G-CSF
n = 129
liek zameraný na AR:
abiraterón +
prednizón/prednizolón
alebo enzalutamid n = 126

Počet udalostí ku dňu ukončenia (%) 95 (73,6 %) 101 (80,2 %) Medián rPFS (mesiace) (95% IS) 8,0 (5,7 až 9,2) 3,7 (2,8 až 5,1) Pomer rizika (HR) (95% IS) 0,54 (0,40 až 0,73)
p-hodnota1 < 0,0001

1stratifikovaný long-rank test, prah štatistickej významnosti = 0,05
Obrázok 2 – Primárny koncový ukazovateľ: Kaplan-Meierov graf rádiografického PFS (ITT
populácia)
Krížikom sú označené cenzurované údaje
Plánované analýzy rPFS založené na stratifikačných faktoroch pri randomizácii ukázali pomer rizika
0,61 (95% IS: 0,39 až 0,96) v podskupine pacientov, ktorí dostávali liek zameraný na AR pred docetaxelom a pomer rizika 0,48 (95% IS: 0,32 až 0,70) v podskupine pacientov, ktorí dostávali liek zameraný na AR po docetaxeli.
Kabazitaxel bol štatisticky lepší ako komparátory zamerané na AR pre každý z alfa-chránených kľúčových sekundárnych koncových ukazovateľov vrátane celkového prežívania (13,6 mesiacov
v skupine s kabazitaxelom oproti 11,0 mesiacov v skupine s liekom zameraným na AR, HR 0,64, 95%
IS: 0,46 až 0,89; p = 0,008), prežívanie bez progresie (4,4 mesiacov v skupine s kabazitaxelom 2,7
mesiacov v skupine s liekom zameraným na AR, HR 0,52; 95% IS: 0,40 až 0,68), potvrdená PSA
odpoveď (36,3 % v skupine s kabazitaxelom oproti 14,3 % v skupine s liekom zameraným na AR,
p = 0,0003) a najlepšia odpoveď nádoru (36,5 % v skupine s kabazitaxelom oproti 11,5 % v skupine s liekom zameraným na AR, p = 0,004).
Bezpečnostný profil kabazitaxelu 25 mg/m2 pozorovaný v štúdii CARD bol celkovo v súlade
s bezpečnostným profilom pozorovaným v štúdiách TROPIC a PROSELICA (pozri časť 4.8). Výskyt nežiaducich udalostí ≥ 3. stupňa bol 53,2 % v skupine s kabazitaxelom oproti 46,0 % v skupine
s liekom zameraným na AR. Výskyt závažných nežiaducich udalostí ≥ 3. stupňa bol 31,7 % v skupine
s kabazitaxelom oproti 37,1 % v skupine s liekom zameraným na AR. Pomer pacientov, ktorí natrvalo prerušili liečbu v štúdii kvôli nežiaducim udalostiam, bol 19,8 % v skupine s kabazitaxelom oproti
8,1 % v skupine s liekom zameraným na AR. Pomer pacientov s nežiaducou udalosťou vedúcou
k fatálnemu koncu bol 5,6 % v skupine s kabazitaxelom oproti 10,5 % v skupine s liekom zameraným
na AR.
Pediatrickápopulácia
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií s kabazitaxelom vo
všetkých podskupinách pediatrickej populácie pre schválenú indikáciu karcinómu prostaty (informácie
o použití v pediatrickej populácii, pozri časť 4.2).
Kabazitaxel bol hodnotený v otvorenej multicentrovej štúdii fázy 1 a 2 vykonanej celkovo u 39
pediatrických pacientov (vo veku od 4 do 18 rokov pre časť štúdie fázy 1 a vo veku od 3 do 16 rokov
pre časť štúdie fázy 2). Štúdia fázy 2 nepreukázala účinnosť kabazitaxelu v dávke 30 mg/m2
v monoterapii v pediatrickej populácii s rekurentným alebo refraktérnym difúznym vnútorným gliómom mozgového kmeňa a high- grade gliómom (HGG).
5.2 Farmakokinetické vlastnosti
Populačná farmakokinetická analýza sa uskutočnila u 170 pacientov vrátane pacientov s pokročilými
solídnymi nádormi (n = 69), metastatickým karcinómom prsníka (n = 34) a metastatickým
karcinómom prostaty (n = 67). Títo pacienti dostávali kabazitaxel v dávkach od 10 do 30 mg/m2 každý týždeň alebo každé 3 týždne.
Absorpcia
U pacientov s metastatickým karcinómom prostaty (n = 67) bola po 1-hodinovej intravenóznej infúzii
25 mg/m2 kabazitaxelu Cmax 226 ng/ml (variačný koeficient - Coefficient of Variation (CV): 107 %)
a bola dosiahnutá na konci 1-hodinovej infúzie (Tmax). Priemerná hodnota AUC bola 991 ng.h/ml (CV:
34 %).
U pacientov s pokročilými solídnymi nádormi (n = 126) nebola pozorovaná veľká odchýlka vo vzťahu
k proporcionalite dávky od 10 do 30 mg/m2.
Distribúcia
Distribučný objem (Vss) bol 4 870 l (2 640 l/m2 u pacientov s mediánom BSA 1,84 m2)
v rovnovážnom stave.
In vitro, viazanie kabazitaxelu na ľudské sérové proteíny bolo 89 – 92 % a nebolo saturovateľné do
50 000 ng/ml, čo pokrýva maximálnu koncentráciu v klinických štúdiách. Kabazitaxel sa viaže predovšetkým na ľudský sérový albumín (82,0 %) a lipoproteíny (87,9 % pre HDL, 69,8 % pre LDL,
a 55,8 % pre VLDL). V ľudskej krvi bol in vitro pomer koncentrácie v krvi a plazme od 0,90 do 0,99,
čo naznačuje, že kabazitaxel sa distribuoval do krvi a plazmy rovnomerne.
Biotransformácia
Kabazitaxel sa extenzívne metabolizuje v pečeni (> 95 %), predovšetkým prostredníctvom izoenzýmu CYP3A (80 % až 90 %). V ľudskej plazme cirkuluje ako hlavná zložka kabazitaxel. V plazme bolo zistených sedem metabolitov (vrátane 3 aktívnych metabolitov, ktoré vznikli z O-demetylácií), pričom hlavný tvoril 5 % expozície. Okolo 20 metabolitov kabazitaxelu sa vylučuje do ľudského moču
a stolice.
Na základe in vitro štúdií je v klinicky relevantných koncentráciách možné riziko inhibície kabazitaxelom vo vzťahu k tým liekom, ktoré sú predovšetkým substrátmi CYP3A. Avšak v klinickej štúdii sa preukázalo, že kabazitaxel (25 mg/m2 podávaný vo forme samostatnej 1-hodinovej infúzie) nemenil plazmatické hladiny midazolamu, skúšobného substrátu CYP3A. Pri súčasnom podávaní substrátov CYP3A a kabazitaxelu v terapeutických dávkach sa preto neočakáva žiadny klinický dopad na pacienta.
Nejestvuje potenciálne riziko inhibície liekov, ktoré sú substrátmi iných CYP enzýmov (1A2, 2B6,
2C9, 2C8, 2C19, 2E1 a 2D6), rovnako ako neexistuje potenciálne riziko indukcie kabazitaxelom tých liekov, ktoré sú substrátmi CYP1A, CYP2C9 a CYP3A. Kabazitaxel in vitro neinhiboval hlavnú cestu
biotransformácie warfarínu na 7-hydroxywarfarín sprostredkovaný CYP2C9. Preto sa in vivo
neočakáva žiadna farmakokinetická interakcia kabazitaxelu a warfarínu. In vitro kabazitaxel neinhiboval proteíny mnohopočetnej liekovej rezistencie (Multidrug-Resistant Proteins, MRP): MRP1 a MRP2 ani transportér organických katiónov (Organic Cation Transporter, OCT1). Kabazitaxel inhiboval transport sprostredkovaný P-glykoproteínom (PgP) (digoxín, vinblastín), proteínom rezistencie rakoviny prsníka (Breast-Cancer-Resistant-Proteins, BCRP) (metotrexát) a organickým aniónovým transportným polypeptidom (Organic Anion Transporting Polypeptide) OATP1B3
(CCK8) pri koncentráciách minimálne 15-násobne vyšších ako v klinických podmienkach, zatiaľ čo inhiboval transport OATP1B1 (estradiol-17β-glukuronid) pri koncentráciách len 5-násobne vyšších ako v klinických podmienkach. Preto je pri dávke 25 mg/m2 riziko interakcie so substrátmi MRP, OCT1, PgP a OATP1B3 in vivo nepravdepodobné. Existuje riziko interakcie s transportérom OATP1B1, predovšetkým v priebehu trvania infúzie (1 hodina) a až do 20 minút po ukončení infúzie (pozri časť 4.5).
V
y
l
učo
v
an
i
e
Po 1-hodinovej intravenóznej infúzii [14C]-kabazitaxelu v dávke 25 mg/m2 sa u pacientov približne
80 % podanej dávky eliminovalo v priebehu 2 týždňov. Kabazitaxel je vylučovaný predovšetkým v stolici, ako viaceré metabolity (76 % dávky), zatiaľ čo renálne vylučovanie kabazitaxelu a jeho metabolitov predstavuje menej ako 4 % dávky (2,3 % sa v nezmenenej podobe vylúči močom).
Kabazitaxel mal vysoký plazmatický klírens: 48,5 l/h (26,4 l/h/m2 u pacientov s mediánom BSA
1,84 m2) a dlhý terminálny polčas 95 hodín.
Osobitnéskupiny pacientov
Starší pacienti
V populačnej farmakokinetickej analýze u 70 pacientov vo veku 65 rokov a starších (57 pacientov vo veku od 65 do 75 rokov a 13 pacientov starších ako 75 rokov) nebol pozorovaný žiadny vplyv veku na
farmakokinetiku kabazitaxelu.
Pediatrickí pacienti
Bezpečnosť a účinnosť kabazitaxelu neboli u detí a dospievajúcich vo veku do 18 rokov stanovené.
Porucha funkcie pečene
Kabazitaxel je eliminovaný predovšetkým metabolizáciou v pečeni.
Špecializovaná štúdia so 43 pacientami s rakovinou s poruchou funkcie pečene nepreukázala žiadny vplyv miernej (celkový bilirubín > 1 až ≤ 1,5-násobok ULN alebo AST > 1,5-násobok ULN) alebo stredne závažnej (celkový bilirubín > 1,5 až ≤ 3-násobok ULN) poruchy funkcie pečene na farmakokinetiku kabazitaxelu. Maximálna tolerovaná dávka (MTD) kabazitaxelu bola 20 a 15 mg/m2 v uvedenom poradí.
U 3 pacientov so závažnou poruchou funkcie pečene (celkový bilirubín > 3 ULN) bolo pozorované zníženie klírensu o 39 % v porovnaní s pacientmi s miernou poruchou funkcie pečene, čo naznačuje
určitý vplyv závažnej poruchy funkcie pečene na farmakokinetiku kabazitaxelu. MTD kabazitaxelu u pacientov so závažnou poruchou funkcie pečene nebola stanovená.
Na základe údajov o bezpečnosti a znášanlivosti by mala byť u pacientov s miernou poruchou funkcie pečene dávka kabazitaxelu znížená (pozri časti 4.2, 4.4).U pacientov so závažnou poruchou funkcie pečene je Cabazitaxel Fresenius Kabi kontraindikovaný (pozri časť 4.3).
Porucha funkcie obličiek
Kabazitaxel sa vylučuje obličkami iba minimálne (2,3 % dávky). V populačnej farmakokinetickej analýze uskutočnenej u 170 pacientov, medzi ktorými bolo 14 pacientov so stredne závažnou poruchou funkcie obličiek (klírens kreatinínu v rozmedzí 30 až 50 ml/min) a 59 pacientov s miernou
poruchou funkcie obličiek (klírens kreatinínu v rozmedzí 50 až 80 ml/min) bolo preukázané, že mierna
až stredne závažná porucha funkcie obličiek nemá významný účinok na farmakokinetiku kabazitaxelu.
Toto bolo potvrdené aj v špecializovanej porovnávacej farmakokinetickej štúdii u pacientov so
solídnymi nádormi s normálnou funkciou obličiek (8 pacientov), so stredne závažnou (8 pacientov)
a závažnou (9 pacientov) poruchou funkcie obličiek, ktorí sa liečili niekoľkými cyklami kabazitaxelu v samostatnej intravenóznej infúzii až do 25 mg/m2.
5.3 Predklinické údaje o bezpečnosti
Nežiaduce reakcie, ktoré neboli pozorované v klinických štúdiách, ale boli pozorované u psov po podaní jednej dávky, pri 5-dňovom a týždennom podávaní pri expozíciách nižších ako sú klinické a s možným významom pre klinické použitie, boli arteriolárna/periarteriolárna nekróza pečene, hyperplázia žlčovodu a/alebo hepatocelulárna nekróza (pozri časť 4.2).
Nežiaduce reakcie, ktoré neboli pozorované v klinických štúdiách, ale boli pozorované u potkanov v štúdiách toxicity po opakovanom podávaní dávky, pri expozíciách vyšších ako sú klinické
a s možným významom pre klinické použitie, boli poruchy oka charakterizované
opuchom/degeneráciou subkapsulárnych vlákien šošovky. Po 8 týždňoch boli tieto účinky čiastočne reverzibilné.
Štúdie karcinogénneho potenciálu kabazitaxelu neboli vykonané.
V teste bakteriálnej reverznej mutácie (Amesov test) kabazitaxel neindukoval mutácie. V ľudských
lymfocytoch in vitro nebol klastogenický (neindukoval štrukturálne chromozomálne aberácie, ale zvýšil počet polyploidných buniek) a v in vivo testoch indukoval zvýšenie počtu mikrojadier
u potkanov. Avšak tieto výsledky genotoxicity sú inherentné s farmakologickou aktivitou samotného
liečiva (inhibícia tubulínovej depolymerizácie) a boli pozorované pri liekoch, ktoré vykazovali rovnakú farmakologickú aktivitu.
Kabazitaxel nemal žiadny účinok na aktivitu pri párení alebo fertilitu liečených samcov potkanov. Avšak v štúdiách toxicity po opakovanom podávaní dávky bola u potkanov pozorovaná degenerácia semenných mechúrikov a atrofia semenotvorných kanálikov v semenníkoch a u psov bola pozorovaná testikulárna degenerácia (minimálna nekróza jednotlivých epitelových buniek v nadsemenníku). Expozície u zvierat boli podobné alebo nižšie ako u ľudí, ktorým boli podávané klinicky relevantné dávky kabazitaxelu.
Kabazitaxel indukoval embryofetálnu toxicitu u samíc potkanov, ktorým bol podávaný intravenózne raz denne v 6. až 17. gestačnom dni, spojenú s materskou toxicitou. Došlo k úmrtiu plodu a zníženiu priemernej hmotnosti plodu, ktoré súviselo s oneskorením osifikácie skeletu. Expozície u zvierat boli nižšie ako u ľudí, ktorým boli podávané klinicky relevantné dávky kabazitaxelu. Kabazitaxel
u potkanov prechádzal placentárnou bariérou.
U potkanov sa kabazitaxel a jeho metabolity vylučovali do materského mlieka v množstve až 1,5 %
podanej dávky počas 24 hodín.
Hodnotenie environmentálnehorizika (ERA)
Výsledky štúdií hodnotenia environmentálneho rizika naznačujú, že používanie kabazitaxelu
nepredstavuje významné riziko pre vodné životné prostredie (pozri časť 6.6 o likvidácii
nespotrebovaného lieku).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
polysorbát 80 bezvodý etanol kyselina citrónová
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Neotvorenáinjekčnáliekovka
3 roky.
Po otvorení
Každá injekčná liekovka je určená na jednorazové použitie a po otvorení sa má použiť okamžite. Ak sa
nepoužije okamžite, za čas a podmienky uchovávania zodpovedá používateľ.
Po finálnomzriedenív infúznomvaku/fľaši
Chemická a fyzikálna stabilita infúzneho roztoku v obaloch bez obsahu PVC bola preukázaná počas 8
hodín pri teplote 15 ºC až 30 ºC (vrátane 1 hodiny podávania infúzie) a 48 hodín pri uchovávaní
v chladničke (vrátane 1 hodiny podávania infúzie).
Z mikrobiologického hľadiska sa má infúzny roztok použiť okamžite. Ak sa nepoužije okamžite, za čas a podmienky uchovávania zodpovedá používateľ a zvyčajne to nemá byť viac ako 24 hodín pri
teplote 2 °C až 8 °C, pokiaľ sa zriedenie neuskutočnilo na mieste s kontrolovanými a validovanými aseptickými podmienkami.
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
Podmienky na uchovávanie lieku po riedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia3 ml koncentrátu v 6 ml tubulárnej injekčnej liekovke z číreho skla (typ I) uzatvorenej chlórbutylovou gumovou zátkou a utesnenej hliníkovým vyklápacím viečkom.
Každé balenie obsahuje jednu injekčnú liekovku.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomCabazitaxel Fresenius Kabi má pripravovať a podávať len personál vyškolený na prácu
s cytostatikami. Tehotné pracovníčky nemajú manipulovať s liekom. Tak, ako aj pri iných cytostatikách, je potrebné byť opatrný pri zaobchádzaní a príprave roztoku kabazitaxelu a zvážiť
použitie oddelených priestorov, osobných ochranných prostriedkov (napr. rukavice) a dodržiavať postupy na prípravu cytostatík. Ak sa kabazitaxel v ktoromkoľvek kroku počas zaobchádzania s ním
dostane do kontaktu s pokožkou, okamžite ju dôkladne umyte mydlom a vodou. Ak sa dostane do kontaktu so sliznicou, okamžite ju dôkladne umyte vodou.
PrípravanaintravenóznepodanieCabazitaxel Fresenius Kabi 20 mg/ml koncentrát na infúzny roztok nevyžaduje ŽIADNE
predchádzajúce riedenie a je pripravený na pridanie do infúzneho roztoku.
NEPOUŽÍVAJTE spolu s inými liekmi obsahujúcimi kabazitaxel s inou koncentráciou kabazitaxelu. Cabazitaxel Fresenius Kabi obsahuje 20 mg/ml kabazitaxelu (najmenej 3 ml dodávaného objemu). Každá injekčná liekovka je určená na jednorazové použitie a má sa použiť okamžite. Všetok nepoužitý roztok zlikvidujte. Na podanie predpísanej dávky môže byť potrebné použiť viac injekčných liekoviek lieku Cabazitaxel Fresenius Kabi.
Koncentrát na infúzny roztok sa má vždy pred pridaním do infúzneho roztoku riediť s celým dodávaným rozpúšťadlom.
Proces riedenia pri príprave infúzneho roztoku sa má vykonať aseptickým spôsobom.
Prí prava i nf úzne ho rozt okuKrok 1.Asepticky natiahnite požadované množstvo
Cabazitaxelu Fresenius Kabi (ktorý obsahuje
20 mg/ml kabazitaxelu) kalibrovanou injekčnou striekačkou s upevnenou ihlou. Napríklad dávka
45 mg kabazitaxelu si vyžaduje 2,25 ml
Cabazitaxelu Fresenius Kabi.
K
rok 2
Vstreknite odobraný objem do sterilnej infúznej
nádoby bez obsahu PVC obsahujúcej buď 5 % roztok glukózy alebo infúzny roztok chloridu sodného 9 mg/ml (0,9 %). Koncentrácia infúzneho roztoku má byť medzi 0,10 mg/ml a 0,26 mg/ml.
Krok 3Odstráňte injekčnú striekačku a ručne premiešajte obsah
infúzneho vaku alebo fľaše kývavým pohybom. Infúzny roztok je číry bezfarebný roztok.
Krok 4Tak ako pri všetkých parenterálnych liekoch, výsledný infúzny
roztok sa musí pred použitím vizuálne skontrolovať. Infúzny roztok je supersaturovaný a preto môže po čase skryštalizovať.
V takomto prípade sa roztok nesmie použiť a má sa
znehodnotiť.
Infúzny roztok sa má podať ihneď. Avšak čas použitia pri správnom uchovávaní môže byť dlhší, ak sú
dodržané špeciálne podmienky popísané v časti 6.3.
Na podávanie sa odporúča použiť filter, ktorého nominálna veľkosť pórov je 0,22 mikrometrov
(označovaný tiež 0,2 mikrometrov).
Na prípravu a podávanie kabazitaxelu nepoužívajte infúzne vaky alebo fľaše obsahujúce PVC alebo
polyuretánové infúzne súpravy.
Cabazitaxel Fresenius Kabi sa nesmie miešať so žiadnymi inými liekmi okrem tých, ktoré sú uvedené. Všetok nepoužitý liek a materiál použitý pri rekonštitúcii, riedení a podávaní sa musí zlikvidovať
v súlade s nemocničnými postupmi pri zaobchádzaní s cytotoxickými látkami a v súlade s aktuálnou legislatívou o likvidácii nebezpečného materiálu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIFresenius Kabi s.r.o.
Na strži 1702/65, Nusle
140 00 Praha 4
Česká republika
8. REGISTRAČNÉ ČÍSLO44/0318/22-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU
12/2022