
známy. Lekári majú byť opatrní pri zvažovaní kombinovanej terapie so sulfasalazínom.
Bezinterakcií
V klinických štúdiách neboli pozorované žiadne interakcie pri podávaní etanerceptu s glukokortikoidmi, salicylátmi (okrem sulfasalazínu), nesteroidovými protizápalovými liekmi
(NSAIDs), analgetikami alebo metotrexátom. Pozri časť 4.4 týkajúcu sa informácií o očkovaní.
Nepozorovali sa klinicky signifikantné farmakokinetické liekové interakcie v štúdiách s metotrexátom, digoxínom ani s warfarínom.
4.6 Fertilita, gravidita a laktácia
Ženyvreprodukčnomveku
Ženám v reprodukčnom veku sa má odporučiť používať vhodnú antikoncepciu, aby sa zabránilo otehotneniu počas liečby s Benepali a počas 3 týždňov po ukončení liečby.
Gravidita
Štúdie vývojovej toxicity uskutočnené na potkanoch a králikoch nepreukázali žiadne poškodenie plodu alebo novonarodených potkanov v dôsledku etanerceptu. Vyššia miera výskytu závažných vrodených chýb sa pozorovala v observačnej štúdii porovnávajúcej gravidity s expozíciou etanerceptu počas prvého trimestra, s graviditami bez expozície etanerceptu alebo iným TNF-antagonistom (upravený pomer šancí 2,4, 95 % CI: 1,0 – 5,5). Typy najčastejšie hlásených závažných vrodených chýb boli totožné s typmi, ktoré sa najčastejšie hlásili vo všeobecnej populácii, a nebol identifikovaný žiadny osobitný typ abnormalít. V štúdii sa nezistila žiadna zmena v miere výskytu spontánneho potratu, narodenia mŕtveho plodu, alebo menej závažných malformácií. Použitie Benepali sa počas gravidity neodporúča.
Etanercept prechádza cez placentu a zistil sa v sére dojčiat, ktoré sa narodili pacientkam liečeným etanerceptom počas tehotenstva. Klinický vplyv tohto zistenia nie je známy, dojčatá však môžu byť vystavené vyššiemu riziku vzniku infekcie. Podávanie živých vakcín dojčatám 16 týždňov potom, ako matka dostala poslednú dávku Benepali, sa vo všeobecnosti neodporúča.
Dojčenie
Zistilo sa, že etanercept sa vylučuje do materského mlieka po podkožnom podaní. U dojčiacich potkanov po podkožnom podaní sa etanercept vylučoval do materského mlieka a zistil sa v plazme mláďat. Pretože sa imunoglobulíny, tak ako mnohé lieky, môžu vylučovať do materského mlieka, rozhodnutie, či ukončiť dojčenie alebo ukončiť liečbu s Benepali sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Predklinické údaje o peri- a postnatálnej toxicite etanerceptu a účinkoch etanerceptu na plodnosť a celkovú reprodukčnú schopnosť nie sú dostupné.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnúdajovobezpečnosti
Najčastejšie hlásenými nežiaducimi reakciami sú reakcie v mieste podania (ako bolesť, opuch, svrbenie, začervenanie a krvácanie v mieste vpichu), infekcie (ako infekcie horných dýchacích ciest,
bronchitída, infekcie močového mechúra a kožné infekcie), alergické reakcie, tvorba autoprotilátok, svrbenie a horúčka.
U etanerceptu boli tiež hlásené závažné nežiaduce reakcie. TNF-antagonisty, tak ako etanercept, ovplyvňujú imunitný systém a ich použitie môže ovplyvniť obranyschopnosť tela voči infekcii a nádoru. Závažné infekcie vyvolávajúce horúčku postihnú menej ako 1 zo 100 pacientov liečených etanerceptom. Hlásenia zahŕňali fatálne a život ohrozujúce infekcie a sepsu. Pri použití etanerceptu boli hlásené aj rôzne malignity vrátane zhubných nádorov prsníka, pľúc, kože a lymfatických žliaz (lymfóm).
Boli hlásené aj závažné hematologické, neurologické a autoimunitné reakcie. Tie zahŕňajú zriedkavé hlásenia pancytopénie a veľmi zriedkavé hlásenia aplastickej anémie. Centrálne a periférne
demyelinizačné ochorenia boli hlásené zriedkavo alebo veľmi zriedkavo, obzvlášť pri použití etanerceptu. Hlásený bol aj lupus, stavy podobné lupusu a vaskulitída.
Tabuľkovýzoznamnežiaducichreakcií
Nasledujúci zoznam nežiaducich účinkov je založený na skúsenostiach z klinických štúdií u dospelých a na skúsenostiach po uvedení lieku na trh.
V rámci tried orgánových systémov sú nežiaduce reakcie uvedené v zozname podľa ich frekvencie (počet pacientov, u ktorých sa nežiaduca reakcia očakáva), pri použití nasledujúcich kategórií: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až
< 1/1 000); veľmi zriedkavé (< 1/10 000); neznáme (z dostupných údajov).
Infekcie a nákazy:
Veľmi časté: Infekcie (vrátane infekcií horných dýchacích ciest, bronchitídy, cystitídy, kožných infekcií)*
Menej časté: Závažné infekcie (vrátane pneumónie, celulitídy, septickej artritídy, sepsy a parazitárnej infekcie)*
Zriedkavé: Tuberkulóza, oportúnne infekcie (vrátane invazívnych mykotických, protozoálnych, bakteriálnych, atypických mykobakteriálnych, vírusových infekcií, a Legionelly)*
Neznáme: Listeria, reaktivácia hepatitídy B
Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy): Menej časté: Nemelanómový karcinóm kože* (pozri časť 4.4) Zriedkavé: Lymfóm, melanóm (pozri časť 4.4)
Neznáme: Leukémia, karcinóm z Merkelových buniek (pozri časť 4.4)
Poruchy krvi a lymfatického systému:
Menej časté: Trombocytopénia
Zriedkavé: Anémia, leukopénia, neutropénia, pancytopénia*
Veľmi zriedkavé:
Poruchy imunitného systému:
Aplastická anémia*
Časté: Alergické reakcie (pozri „Poruchy kože a podkožného tkaniva“), tvorba autoprotilátok*
Menej časté: Systémová vaskulitída (vrátane vaskulitídy s cytoplazmatickými protilátkami proti neutrofilom)
Zriedkavé: Závažné alergické/anafylaktické reakcie (vrátane angioedému,
bronchospazmu), sarkoidóza
Neznáme: Syndróm aktivácie makrofágov*, zhoršenie príznakov dermatomyozitídy
Poruchy nervového systému:
Zriedkavé: Záchvaty
Prípady demyelinizácie CNS pripomínajúce sklerózu multiplex alebo lokalizované demyelinizačné ochorenia, ako je zápal
zrakového nervu a tranzverzálna myelitída (pozri časť 4.4).
P
oruchy oka:
Veľmi zriedkavé:
Periférne demyelinizačné prípady vrátane Guillainov-Barrého syndrómu, chronickej zápalovej demyelinizačnej polyneuropatie, demyelinizačnej polyneuropatie a multifokálnej motorickej neuropatie (pozri časť 4.4)

Menej časté: Zápal dúhovky (uveitída), skleritída
Poruchy srdca a srdcovej činnosti:Zriedkavé: Kongestívne zlyhanie srdca (pozri časť 4.4.).
Poruchy dýchacej sústavy, hrudníka a mediastína:Menej časté: Intersticiálna choroba pľúc (vrátane pneumonitídy a pulmonálnej fibrózy)*
Poruchy pečene a žlčových ciest:
Menej časté: Zvýšené pečeňové enzýmy*
Zriedkavé: Autoimunitná hepatitída
Poruchy kože a podkožného tkaniva:
Časté: Pruritus
Menej časté: Angioedém, urtikária, vyrážka, vyrážka podobná psoriáze, psoriáza (vrátane nového alebo zhoršenia výsypu a pustulárnej
formy hlavne na dlaniach a chodidlách)
Zriedkavé: Kožná vaskulitída (vrátane leukocytoklastickej vaskulitídy), Stevensov-Johnsonov syndróm, erythema multiforme
Veľmi
zriedkavé:
Toxická epidermálna nekrolýza
 P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva:
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva:
Zriedkavé: Subakútny kožný lupus erythematosus, diskoidný lupus erythematosus, syndróm podobný lupusu
Celkové poruchy a reakcie v mieste podania:Veľmi časté: Reakcie v mieste podania (vrátane krvácania, hematómu, erytému, svrbenia, bolesti, opuchu)*
Časté: Horúčka
*pozri Opis vybraných nežiaducich reakcií uvedených nižšie.
Opis vybraných nežiaducichreakciíMalignity a lymfoproliferatívne ochoreniaPri sledovaní 4 114 pacientov s reumatoidnou artritídou, ktorí boli v klinických štúdiách liečení etanerceptom bolo po dobu približne 6 rokov pozorovaných 129 nových malignít rôzneho typu. A to vrátane 231 pacientov, ktorí boli liečení etanerceptom v kombinácii s metotrexátom v dvojročnej, aktívne kontrolovanej klinickej štúdii. Ich výskyt a rozsah boli v týchto klinických štúdiách podobné, aké je možné očakávať v sledovanej populácii. Celkovo boli hlásené 2 malignity v klinických štúdiách trvajúcich približne 2 roky, ktoré zahrnuli 240 pacientov so psoriatickou artritídou, liečených etanerceptom. V klinickej štúdii v populácii 351 pacientov s ankylozujúcou spondylitídou trvajúcej viac ako 2 roky bolo hlásených 6 malignít u pacientov liečených etanerceptom. V skupine
2 711 pacientov so psoriázou liečených etanerceptom v dvojito zaslepených a otvorených štúdiách trvajúcich až do 2,5 roka bolo hlásených 30 malignít a 43 prípadov nemelanómovej rakoviny kože.
V klinických štúdiách v skupine 7 416 pacientov s reumatoidnou artritídou, psoriatickou artritídou, ankylozujúcou spondylitídou a psoriázou liečených etanerceptom bolo celkovo hlásených
18 lymfómov.
Rôzne malígne ochorenia boli hlásené aj v období po uvedení lieku na trh (vrátane karcinómu prsníka a pľúc a lymfómu) (pozri časť 4.4).
Reakcie v mieste podania injekcieV porovnaní s placebom bola u pacientov s reumatickými ochoreniami liečených etanerceptom signifikantne vyššia incidencia lokálnych reakcií v mieste podania (36 % vs. 9 %). Reakcie v mieste
podania sa zvyčajne objavili v prvom mesiaci. Priemerné trvanie bolo približne 3 až 5 dní. Vo väčšine
prípadov reakcií v mieste podania v skupine liečenej etanerceptom sa nepodávala žiadna liečba a väčšina pacientov, ktorí boli liečení dostala lokálne prípravky ako kortikosteroidy alebo perorálne antihistaminiká. Okrem toho, u niektorých pacientov sa objavili opätovné reakcie v mieste podania, ktoré sú charakterizované kožnou reakciou na najčerstvejšom mieste podania spolu so súčasným objavením sa reakcie v mieste predchádzajúceho podania. Vo všeobecnosti boli tieto reakcie prechodné a neopakovali sa počas liečby.
V kontrolovaných klinických štúdiách u pacientov so psoriázou s plakmi sa asi u 13,6 % pacientov liečených etanerceptom objavila reakcia v mieste podania v porovnaní s 3,4 % placebom liečených pacientov počas prvých 12 týždňov liečby.
Závažné infekcie
V placebom kontrolovaných klinických štúdiách sa nepozoroval nárast incidencie závažných infekcií (smrteľných, život ohrozujúcich alebo vyžadujúcich hospitalizáciu alebo intravenózne antibiotiká). Závažné infekcie sa vyskytli u 6,3 % pacientov s reumatoidnou artritídou liečených etanerceptom až
48 mesiacov. K týmto závažným infekciám patrili: absces (na rôznych miestach), bakteriémia, bronchitída, burzitída, celulitída, cholecystitída, hnačky, divertikulitída, endokarditída (podozrenie),
gastroenteritída, hepatitída B, herpes zoster, vred na dolnej končatine, infekcia ústnej dutiny,
osteomyelitída, otitída, peritonitída, pneumónia, pyelonefritída, sepsa, septická artritída, sinusitída, kožná infekcia, kožná ulcerácia, infekcia močového traktu, vaskulitída a infekcia v rane. V 2 roky
trvajúcej, aktívne kontrolovanej štúdii, v ktorej boli pacienti liečení buď samostatne etanerceptom,
samostatne metotrexátom alebo etanerceptom v kombinácii s metotrexátom bol výskyt závažných infekcií podobný vo všetkých liečených skupinách. Avšak, nemožno vylúčiť, že sa s kombináciou etanerceptu a metotrexátu nemôže spájať zvýšený výskyt infekcií.
Nepozorovali sa rozdiely vo výskyte infekcií medzi pacientmi liečenými etanerceptom a placebom pri psoriáze s plakmi v placebom kontrolovaných štúdiách v trvaní do 24 týždňov. Závažné infekcie, ktoré sa objavili u pacientov liečených etanerceptom zahŕňali celulitídu, gastroenteritídu, pneumóniu, cholecystitídu, osteomyelitídu, gastritídu, apendicitídu, streptokokovú fasciitídu, myozitídu, septický šok, divertikulitídu a absces. V dvojito zaslepených a otvorených štúdiách so psoriatickou artritídou bola závažná infekcia (pneumónia) hlásená u 1 pacienta.
Závažné a smrteľné infekcie boli hlásené pri používaní etanerceptu; k hláseným patogénom patrili baktérie, mykobaktérie (vrátane tuberkulózy), vírusy a huby. Niektoré sa objavili v priebehu pár týždňov po začatí liečby etanerceptom u pacientov so základným ochorením (napr. diabetes, kongestívne zlyhanie srdca, anamnéza aktívnej alebo chronickej infekcie) okrem reumatoidnej
artritídy (pozri časť 4.4). Liečba s Benepali môže zvyšovať mortalitu u pacientov s rozvinutou sepsou.
V súvislosti s etanerceptom boli hlásené oportúnne infekcie vrátane invazívnych mykotických, parazitických (vrátane protozoálnych), vírusových (vrátane herpes zoster), bakteriálnych (vrátane Listeria a Legionella) a atypických mykobakteriálnych infekcií. V súbore údajov z klinických štúdií bola celková incidencia oportúnnych infekcií 0,09 % na 15 402 pacientov, ktorí dostávali etanercept. Miera prispôsobená expozícii bola 0,06 prípadov na 100 pacientorokov. V sledovaní po uvedení lieku na trh bola približne polovica zo všetkých prípadov oportúnnych infekcií invazívne mykotické infekcie. Najčastejšie hlásené invazívne mykotické infekcie zahŕňali rody Candida, Pneumocystis, Aspergillus a Histoplasma. Invazívne mykotické infekcie predstavovali viac ako polovicu fatálnych prípadov medzi pacientmi, u ktorých sa vyvinuli oportúnne infekcie. Väčšina hlásení s fatálnym následkom bola u pacientov s pneumóniou Pneumocystis, nešpecifickými systémovými mykotickými infekciami a aspergilózou (pozri časť 4.4).
Autoprotilátky
Vzorky plazmy dospelých pacientov sa vyšetrovali na autoprotilátky vo viacerých časových intervaloch. U pacientov s reumatoidnou artritídou vyšetrovaných na antinukleárne protilátky (ANA) bolo percento novo vzniknutých pozitívnych ANA (≥ 1:40) vyššie u pacientov liečených etanerceptom (11 %) ako u pacientov užívajúcich placebo (5 %). Percento pacientov, u ktorých sa objavila nová pozitivita protilátok proti dvojšpirálovej DNA (anti-dsDNA) bolo tiež vyššie pri rádioimunologickom stanovení (15 % pacientov liečených etanerceptom v porovnaní so 4 % pacientov užívajúcich placebo) a testom Crithidia luciliae (3 % pacientov liečených etanerceptom a žiaden pacient užívajúci placebo). Pomer pacientov liečených etanerceptom, u ktorých sa objavili antikardiolipínové protilátky bol v porovnaní s pacientmi, ktorým bolo podávané placebo podobne zvýšený. Vplyv dlhodobej terapie etanerceptom na vývoj autoimunitného ochorenia nie je známy.
U pacientov vrátane pacientov s pozitívnym reumatoidným faktorom bola zriedkavo hlásená tvorba ďalších protilátok v spojitosti so syndrómom podobným lupusu alebo exantémom, ktorý je zhodný so subakútnym kožným lupusom alebo diskoidným lupusom na základe klinického obrazu a biopsie.
P
ancytopénia a aplastická anémia
Existujú hlásenia po uvedení lieku na trh týkajúce sa pancytopénie a aplastickej anémie, niektoré z nich boli smrteľné (pozri časť 4.4).
Intersticiálna choroba pľúc
Existujú hlásenia po uvedení lieku na trh týkajúce sa intersticiálnej choroby pľúc (vrátane pneumonitídy a pulmonálnej fibrózy), pričom niektoré z nich boli smrteľné.
Súčasná liečba s anakinrou
V štúdiách, v ktorých dospelí pacienti dostávali súčasnú liečbu etanerceptom plus anakinrou sa pozoroval vyšší výskyt závažných infekcií v porovnaní s etanerceptom samotným a u 2 % pacientov (3/139) sa vyvinula neutropénia (absolútny počet neutrofilov < 1 000/mm3). Počas neutropénie sa vyvinula u jedného pacienta celulitída, ktorá ustúpila po hospitalizácii (pozri časti 4.4 a 4.5).
Zvýšené pečeňové enzýmy
V dvojito zaslepených obdobiach kontrolovaných klinických štúdií etanerceptu vo všetkých indikáciách bola frekvencia (podiel incidencie) nežiaducich účinkov spojených so zvýšením pečeňových enzýmov u pacientov dostávajúcich etanercept bez súčasného podávania metotrexátu
0,54 % (frekvencia: menej časté). V dvojito zaslepených obdobiach kontrolovaných klinických štúdií umožňujúcich súčasnú liečbu etanerceptom a metotrexátom bola frekvencia (podiel incidencie)
nežiaducich účinkov spojených so zvýšenými pečeňovými enzýmami 4,18 % (frekvencia: časté).
Pediatrická populácia
Nežiaduce účinky u pediatrických pacientov s juvenilnou idiopatickou artritídou
Všeobecne, nežiaduce udalosti u pediatrických pacientov s juvenilnou idiopatickou artritídou boli, čo sa týka početnosti a typu, podobné ako tie u dospelých pacientov. Rozdiely u dospelých a iné zvláštne okolnosti sa preberajú v nasledujúcich odsekoch.
Typy hlásených infekcií v klinických štúdiách u pacientov s juvenilnou idiopatickou artritídou vo veku
2 až 18 rokov boli vo všeobecnosti mierne až stredne závažné a zhodné s bežne pozorovanými infekciami u ambulantných pediatrických pacientov. Závažné nežiaduce účinky zahŕňali varicellu so znakmi a príznakmi aseptickej meningitídy, ktorá odznela bez následkov (pozri tiež časť 4.4), apendicitídu, gastroenteritídu, depresiu/poruchu osobnosti, kožnú ulceráciu a ezofagitídu/gastritídu, septický šok spôsobený streptokokmi skupiny A, diabetes mellitus typu I a infekcie mäkkých tkanív a operačných rán.
V jednej štúdii u detí s juvenilnou idiopatickou artritídou vo veku 4 až 17 rokov, 43 zo 69 (62 %) detí prekonalo infekciu v období, keď dostávali etanercept počas 3 mesiacov trvania štúdie (časť 1, otvorená), pričom frekvencia a závažnosť infekcií bola podobná u 58 pacientov, ktorí ukončili
12 mesačnú predĺženú liečbu v rámci otvorenej štúdie. Druh a podiel nežiaducich udalostí u pacientov s juvenilnou idiopatickou artritídou bol podobný ako u dospelých s reumatoidnou artritídou a väčšinou
boli mierne. Niektoré nežiaduce udalosti boli hlásené častejšie u 69 pacientov s juvenilnou idiopatickou artritídou, ktorí užívali etanercept 3 mesiace než u 349 dospelých pacientov s reumatoidnou artritídou. Tieto zahŕňajú bolesť hlavy (19 % pacientov, 1,7 prípadu na pacientorok),
nauzeu (9 %, 1,0 prípad na pacientorok), abdominálnu bolesť (19 %, 0,74 prípadu na pacientorok) a vracanie (13 %, 0,74 prípadu na pacientorok).
Boli hlásené 4 prípady syndrómu aktivácie makrofágov v klinických štúdiách juvenilnej idiopatickej artritídy.
V zdrojoch získaných po uvedení lieku na trh boli hlásené prípady zápalového črevného ochorenia a uveitídy u pacientov s JIA liečených etanerceptom, vrátane malého počtu prípadov naznačujúcich pozitívnu odozvu (pozri časť 4.4).
Nežiaduce účinky u pediatrických pacientov so psoriázou s plakmi
V 48 týždňovej klinickej štúdii u 211 detí vo veku od 4 do 17 rokov s pediatrickou psoriázou s plakmi
boli hlásené nežiaduce účinky podobné tým, ktoré boli pozorované v predchádzajúcich štúdiách u dospelých so psoriázou s plakmi.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePočas klinických štúdií pacientov s reumatoidnou artritídou sa nepozorovala žiadna dávku limitujúca toxicita. Najvyššia hodnotená hladina dávky bola intravenózna nárazová dávka 32 mg/m2 s následnými subkutánnymi dávkami 16 mg/m2 podávanými dvakrát týždenne. Jeden pacient s reumatoidnou artritídou si omylom podával 62 mg etanerceptu subkutánne dvakrát týždenne počas
3 týždňov bez výskytu nežiaducich účinkov. Nie je známe antidotum proti etanerceptu.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Imunosupresívum, inhibítory tumor nekrotizujúceho faktora alfa
(TNF-α), ATC kód: L04AB01
Benepali je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.Tumor nekrotizujúci faktor (TNF) je dominantným cytokínom v zápalovom procese reumatoidnej
artritídy. Zvýšené hladiny TNF sú taktiež nachádzané v synovii a psoriatických plakoch u pacientov so psoriatickou artritídou a v plazme a synoviálnom tkanive u pacientov s ankylozujúcou spondylitídou.
U pacientov so psoriázou s plakmi vedie infiltrácia zápalovými bunkami vrátane T-lymfocytov
k zvýšeniu hodnôt TNF v psoriatickej lézii v porovnaní s hodnotami v nepostihnutej koži. Etanercept je kompetetívnym inhibítorom väzby TNF na jeho receptor na povrchu bunky, a tým inhibuje
biologickú aktivitu TNF. TNF a lymfotoxín sú prozápalové cytokíny, ktoré sa viažu na dva odlišné
povrchové receptory buniek: 55-kilodaltonový (p55) a 75-kilodaltonový (p75) receptor pre tumor nekrotizujúci faktor (TNFR). Oba TNF-receptory sa prirodzene vyskytujú v membránovo-viazanej a
solubilnej forme. Predpokladá sa, že solubilné TNFR regulujú biologickú aktivitu TNF.
TNF a lymfotoxín existujú prevažne ako homotriméry, ktorých biologická aktivita závisí od priečnych väzieb povrchových bunkových TNF-receptorov. Dimérne solubilné receptory majú podobne ako etanercept vyššiu afinitu pre TNF ako monomérne receptory a sú výrazne účinnejšími kompetetívnymi inhibítormi väzby TNF na jeho bunkové receptory. Navyše, použitie Fc fragmentu imunoglobulínu
ako fúzneho elementu pri konštrukcii dimérneho receptora predlžuje polčas v sére.
MechanizmusúčinkuVeľká časť kĺbovej patológie pri reumatoidnej artritíde a ankylozujúcej spondylitíde a kožnej patológii v psoriatických plakoch je sprostredkovaná prozápalovými molekulami, ktoré tvoria systém kontrolovaný TNF. Predpokladaný mechanizmus účinku etanerceptu spočíva v kompetetívnej inhibícii väzby TNF na TNFR na povrchu bunky, a tým jeho biologická inaktivácia zabráni TNF sprostredkovanej bunkovej odpovedi. Etanercept môže tiež modulovať biologickú odpoveď kontrolovanú ďalšími molekulami zápalovej kaskády (napr. cytokínmi, adhezívnymi molekulami
alebo proteinázami), ktoré sú indukované alebo regulované prostredníctvom TNF.
KlinickáúčinnosťabezpečnosťTáto časť uvádza údaje zo štyroch randomizovaných, kontrolovaných štúdií u dospelých s reumatoidnou artritídou, jednej štúdie u dospelých so psoriatickou artritídou, jednej štúdie u dospelých s ankylozujúcou spondylitídou, jednej štúdie u dospelých s axiálnou spondyloartritídou bez
rádiografického dôkazu a štyroch štúdií u dospelých so psoriázou s plakmi, troch štúdií u pacientov s juvenilnou idiopatickou artritídou a jednej štúdie u pediatrických pacientov so psoriázou s plakmi.
Dospelí pacienti s reumatoidnou artritídou
Účinnosť etanerceptu sa posudzovala v randomizovanej, dvojito zaslepenej placebom kontrolovanej štúdii. Štúdia hodnotila 234 dospelých pacientov s aktívnou reumatoidnou artritídou, u ktorých zlyhala
terapia najmenej jedným, ale nie viac ako štyrmi chorobu modifikujúcimi antireumatikami (DMARD).
Dávky 10 mg alebo 25 mg etanerceptu alebo placeba boli podávané subkutánne dvakrát týždenne 6 po sebe nasledujúcich mesiacov. Výsledky tejto kontrolovanej štúdie boli vyjadrené v percentuálnom
zlepšení reumatoidnej artritídy s použitím kritérií odpovede na terapiu podľa Americkej
reumatologickej spoločnosti (ACR).
Odpovede ACR 20 a 50 boli vyššie u pacientov liečených etanerceptom v 3. a 6. mesiaci než u pacientov liečených placebom (ACR 20: etanercept 62 % po 3 mesiacoch a 59 % po 6 mesiacoch, placebo 23 % po 3 mesiacoch a 11 % po 6 mesiacoch; ACR 50: etanercept 41 % po 3 mesiacoch a
40 % po 6 mesiacoch, placebo 8 % po 3 mesiacoch a 5 % po 6 mesiacoch; p < 0,01 pre etanercept oproti placebu vo všetkých časových bodoch, ako pre odpoveď ACR 20, tak aj pre odpoveď ACR 50).
Približne 15 % osôb, ktoré dostávali etanercept dosiahlo odpoveď ACR 70 v 3. mesiaci a v 6. mesiaci v porovnaní s menej ako 5 % osôb v skupine s placebom. Medzi pacientmi užívajúcimi etanercept sa klinická odpoveď obvykle dosiahla počas 1 až 2 týždňov od začiatku terapie a takmer vždy do
3 mesiacov. Pozorovala sa odpoveď v závislosti na dávke; výsledky s dávkou 10 mg sa nachádzali na prechode medzi placebom a 25 mg. Etanercept bol výrazne lepší než placebo vo všetkých ACR
kritériách, rovnako ako aj v ďalších ukazovateľoch aktivity reumatoidnej artritídy, ktoré nie sú obsiahnuté v ACR kritériách odpovede na terapiu, takým je napr. ranná stuhnutosť. Dotazník
hodnotenia zdravia (Health Assessment Questionnaire, HAQ), ktorý zahŕňa invaliditu, vitalitu, mentálne zdravie, celkový zdravotný stav a jednotlivé zložky zdravotného stavu asociované s
artritídou bol počas štúdie vyplňovaný každé 3 mesiace. U pacientov liečených etanerceptom v porovnaní s kontrolami došlo v 3. a 6. mesiaci k zlepšeniu vo všetkých oblastiach HAQ.
Po prerušení liečby etanerceptom sa príznaky artritídy spravidla vrátili do jedného mesiaca. Na základe výsledkov z otvorených štúdií sa zistilo, že opätovné nasadenie liečby etanerceptom do
24 mesiacov od jej prerušenia malo za následok rovnako veľkú odpoveď ako u pacientov, ktorí etanercept užívali bez prerušenia liečby. V otvorených, rozširujúcich štúdiách sa u pacientov užívajúcich etanercept bez prerušenia pozorovalo, že stabilné odpovede pretrvávajú až do 10 rokov.
Účinnosť etanerceptu a metotrexátu sa porovnávala v randomizovanej, aktívne kontrolovanej štúdii so slepými rádiografickými hodnoteniami ako primárnym koncovým bodom u 632 dospelých pacientov s aktívnou reumatoidnou artritídou (< 3 roky trvanie), ktorí nikdy neboli liečení metotrexátom. Etanercept sa v dávke 10 mg alebo 25 mg podával subkutánne (s.c.) dvakrát do týždňa po dobu až
24 mesiacov. Dávky metotrexátu sa stupňovali od 7,5 mg týždenne, maximálne až do 20 mg týždenne a to počas prvých 8 týždňov štúdie a pokračovalo sa v nich až do 24 mesiacov. Klinické zlepšenie vrátane nástupu účinku do 2 týždňov bolo pri podávaní etanerceptu 25 mg podobné ako v predchádzajúcich štúdiách a pretrvalo až do 24 mesiacov. Pred liečbou na začiatku štúdie mali pacienti stredne závažný stupeň invalidity s priemerným skóre HAQ 1,4 až 1,5. Liečba etanerceptom 25 mg viedla k významnému zlepšeniu po 12 mesiacoch, pričom 44 % pacientov dosiahlo normálne HAQ skóre (menej ako 0,5). Toto zlepšenie pretrvalo do 2. roku štúdie.
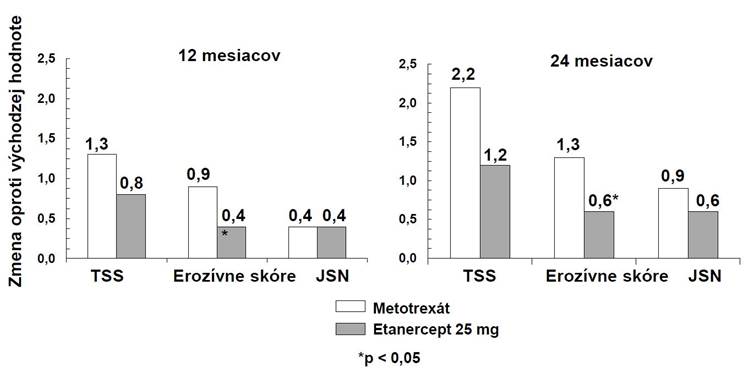
V tejto štúdii sa štrukturálne poškodenie kĺbov hodnotilo rádiograficky a vyjadrovalo sa ako zmena v celkovom skóre ostrosti (Total Sharp Score, TSS) a v jeho zložkách, v erozívnom skóre a v skóre zužovania medzikĺbového priestoru (Joint Space Narrowing Score, JSN). Rtg snímky rúk/zápästí a nôh sa hodnotili pred liečbou a po 6, 12 a 24 mesiacoch liečby. 10 mg dávka etanerceptu mala trvale nižší účinok na štrukturálne poškodenie ako dávka 25 mg. Etanercept 25 mg bol signifikantne lepší ako metotrexát v erozívnom skóre, a to ako po 12, tak i po 24 mesiacoch. Pri liečbe metotrexátom a etanerceptom neboli rozdiely v TSS a JSN štatisticky signifikantné. Pozri výsledky na obrázku uvedenom nižšie.
R
ádiografická progresia: Porovnanie etanerceptu a metotrexátu u pacientov s reumatoidnou artritídou trvajúcou do 3 rokov
V ďalšej aktívne kontrolovanej, dvojito zaslepenej, randomizovanej štúdii sa porovnávala klinická účinnosť, bezpečnosť a rádiografická progresia u pacientov s reumatoidnou artritídou, ktorí boli liečení samotným etanerceptom (25 mg dvakrát týždenne) alebo samotným metotrexátom (7,5 až
20 mg týždenne, priemerná dávka 20 mg) alebo kombináciou etanerceptu a metotrexátu, pričom ich aplikácia začala súčasne; a to u 682 dospelých pacientov s aktívnou reumatoidnou artritídou, trvajúcou
6 mesiacov až 20 rokov (v priemere 5 rokov), ktorí menej ako uspokojivo odpovedali na liečbu
najmenej jedným ochorenie modifikujúcim antireumatikom (DMARD) okrem metotrexátu.
U pacientov liečených etanerceptom v kombinácii s metotrexátom boli signifikantne vyššie odpovede ACR 20, ACR 50 a ACR 70, ako i zlepšenia v skóre DAS a HAQ než u pacientov liečených iba jedným liekom, a to ako 24, tak i po 52 týždňoch (výsledky sú uvedené v nasledujúcej tabuľke). Signifikantne lepšie výsledky etanerceptu v kombinácii s metotrexátom v porovnaní s monoterapiou etanerceptom a monoterapiou metotrexátom sa pozorovali aj po 24 mesiacoch.
Výsledky klinickej účinnosti po 12 mesiacoch: Porovnanie etanerceptu, metotrexátu a etanerceptu v kombinácii s metotrexátom u pacientov s reumatoidnou artritídou trvajúcou6 mesiacov až 20 rokov
K
oncový bod
Metotrexát
(
n = 228)
E
t
anercept
(
n = 223)
E
t
anercept
+
Metotrexát
(
n = 231)
O
dpovede
ACR
a
ACR 20 58,8 % 65,5 % 74,5 %†, Φ
ACR 50 36,4 % 43,0 % 63,2 %†, Φ
ACR 70 16,7 % 22,0 % 39,8 %†, Φ
DA
S (Skóreb)
východiskové skóre
(Skóreb) po
52 týždňoch
5,5 5,7 5,5
3,0 3,0 2,3†, Φ
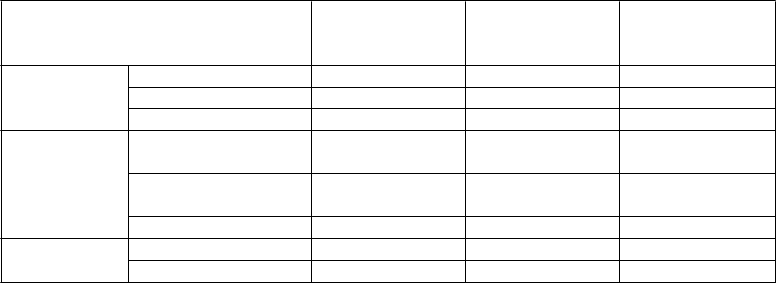
Remisiac 14 % 18 % 37 %†, Φ
HAQ Východiskové skóre 1,7 1,7 1,8
52. týždeň 1,1 1,0 0,8†, Φ
a Pacienti, ktorí neukončili 12 mesiacov v štúdii, boli považovaní za neodpovedajúcich na liečbu.
b Hodnoty DAS sú priemery.
c Remisia je definovaná ako DAS < 1,6.
p-hodnoty párových porovnávaní: † = p < 0,05 pre porovnanie etanerceptu + metotrexátu oproti metotrexátu a Φ = p < 0,05 pre porovnanie etanerceptu + metotrexátu oproti etanerceptu.
V skupine liečenej etanerceptom bola rádiografická progresia po 12 mesiacoch signifikantne nižšia
ako v skupine liečenej metotrexátom, pričom kombinácia bola v spomaľovaní rádiografickej progresie významne lepšia ako obe monoterapie (pozri obrázok nižšie).
Rádiografická progresia: Porovnanie etanerceptu, metotrexátu a etanerceptu v kombinácii s metotrexátom u pacientov s reumatoidnou artritídou trvajúcou 6 mesiacov až 20 rokov (výsledky po 12 mesiacoch) p-hodnoty párových porovnávaní: * = p < 0,05 pre porovnanie etanerceptu oproti metotrexátu, †= p
< 0,05 pre porovnanie etanerceptu + metotrexátu oproti metotrexátu a Φ = p < 0,05 pre porovnanie etanerceptu + metotrexátu oproti etanerceptu.
Signifikantne lepšie výsledky etanerceptu v kombinácii s metotrexátom v porovnaní s monoterapiou etanerceptom a monoterapiou metotrexátom sa pozorovali aj po 24 mesiacoch. Podobne, signifikantné výhody monoterapie etanerceptom v porovnaní s monoterapiou metotrexátom sa pozorovali aj po
24 mesiacoch.
V analýze, v ktorej boli všetci pacienti, ktorí vypadli zo štúdie z akéhokoľvek dôvodu považovaní za pacientov s progresiou bolo percento pacientov bez progresie (zmena CSO ≤ 0,05) po 24 mesiacoch vyššie v skupine liečenej etanerceptom v kombinácii s metotrexátom v porovnaní so skupinou liečenou samotným etanerceptom a so skupinou liečenou samotným metotrexátom (62 %, 50 %,
respektíve 36 %; p < 0,05). Rozdiel medzi samotným etanerceptom a samotným metotrexátom bol tiež signifikantný (p < 0,05). Medzi pacientmi, ktorí ukončili plných 24 mesiacov liečby v štúdii bola
miera bez progresie 78 %, 70 %, respektíve 61 %.
Bezpečnosť a účinnosť 50 mg etanerceptu (dve 25 mg subkutánne injekcie) podaného jedenkrát týždenne sa hodnotila v dvojito zaslepenej, placebom kontrolovanej štúdií u 420 pacientov s aktívnou RA. V tejto štúdií 53 pacientov dostávalo placebo, 214 pacientov dostávalo 50 mg etanerceptu jedenkrát týždenne a 153 pacientov dostávalo 25 mg etanerceptu dvakrát týždenne. Profil bezpečnosti a účinnosti dvoch liečebných režimov etanerceptu bol porovnateľný v ôsmom týždni v účinku na znaky a symptómy RA; údaje v 16. týždni nepreukázali porovnateľnosť (non inferioritu) medzi dvomi liečbami.
D
ospelí pacienti so psoriatickou artritídou
Účinnosť etanerceptu sa hodnotila v randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii u 205 pacientov so psoriatickou artritídou. Pacienti boli vo veku od 18 do 70 rokov a mali
aktívnu psoriatickú artritídu (≥ 3 opuchnuté kĺby a ≥ 3 stuhnuté kĺby) aspoň v jednej z nasledujúcich
foriem: (1) distálne interfalangeálne (DIP) postihnutie; (2) polyartikulárna artritída (neprítomnosť reumatoidných uzlíkov a prítomnosť psoriázy); (3) mutilujúca artritída; (4) asymetrická psoriatická artritída alebo (5) ankylóza podobná spondylitíde. Pacienti mali taktiež psoriázu s plakmi s kvalifikujúcou cieľovou léziou ≥ 2 cm v priemere.
Pacienti boli v minulosti liečení NSAIDs (86 %), DMARDs (80 %) a kortikosteroidmi (24 %).
Pacienti práve liečení metorexátom (stabilní počas ≥ 2 mesiacov) mohli pokračovať pri stabilnej dávke metotrexátu ≤ 25 mg/týždeň. Dávky 25 mg etanerceptu (založené na štúdiách pre zistenie dávky u
pacientov s reumatoidnou artritídou) alebo placeba boli podávané subkutánne dvakrát týždenne počas
6 mesiacov. Na konci dvojito zaslepenej štúdie mohli pacienti vstúpiť do dlhodobej otvorenej pokračujúcej štúdie s celkovým trvaním až do 2 rokov.
Klinické odpovede sa vyjadrili ako percento pacientov, ktorí dosiahli odpoveď ACR 20, 50 a 70 a percento zlepšenia podľa kritérií odpovede u psoriatickej artritídy (Psoriatic Arthritis Response Criteria, PsARC). Výsledky sú sumarizované v nižšie uvedenej tabuľke.
Odpoveď pacientov so psoriatickou artritídou v placebom kontrolovanej štúdii
O
dpoveď psoriatickej artritídy
P
e
rcento pacientov
Placebo n = 104
E
t
anercept
a
n = 101
 AC
R 20
AC
R 20 Mesiac 3 15 59b
Mesiac 6 13 50b
ACR 50 Mesiac 3 4 38b
Mesiac 6 4 37b
ACR 70 Mesiac 3 0 11b
Mesiac 6 1 9c
PsARC Mesiac 3 31 72b
Mesiac 6 23 70b a 25 mg etanercept s.c. dvakrát týždenne
b p < 0,001, etanercept vs. placebo
c p < 0,01, etanercept vs. placebo
Medzi pacientmi so psoriatickou artritídou, ktorí dostávali etanercept bola klinická odpoveď zjavná v čase prvej návštevy (4 týždne) a pretrvávala počas 6 mesiacov terapie. Etanercept bol signifikantne lepší než placebo vo všetkých charakteristikách aktivity ochorenia (p < 0,001) a odpoveď bola podobná so súčasnou metotrexátovou terapiou alebo bez nej. Kvalita života u pacientov so psoriatickou artritídou sa hodnotila pri každej návšteve s použitím indexu invalidity HAQ. Skóre indexu invalidity bolo signifikantne zlepšené pri všetkých návštevách u pacientov so psoriatickou artritídou liečených etanerceptom v porovnaní s placebom (p < 0,001).
V štúdii psoriatickej artritídy boli hodnotené rádiografické zmeny. RTG snímky rúk a zápästí boli zaznamenané vo východiskovom stave a v 6., 12. a 24. mesiaci. Modifikované TSS v 12. mesiaci je znázornené v tabuľke uvedenej nižšie. V analýze, v ktorej všetci pacienti, ktorí vypadli zo štúdie z akéhokoľvek dôvodu boli považovaní za pacientov s progresiou bol percentuálny podiel pacientov bez progresie (zmena TSS ≤ 0,5) v 12. mesiaci vyšší v skupine etanerceptu v porovnaní so skupinou placeba (73 % vs. 47 %, p ≤ 0,001). Účinok etanerceptu na rádiografickú progresiu bol zachovaný u pacientov, ktorí pokračovali v liečbe počas druhého roka. Spomalenie poškodenia periférnych kĺbov sa pozorovalo u pacientov s polyartikulárnym symetrickým postihnutím kĺbov.
P
r
i
e
m
erná (SE) ročná zmena celkového skóre ostrosti (TSS) z východiskového stavu
Č
as
Placebo
(
n = 104)
E
t
anercept
(
n = 101)

12. mesiac 1,00 (0,29) -0,03 (0,09)a
SE = štandardná chyba
a p = 0,0001
Liečba etanerceptom viedla k zlepšeniu fyzickej funkcie v priebehu dvojito zaslepenej fázy a toto zlepšenie sa udržalo počas dlhodobej expozície až do 2 rokov.
Nie sú k dispozícii dostatočné údaje o účinnosti etanerceptu u pacientov s artropatiami podobnými ankylozujúcej spondylitíde a psoriatickej artritíde mutilans pre malý počet sledovaných pacientov.
U pacientov so psoriatickou artritídou nebola uskutočnená štúdia s dávkovacím režimom 50 mg jedenkrát týždenne. V tejto populácii bol dôkaz účinnosti pre dávkovací režim jedenkrát týždenne založený na údajoch zo štúdie u pacientov s ankylozujúcou spondylitídou.
Dospelí pacienti s ankylozujúcou spondylitídouÚčinnosť etanerceptu pri ankylozujúcej spondylitíde sa hodnotila v 3 randomizovaných, dvojito zaslepených štúdiách porovnávajúcich podávanie etanerceptu 25 mg dvakrát týždenne s placebom.
Celkovo bolo do štúdie zaradených 401 pacientov, z ktorých 203 bolo liečených etanerceptom.
Najväčšia z týchto štúdií (n = 277) zahŕňala pacientov vo veku 18 až 70 rokov s aktívnou ankylozujúcou spondylitídou definovanou pomocou vizuálnej analógovej škály (VAS) so skóre ≥ 30 pre priemernú dĺžku trvania a intenzitu rannej stuhnutosti a VAS skóre ≥ 30 pre aspoň 2 z nasledujúcich 3 parametrov: pacientovo globálne hodnotenie, priemer hodnôt VAS pre nočnú bolesť chrbta a celkovú bolesť chrbta, priemer z 10 otázok Bath funkčného indexu ankylozujúcej spondylitídy (
Bath Ankylosing Spondylitis Functional Index, BASFI). Pacienti užívajúci DMARD, nesteroidové antiflogistiká alebo kortikosteroidy mohli pokračovať v ich užívaní pri stabilných dávkach. Pacienti s kompletnou ankylózou chrbtice neboli do štúdie zahrnutí. Dávky 25 mg etanerceptu (na základe štúdií dávok u pacientov s reumatoidnou artritídou) alebo placebo boli podávané dvakrát týždenne počas 6 mesiacov u 138 pacientov.
Primárny ukazovateľ účinnosti (ASAS 20) bol ≥ 20 % zlepšenie aspoň u 3 zo 4 domén hodnotenia u ankylozujúcej spondylitídy (
Assessment in Ankylosing Spondylitis, ASAS) (zahŕňa pacientovo globálne hodnotenie, bolesť chrbta, BASFI a zápal) a žiadne zhoršenie v ostatných doménach.
ASAS 50 a 70 odpovede používali rovnaké kritériá s 50 % alebo 70 % zlepšením.
V porovnaní s placebom sa pri liečbe etanerceptom dosiahlo signifikantné zlepšenie ASAS 20, ASAS 50 a ASAS 70 už 2 týždne po zahájení liečby.
O
dpovede pacientov s ankylozujúcou spondylitídou v placebom kontrolovanej štúdii
O
dpoveď ankylozujúcej spondylitídy
A
SAS 20
P
e
rcento pacientov
Placebo n = 139
E
t
anercept n = 138

Týždne 2 22 46a
Mesiace 3 27 60a
Mesiace 6 23 58a
ASAS 50Týždne 2 7 24a
Mesiace 3 13 45a
Mesiace 6 10 42a
ASAS 70Týždne 2 2 12b
Mesiace 3 7 29b
Mesiace 6 5 28b a p < 0,001, etanercept vs. placebo
b p = 0,002, etanercept vs. placebo
Medzi pacientmi s ankylozujúcou spondylitídou dostávajúcimi etanercept bola klinická odpoveď zjavná v čase prvej návštevy (2 týždne) a pretrvávala počas 6 mesačnej terapie. Na začiatku terapie boli u pacientov so súčasnou liečbou alebo bez nej odpovede podobné.
Podobné výsledky sa získali v 2 menších štúdiách s ankylozujúcou spondylitídou.
V štvrtej štúdii bola hodnotená bezpečnosť a účinnosť etanerceptu 50 mg (dvoch 25 mg subkutánnych injekcií) podávaných jedenkrát týždenne verzus etanercept 25 mg podávaný dvakrát týždenne v dvojito zaslepenej, placebom kontrolovanej klinickej štúdii u 356 pacientov s aktívnou ankylozujúcou spondylitídou. Profily bezpečnosti a účinnosti režimov 50 mg jedenkrát týždenne a 25 mg dvakrát týždenne boli podobné.
Dospelí pacienti s axiálnou spodyloartritídou bez rádiografického dôkazuÚčinnosť etanerceptu sa u pacientov s axiálnou spondyloartritídou bez rádiografického dôkazu
(nr-AxSpa) hodnotila v randomizovanej, 12-týždňovej dvojito zaslepenej, placebom kontrolovanej štúdii. V štúdii sa vyhodnocovalo 215 dospelých pacientov (modifikovaná populácia podľa liečebného zámeru) s aktívnou formou nr-AxSpa (vo veku 18 až 49 rokov) definovaných ako pacienti, ktorí spĺňajú kritériá axiálnej spondyloartritídy podľa klasifikácie ASAS, ale nesplnili modifikované newyorské kritériá pre AS. U pacientov sa tiež vyžadovalo, aby mali neadekvátnu odpoveď alebo aby neznášali dve alebo viac NSAIDs. V období dvojitého zaslepenia pacienti dostávali etanercept v dávke
50 mg týždenne alebo placebo počas 12 týždňov. Primárnym dôkazom účinnosti (ASAS 40) bolo
40 % zlepšenie v minimálne troch zo štyroch domén ASAS a neprítomnosť zhoršenia v zostávajúcej doméne. Po období dvojitého zaslepenia nasledovalo odslepené obdobie, počas ktorého všetci pacienti dostávali etanercept v dávke 50 mg týždenne počas ďalších 92 týždňov. Na vyhodnotenie zápalu na začiatku a počas týždňov 12 a 104 sa vykonali vyšetrenia sakroiliakálneho kĺbu a chrbtice pomocou MRI.
V porovnaní s placebom viedla liečba etanerceptom k štatisticky významnému zlepšeniu v ASAS 40, ASAS 20 a ASAS 5/6. Významné zlepšenie sa tiež pozorovalo pri čiastočnej remisii ASAS a BASDAI 50. Výsledky v 12. týždni sú uvedené v tabuľke nižšie.
O
dpoveď účinnosti v placebom kontrolovanej štúdii nr-AxSpa: Percento pacientov, ktorí dosiahli cieľové ukazovatele
D
vojito zaslepené klinické
odpovede v 12. týždni
Placebo
n = 106 až 109*
E
t
anercept
n = 103 až 105*
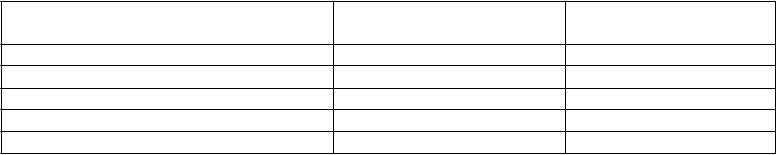
ASAS** 40 15,7 32,4b
ASAS 20 36,1 52,4c ASAS 5/6 10,4 33,0a ASAS čiastočnej remisie 11,9 24,8c
BASDAI***50 23,9 43,8b
*Niektorí pacienti neposkytli kompletné údaje pre každý cieľový ukazovateľ
**ASAS = Assessments in Spondyloarthritis International Society
***Bath Ankylosing Spondylitis Disease Activity Index
a: p < 0,001, b: < 0,01 a c: < 0,05 medzi etanerceptom a placebom v uvedenom poradí
U pacientov, ktorí dostávali etanercept, sa v 12. týždni objavilo štatisticky významné zlepšenie v skóre SPARCC (
Spondyloarthritis Research Consortium of Canada) pri sakroiliakálnom kĺbe (SIJ) na základe merania MRI. Upravená priemerná zmena z východiskovej hodnoty bola 3,8 u pacientov liečených etanerceptom (n = 95) oproti 0,8 u pacientov liečených placebom (n = 105) (p < 0,001).
V 104. týždni u všetkých pacientov, ktorí dostávali etanercept, priemerná zmena z východiskovej hodnoty v skóre SPARCC, na základe merania MRI, bola pri SIJ 4,64 (n = 153) a 1,40 (n = 154) pre
chrbticu.
Vo väčšine hodnotení kvality života súvisiacej so zdravotným stavom a hodnotení telesných funkcií vrátane BASFI (
Bath Ankylosing Spondylitis Functional Index), skóre celkového zdravotného stavu EuroQol 5D a skóre telesnej zložky SF-36 sa pri etanercepte preukázalo štatisticky významne väčšie zlepšenie od východiskového stavu do 12. týždňa v porovnaní s placebom.
Klinické odpovede medzi pacientmi s nr-AxSpa, ktorí dostávali etanercept, boli zreteľné v čase prvej návštevy (2 týždne) a počas 2 rokov liečby sa udržali. Počas 2 rokov liečby sa udržalo aj zlepšenie kvality života súvisiacej so zdravím a zlepšenie fyzických funkcií. 2-ročné údaje neodhalili žiadne nové bezpečnostné zistenia. V 104. týždni 8 pacientov progredovalo do stupňa 2 bilaterálneho skóre RTG chrbtice, podľa modifikovaných Newyorských kritérií, svedčiacich pre axiálnu spondyloartropatiu.
Dospelí pacienti so psoriázou s plakmiEtanercept sa odporúča na použitie u pacientov podľa definície uvedenej v časti 4.1. Pacienti, u ktorých „odpoveď zlyhala“ sa v cieľovej populácii definuje nedostatočnou odpoveďou (PASI < 50
alebo PGA nižší stupeň ako dobrá) alebo zhoršením ochorenia počas liečby alebo ak sa liečba jednou z
troch dostupných systémových terapií podáva dostatočne dlho a v adekvátnej dávke, aby sa mohla zhodnotiť odpoveď.
Účinnosť etanerceptu oproti iným systémovým terapiám u pacientov so stredne závažnou až závažnou psoriázou (odpovedajúcou na inú systémovú terapiu) sa nehodnotila v priamych porovnávajúcich štúdiách etanerceptu s inými systémovými terapiami. Namiesto toho sa bezpečnosť a účinnosť etanerceptu hodnotila v štyroch randomizovaných, dvojito zaslepených, placebom kontrolovaných štúdiách. Primárny sledovaný parameter účinnosti vo všetkých štyroch štúdiách bol podiel pacientov v každej liečebnej skupine, ktorí dosiahli PASI 75 (to znamená najmenej 75 % zlepšenie Psoriatickej plochy a Indexu závažnosti oproti východiskovému stavu) po 12 týždňoch.
Štúdia 1 bola štúdia II. fázy u pacientov s aktívnou, ale klinicky stabilnou psoriázou s plakmi, ktorá postihovala ≥ 10 % povrchu tela, ktorí mali ≥ 18 rokov. Bolo randomizovaných 112 pacientov, ktorí dostávali 25 mg etanerceptu (n = 57) alebo placebo (n = 55) dvakrát do týždňa po dobu 24 týždňov.
Štúdia 2 hodnotila 652 pacientov s chronickou psoriázou s plakmi a mala tie isté zaraďovacie kritériá ako štúdia 1 plus psoriatická plocha a index závažnosti (PASI) v skríningu minimálne 10. Etanercept
sa podával v dávkach 25 mg raz za týždeň, 25 mg dvakrát za týždeň alebo 50 mg dvakrát za týždeň v trvaní 6 mesiacov. Počas prvých 12 týždňov dvojito zaslepenej periódy liečby pacienti dostávali placebo alebo jednu z troch uvedených dávok etanerceptu. Po 12. týždňoch liečby začali pacienti
v skupine s placebom so zaslepenou liečbou etanerceptom (25 mg dvakrát do týždňa); pacienti v aktívne liečených skupinách pokračovali do 24. týždňa v dávke, na ktorú boli pôvodne randomizovaní.
Štúdia 3 hodnotila 583 pacientov a mala také isté zaraďovacie kritériá ako štúdia 2. Pacienti v tejto štúdii dostávali dávku 25 mg alebo 50 mg etanerceptu alebo placebo, dvakrát do týždňa v trvaní
12 týždňov a potom dostali všetci pacienti etanercept 25 mg dvakrát týždenne v otvorenej fáze počas ďalších 24 týždňov.
Štúdia 4 hodnotila 142 pacientov a mala podobné vstupné kritériá ako štúdie 2 a 3. Pacienti dostávali v tejto štúdii dávku 50 mg etanerceptu alebo placebo jedenkrát týždenne v trvaní 12 týždňov a potom dostávali všetci pacienti v otvorenej fáze etanercept 50 mg jedenkrát týždenne počas ďalších
12 týždňov.
V štúdii 1 bol v skupine liečenej etanerceptom signifikantne vyšší podiel pacientov s PASI 75 odpoveďou v týždni 12 (30 %) v porovnaní s placebo skupinou (2 %) (p < 0,0001). Po 24 týždňoch dosiahlo 56 % pacientov v skupine liečenej etanerceptom PASI 75 v porovnaní s 5 % v skupine
s placebom. Kľúčové výsledky štúdie 2, 3 a 4 sú uvedené nižšie.
Odpovede pacientov so psoriázou s plakmi v štúdiách 2, 3 a 4
Štúdia 2 Štúdia 3 Štúdia 4
Etanercept
Etanercept
Etanercept
Odpoveď
( %)
Place- bo
25 mg 2x za týždeň
50 mg 2x za týždeň
Place- bo
25 mg
2x za týždeň
50 mg
2x za týždeň
Place- bo
50 mg
1x za týždeň
50 mg
1x za týždeň
n =
166
n =
162
n =
162
n =
164
n =
164
n =
193
n =
196
n =
196 n = 46 n = 96 n = 90
týždeň
12
týždeň
12
týždeň
24a
týždeň
12
týždeň
24a
týždeň
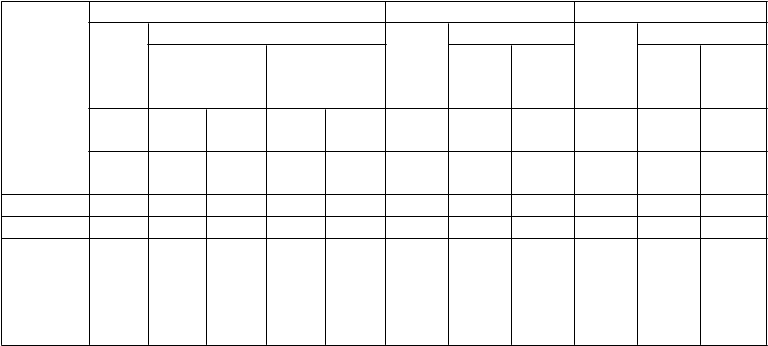
12
týždeň
12
týždeň
12
týždeň
12
týždeň
12
týždeň
24a
PASI 50 14 58* 70 74* 77 9 64* 77* 9 69* 83
PASI 75 4 34* 44 49* 59 3 34* 49* 2 38* 71
DSGAb, čistý
alebo takmer čistý
5 34* 39 49* 55 4 39* 57* 4 39* 64
*p ≤ 0,0001 v porovnaní s placebom
a V štúdiách 2 a 4 sa nerobili žiadne štatistické porovnania s placebom v týždni 24 pretože pôvodná placebo skupina začala dostávať etanercept 25 mg dvakrát za týždeň alebo 50 mg jedenkrát za týždeň
od týždňa 13 do týždňa 24.
b Globálne hodnotenie stavu dermatológom. Čistý alebo takmer čistý definovaný ako 0 alebo 1 na škále 0 až 5.
U pacientov trpiacich na psoriázu s plakmi, ktorí dostávali etanercept boli signifikantné odpovede v porovnaní s placebom zrejmé v čase prvej návštevy (2 týždne) a pretrvali počas 24 týždňov liečby.
Štúdia 2 mala aj obdobie prerušenia počas ktorého sa u pacientov, ktorí dosiahli najmenej 50 % zlepšenie PASI v týždni 24 zastavila liečba. Bez liečby sa u pacientov sledovalo znovu objavenie ložísk (PASI ≥ 150 % referenčnej hodnoty) a čas do nástupu relapsu (definovaného ako strata najmenej polovice zlepšenia dosiahnutého medzi východiskovým stavom a týždňom 24). Počas obdobia prerušenia sa príznaky psoriázy postupne vracali s mediánom času do relapsu 3 mesiace. Nepozorovala sa opätovná erupcia, ani so psoriázou súvisiace závažné nežiaduce udalosti. Našli sa
určité dôkazy podporujúce prospešnosť opakovanej liečby etanerceptom u pacientov, ktorí iniciálne odpovedajú na liečbu.
V štúdii 3 väčšina pacientov (77 %), ktorí boli pôvodne randomizovaní na 50 mg dvakrát do týždňa a ich dávka etanerceptu sa znížila v týždni 12 na 25 mg dvakrát do týždňa si udržala PASI 75 odpoveď až do týždňa 36. U pacientov, ktorí dostávali 25 mg dvakrát do týždňa počas celej štúdie pokračovalo zlepšovanie PASI 75 odpovede medzi týždňami 12 a 36.
V štúdii 4 mala skupina liečená etanerceptom vyšší podiel pacientov s PASI 75 v týždni 12 (38 %) v porovnaní so skupinou liečenou placebom (2 %) (p < 0,0001). U pacientov, ktorí dostávali počas štúdie 50 mg jedenkrát do týždňa sa účinnosť neustále zlepšovala a 71 % pacientov dosiahlo PASI 75 v týždni 24.
V dlhotrvajúcich (až do 34 mesiacov) otvorených štúdiách, v ktorých sa etanercept podával bez prerušenia sa klinické odpovede zachovali a bezpečnosť bola porovnateľná s bezpečnosťou pri krátkotrvajúcich štúdiách.
Analýza klinických údajov neukázala žiadne základné charakteristiky ochorenia, ktoré by mohli byť nápomocné pre lekárov pri výbere najvhodnejšieho dávkovania (intermitentného alebo kontinuálneho). Preto výber intermitentnej alebo kontinuálnej liečby má byť založený na posúdení lekára a na individuálnych potrebách pacienta.
Protilátky proti etanerceptu
Protilátky proti etanerceptu sa našli v plazme niektorých osôb liečených etanerceptom. Tieto protilátky vo všeobecnosti neboli neutralizujúce a sú dočasné. Neprejavila sa korelácie medzi tvorbou protilátky
a klinickou odpoveďou alebo nežiaducimi udalosťami.
Pediatrická populácia
Pediatrickí pacienti s juvenilnou idiopatickou artritídou
Bezpečnosť a účinnosť etanerceptu bola hodnotená v dvoch častiach štúdie so 69 deťmi
s polyartikulárnym priebehom juvenilnej idiopatickej artritídy v rôzne rozvinutých štádiách juvenilnej idiopatickej artritídy (polyartritída, oligoartritída, systémový začiatok). Zaradení boli pacienti vo veku od 4 do 17 rokov, so stredne až vysoko aktívnou juvenilnou idiopatickou artritídou s polyartikulárnym priebehom, refraktérnou na metotrexát alebo s intoleranciou metotrexátu; pacienti zostali na stabilnej dávke jedného nesteroidového antiflogistika a/alebo prednizónu (< 0,2 mg/kg/deň alebo maximálne
10 mg). V časti 1 dostávali všetci pacienti 0,4 mg/kg (maximálne 25 mg v dávke) etanerceptu
subkutánne dvakrát týždenne. V časti 2 boli pacienti s klinickou odpoveďou na 90. deň randomizovaní na tých, ktorí zostanú na liečbe etanerceptom alebo tých, ktorí budú užívať placebo počas 4 mesiacov
a hodnotilo sa u nich opätovné vzplanutie ochorenia. Odpoveď sa merala použitím ACR Pedi 30, ktorá je určená ako 30 % zlepšenie v najmenej troch zo šiestich a 30 % zhoršenie v nie viac ako jednom zo šiestich JRA hlavných kritérií, vrátane počtu aktívnych kĺbov, obmedzenia hybnosti, celkového hodnotenia lekárom a pacientom/rodičom, funkčného hodnotenia a rýchlosti sedimentácie erytrocytov (Erythrocyte Sedimentation Rate, ESR). Vzplanutie ochorenia sa definovalo ako 30 % zhoršenie
v troch zo šiestich JRA hlavných kritérií a 30 % zlepšenie v nie viac ako jednom zo šiestich JRA
hlavných kritérií a minimálne dva aktívne kĺby.
V časti 1 tejto štúdie malo 51 zo 69 (74 %) pacientov dokázateľnú klinickú odpoveď, ktorí vstúpili do časti 2. V časti 2 opätovne vzplanulo ochorenie u 6 z 25 (24 %) pacientov, ktorí zostali na liečbe etanerceptom v porovnaní s 20 z 26 (77 %) pacientov, ktorí dostávali placebo (p = 0,007). Od začiatku časti 2 bol priemerný čas do vzplanutia 116 dní u pacientov užívajúcich etanercept a 28 dní
u pacientov dostávajúcich placebo. Z pacientov s dokázateľnou klinickou odpoveďou na 90. deň, ktorí
po vstupe do časti 2 zostali na etanercepte, u niektorých pokračovalo zlepšovanie stavu od 3. do
7. mesiaca, zatiaľ čo u tých, ktorí dostávali placebo k zlepšeniu nedošlo.
V nezaslepenom predĺžení štúdie zameranom na bezpečnosť pokračovalo 58 pediatrických pacientov z vyššie uvedenej štúdie (vo veku od 4 rokov v čase zaradenia) v užívaní etanerceptu až do doby 10 rokov. Miery závažných nežiaducich udalostí a závažných infekcií sa pri dlhodobej expozícii nezvýšili.
Dlhodobá bezpečnosť monoterapie etanerceptom (n = 103), kombinácie etanercept plus metotrexát
(n = 294), alebo monoterapie metotrexátom (n = 197) sa stanovila pre obdobie do 3 rokov v registri
594 detí s juvenilnou idiopatickou artritídou vo veku od 2 do 18 rokov, z ktorých 39 bolo vo veku 2 až
3 roky. Celkovo boli infekcie hlásené častejšie u pacientov liečených etanerceptom v porovnaní so samotným metotrexátom (3,8 vs. 2 %) a infekcie súvisiace s použitím etanerceptu mali závažnejší charakter.
V ďalšej nezaslepenej štúdii s jedným ramenom bolo 60 pacientov s rozšírenou oligoartritídou
(15 pacientov vo veku 2 až 4 roky, 23 pacientov vo veku 5 až 11 rokov a 22 pacientov vo veku 12 až
17 rokov), 38 pacientov s artritídou spojenou s entezitídou (12 až 17 rokov) a 29 pacientov
s psoriatickou artritídou (12 až 17 rokov) liečených etanerceptom v dávke 0,8 mg/kg (maximálne do
50 mg v dávke) podávaným týždenne počas 12 týždňov. Pri každom z podtypov JIA splnila väčšina pacientov kritériá ACR Pedi 30 a preukázala klinické zlepšenie v sekundárnych cieľových ukazovateľoch, ako je počet citlivých kĺbov a celkové hodnotenie lekárom. Profil bezpečnosti bol zhodný s profilom pozorovaným v ďalších štúdiách JIA.
Neuskutočnili sa štúdie u pacientov s juvenilnou idiopatickou artritídou na zhodnotenie účinkov pokračujúcej liečby etanerceptom u pacientov, ktorí neodpovedajú do 3 mesiacov od začiatku liečby etanerceptom. Navyše sa neuskutočnili štúdie na zhodnotenie účinkov prerušenia alebo zníženia odporúčanej dávky etanerceptu po jeho dlhodobom používaní u pacientov s JIA.
Pediatrickí pacienti so psoriázou s plakmi
Účinnosť etanerceptu bola hodnotená v randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii u 211 pediatrických pacientov vo veku od 4 do 17 rokov so stredne závažnou až závažnou psoriázou s plakmi (definované podľa sPGA skóre ≥ 3, vrátane ≥ 10 % z BSA a PASI ≥ 12). Zaradení pacienti boli v minulosti liečení fototerapiou alebo systémovou liečbou alebo neboli dostatočne kontrolovaní topickou liečbou.
Pacienti dostávali etanercept 0,8 mg/kg (maximálne do 50 mg) alebo placebo jedenkrát týždenne po dobu 12 týždňov. V 12. týždni malo pozitívnu odpoveď účinnosti (napr. PASI 75) viac pacientov randomizovaných na etanercept ako pacientov randomizovaných na placebo.
Výsledky štúdie pediatrickej psoriázy s plakmi v 12. týždni
E
t
anercept
0,8 mg/kg jedenkrát týždenne
 (
N = 106)
Placebo
(
N = 105)
(
N = 106)
Placebo
(
N = 105)
PASI 75, n (%) 60 (57 %)a 12 (11 %) PASI 50, n (%) 79 (75 %)a 24 (23 %)
sPGA „čistý“ alebo „takmer čistý
(minimálny)“, n (%)
56 (53 %)a 14 (13 %)
Skratka: sPGA- statické globálne hodnotenie lekárom (static Physician Global Assessment)
a p < 0,0001 porovnané s placebom
Po 12. týždňovej dvojito zaslepenej fáze liečby dostávali všetci pacienti etanercept 0,8 mg/kg (maximálne do 50 mg) jedenkrát týždenne počas ďalších 24 týždňov. Odpovede pozorované počas otvorenej fázy štúdie boli podobné ako tie pozorované v dvojito zaslepenej fáze.
Počas randomizovaného vysadenia lieku sa u signifikantne väčšieho počtu pacientov
re-randomizovaných na placebo objavil relaps ochorenia (strata odpovede PASI 75) v porovnaní
s pacientmi re-randomizovanými na etanercept. Pri pokračujúcej liečbe boli odpovede udržané až do
48 týždňov.
Dlhodobá bezpečnosť a účinnosť etanerceptu v dávke 0,8 mg/kg (do 50 mg) jedenkrát týždenne sa hodnotila v otvorenej predĺženej časti štúdie u 181 pediatrických pacientov so psoriázou s plakmi, a to po 48 týždňoch spomínaných vyššie, až do 2 rokov. Dlhodobé skúsenosti s etanerceptom boli vo všeobecnosti porovnateľné s pôvodnou 48 týždňov trvajúcou štúdiou a nepreukázali žiadne nové zistenia týkajúce sa bezpečnosti.
5.2 Farmakokinetické vlastnosti
Sérové hladiny etanerceptu boli stanovené ELISA (Enzyme-Linked Immunosorbent Assay) metódou, ktorá umožňuje detekovať ELISA-reaktívne degradačné produkty, rovnako ako aj materskú látku.
Absorpcia
Etanercept sa pomaly absorbuje z miesta podania subkutánnej injekcie, maximálnu koncentráciu dosahuje približne 48 hodín po podaní jednotlivej dávky. Absolútna biologická dostupnosť je 76 %.
Pri podávaní dvakrát týždenne sa očakáva, že ustálené koncentrácie budú približne dvakrát vyššie, ako tie namerané po jednotlivých dávkach. Po subkutánnom podaní jednej 25 mg dávky etanerceptu bola priemerná maximálna koncentrácia v plazme zdravých dobrovoľníkov 1,65 ± 0,66 µg/ml a plocha pod
krivkou (AUC) bola 235 ± 96,6 µg × h/ml. Priemerné plazmatické koncentrácie u stabilizovaných liečených RA pacientov boli Cmax 2,4 mg/l vs 2,6 mg/l, Cmin 1,2 mg/l vs 1,4 mg/l a parciálne AUC
297 mg × h/l vs 316 mg × h/l pre etanercept 50 mg jedenkrát týždenne (n = 21) vs etanercept 25 mg dvakrát týždenne (n = 16). V otvorenej jednodávkovej skríženej štúdii s dvomi druhmi liečby u zdravých dobrovoľníkov sa zistilo, že etanercept podávaný ako jedna 50 mg/ml injekcia je
bioekvivalentný dvom súčasne podaným 25 mg/ml injekciám.
V populačnej farmakokinetickej analýze u pacientov s ankylozujúcou spondylitídou boli parametre AUC rovnovážneho stavu etanerceptu 466 µg × h/ml a 474 µg × h/ml pre etanercept 50 mg jedenkrát týždenne (n = 154), respektíve 25 mg dvakrát týždenne (n = 148).
Distribúcia
Na vyjadrenie závislosti koncentrácie od času je pre etanercept potrebná biexponenciálna krivka. Stredný distribučný objem etanerceptu je 7,6 l, zatiaľ čo distribučný objem v ustálenom stave je 10,4 l.
Eliminácia
Etanercept sa z tela vylučuje pomaly. Polčas je dlhý, asi 70 hodín. Klírens je približne 0,066 l/h u pacientov s reumatoidnou artritídou, čo je o niečo nižšia hodnota než 0,11 l/h, ktorá sa pozorovala u
zdravých dobrovoľníkov. Farmakokinetika etanerceptu u pacientov s reumatoidnou artritídou,
ankylozujúcou spondylitídou a psoriázou s plakmi je podobná.
Nie je nijaký zjavný rozdiel vo farmakokinetike medzi mužmi a ženami. Linearita
Dávková distribúcia nebola formálne vyhodnotená, ale v rámci dávkového rozmedzia sa nezistila saturácia klírensu.
Osobitné skupiny pacientov
Porucha funkcie obličiek
Aj keď po podaní rádioaktívne značeného etanerceptu pacientom a dobrovoľníkom dochádza k vylučovaniu rádioaktivity močom, neboli zaznamenané zvýšené koncentrácie etanerceptu u pacientov
s akútnym renálnym zlyhaním. Porucha funkcie obličiek nevyžaduje zmenu v dávkovaní.
P
orucha funkcie pečene
U pacientov s akútnym hepatálnym zlyhaním sa nepozorovali zvýšené koncentrácie etanerceptu. Prítomnosť poruchy funkcie pečene nevyžaduje zmenu v dávkovaní.
Starší ľudía
Vplyv pokročilého veku sa sledoval v populačnej farmakokinetickej analýze plazmatických hladín etanerceptu. Odhady klírensu a distribučného objemu u pacientov medzi 65 a 87 rokmi boli podobné ako u pacientov mladších ako 65 rokov.
Pediatrická populácia
Pediatrickí pacienti s juvenilnou idiopatickou artritídou
V skúšaní použitia etanerceptu pri polyartikulárnom priebehu juvenilnej idiopatickej artritídy sa
69 pacientom (vo veku 4 až 17 rokov) podával etanercept v dávke 0,4 mg/kg dvakrát týždenne počas troch mesiacov. Profily plazmatických koncentrácií boli podobné ako u dospelých pacientov
s reumatoidnou artritídou. Najmladšie deti (vo veku 4 rokov) mali redukovaný klírens (zvýšený klírens po prepočítaní na hmotnosť) v porovnaní so staršími deťmi (vo veku 12 rokov) a dospelými.
Simulácia dávkovania poukazuje na to, že kým staršie deti (vo veku 10 až 17 rokov) budú mať
plazmatické hladiny podobné dospelým, u mladších detí budú hladiny značne nižšie.
Pediatrickí pacienti so psoriázou s plakmi
Pacientom s pediatrickou psoriázou s plakmi (vo veku 4 až 17 rokov) sa podávali dávky 0,8 mg/kg
(maximálne v dávke do 50 mg na týždeň) etanerceptu jedenkrát týždenne počas doby až do
48 týždňov. Priemerná minimálna rovnovážna koncentrácia v sére bola v rozmedzí od 1,6 až 2,1 µg/ml v týždni 12, 24 a 48. Tieto priemerné koncentrácie u pacientov s pediatrickou psoriázou s plakmi boli podobné ako koncentrácie pozorované u pacientov s juvenilnou idiopatickou artritídou (liečených dávkou 0,4 mg/kg etanerceptu dvakrát týždenne, maximálne v dávke do 50 mg na týždeň). Tieto priemerné koncentrácie boli podobné tým, ktoré boli pozorované u dospelých pacientov so psoriázou
s plakmi liečených dávkou 25 mg etanerceptu dvakrát týždenne.
5.3 Predklinické údaje o bezpečnosti
V toxikologických štúdiách s etanerceptom sa nepreukázala žiadna dávku limitujúca alebo orgánovo špecifická toxicita. Na základe série in vitro a in vivo štúdií nie je etanercept považovaný za genotoxický. Štúdie karcinogenity a štandardné hodnotenia fertility a postnatálnej toxicity etanerceptu neboli uskutočnené kvôli tvorbe neutralizujúcich protilátok u hlodavcov.
Etanercept nespôsobil úmrtnosť alebo nápadné známky toxicity u myší a potkanov po podaní jednotlivej dávky 2 000 mg/kg subkutánne alebo po jednorazovej intravenóznej dávke 1 000 mg/kg. Etanercept nevyvolal dávku limitujúcu alebo orgánovo špecifickú toxicitu u opíc rodu Cynomolgus ani vtedy, ak sa im dvakrát týždenne počas 4 alebo 26 po sebe nasledujúcich týždňoch subkutánne aplikovala dávka (15 mg/kg), ktorá mala za následok 27-násobne vyššiu plazmatickú koncentráciu liečiva na základe AUC než bola dosiahnutá u ľudí pri podávaní odporúčanej dávky 25 mg.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
sacharóza chlorid sodný
monohydrát dihydrogénfosforečnanu sodného heptahydrát hydrogénfosforečnanu disodného
voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
30 mesiacov.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Naplnené injekčné striekačky uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Po vybratí injekčnej striekačky z chladničky počkajte približne 30 minút, aby sa umožnilo roztoku Benepali v injekčnej striekačke dosiahnuť izbovú teplotu. Nezohrievajte ho žiadnym iným spôsobom. Potom sa odporúča jeho okamžité použitie.
Benepali sa môže uchovávať pri teplote maximálne do 25 °C jedenkrát počas obdobia do 4 týždňov; po tomto období sa nemá opätovne uchovávať v chladničke. Benepali sa má zlikvidovať, ak sa nepoužije do štyroch týždňov po vybratí z chladničky.
6.5 Druh obalu a obsah balenia
Naplnená injekčná striekačka z číreho skla (I. typu) s ihlou z nehrdzavejúcej ocele s gumeným krytom ihly a gumeným piestom obsahujúca 0,51 ml roztoku.
Benepali je dostupný v baleniach obsahujúcich 4 naplené injekčné striekačky, viacnásobných
baleniach obsahujúcich 8 (2 balenia po 4) naplených injekčných striekačiek a viacnásobných baleniach obsahujúcich 24 (6 balení po 4) naplených injekčných striekačiek. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Pred podaním injekcie sa má umožniť, aby naplnená jednorazová injekčná striekačka Benepali dosiahla izbovú teplotu (približne 30 minút). Počas tohto obdobia dosahovania izbovej teploty sa kryt ihly nemá odstrániť. Roztok má byť číry až mierne opaleskujúci, bezfarebný alebo bledožltý a môže obsahovať malé priesvitné alebo biele bielkovinové častice.
Podrobné pokyny na podanie sa nachádzajú v písomnej informácii pre používateľa, časť 7, „Pokyny na použitie“.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Samsung Bioepis UK Limited
5th floor
Profile West
950 Great West Road
Brentford
Middlesex TW8 9ES Veľká Británia
8. REGISTRAČNÉ ČÍSLO
EU/1/15/1074/005
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 14 január 2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o
bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUBenepali 50 mg injekčný roztok naplnený v injekčnej striekačke. Benepali 50 mg injekčný roztok naplnený v injekčnom pere.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE50mginjekčnýroztoknaplnenývinjekčnejstriekačkeKaždá naplnená injekčná striekačka obsahuje 50 mg etanerceptu.
50mginjekčnýroztoknaplnenývinjekčnompereKaždé naplnené pero obsahuje 50 mg etanerceptu.
Etanercept je ľudský proteín zložený z receptoru p75 tumor nekrotizujúceho faktoru a Fc fragmentu, vyrábaný technológiou rekombinantnej DNA v cicavčom translačnom systéme ovárií čínskeho škrečka (CHO). Etanercept je dimér chimérického proteínu pripraveného fúziou extracelulárnej
ligandu viažucej časti receptora-2 pre ľudský tumor nekrotizujúci faktor (TNFR2/p75) a Fc fragmentu ľudského IgG1. Tento Fc fragment obsahuje väzbovú CH2 a CH3 oblasť, ale nie CH1 oblasť IgG1. Etanercept sa skladá z 934 aminokyselín a má relatívnu molekulovú hmotnosť približne
150 kilodaltonov. Špecifická aktivita etanerceptu je 1,7 x 106 jednotiek/mg.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMAInjekčný roztok (injekcia).
Roztok je číry až slabo opaleskujúci, bezfarebný alebo bledožltý a je pripravený v hodnote pH
6,2 ± 0,3. Osmolalita roztoku je 325 ± 35 mOsm/kg.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieReumatoidnáartritídaBenepali v kombinácií s metotrexátom je indikovaný dospelým na liečbu stredne závažnej až závažnej aktívnej reumatoidnej artritídy pri nedostatočnej odpovedi na ochorenie-modifikujúce antireumatiká vrátane metotrexátu (ak nie je kontraindikovaný).
Benepali je možné podávať ako monoterapiu v prípade intolerancie na metotrexát alebo ak je kontinuálna liečba metotrexátom nevhodná.
Benepali je indikovaný dospelým, ktorí predtým neboli liečení metotrexátom, aj na liečbu závažnej, aktívnej a progresívnej reumatoidnej artritídy.
Benepali, samotný alebo v kombinácii s metotrexátom, preukázal spomalenie progresie poškodenia kĺbov podľa RTG kritérií a zlepšenie mechanickej funkcie.
J
uvenilná
i
d
i
opatická
artritída
Liečba polyartritídy (s pozitívnym alebo negatívnym reumatoidným faktorom) a rozšírenej oligoartritídy u detí a dospievajúcich od 2 rokov, ktorí mali nedostatočnú odpoveď na metotrexát alebo dokázanú intoleranciu metotrexátu.
Liečba psoriatickej artritídy u dospievajúcich od 12 rokov, ktorí mali nedostatočnú odpoveď na metotrexát alebo dokázanú intoleranciu metotrexátu.
Liečba artritídy spojenej s entezitídou u dospievajúcich od 12 rokov, ktorí mali nedostatočnú odpoveď na konvenčnú liečbu alebo dokázanú intoleranciu konvenčnej liečby.
Etanercept sa nesledoval u detí mladších ako 2 roky. Psoriatickáartritída
Liečba aktívnej a progresívnej psoriatickej artritídy u dospelých, ak je odpoveď na predchádzajúcu ochorenie modifikujúcu antireumatickú liečbu nedostatočná. Etanercept preukázal zlepšenie
mechanickej funkcie u pacientov so psoriatickou artritídou a spomalenie progresie poškodenia
periférnych kĺbov merané pomocou RTG u pacientov s polyartikulárnymi symetrickými formami ochorenia.
Axiálna spondyloartritída
Ankylozujúcaspondylitída
Liečba dospelých so závažnou aktívnou ankylozujúcou spondylitídou, ktorí nemajú dostatočnú odpoveď na konvenčnú liečbu.
Axiálnaspondyloartritídabezrádiografickéhodôkazu
Liečba dospelých so závažnou axiálnou spondyloartritídou bez rádiografického dôkazu s objektívnymi prejavmi zápalu, preukázanými zvýšenou hodnotou C-reaktívneho proteínu (CRP) a/alebo dôkazom podľa magnetickej rezonancie (MRI), ktorí mali neadekvátnu odpoveď na nesteroidné protizápalové lieky (NSAIDs).
Psoriázasplakmi
Liečba dospelých so stredne závažnou až závažnou psoriázou s plakmi u pacientov, ktorí nedostatočne odpovedajú, netolerujú alebo u ktorých je kontraindikovaná iná systémová liečba vrátane cyklosporínu,
metotrexátu alebo psoralénu a UV-A svetlom (PUVA) (pozri časť 5.1).
Pediatrickápsoriázasplakmi
Liečba chronickej závažnej psoriázy s plakmi u detí a dospievajúcich od 6 rokov, ktorí sú nedostatočne kontrolovaní inou systémovou liečbou alebo fototerapiou alebo sú intolerantní na inú systémovú liečbu alebo fototerapiu.
4.2 Dávkovanie a spôsob podávania
Liečbu s Benepali má začať a ďalej sledovať odborný lekár so skúsenosťami v diagnostike a liečbe reumatoidnej artritídy, juvenilnej idiopatickej artritídy, psoriatickej artritídy, ankylozujúcej spondylitídy, axiálnej spondyloartritídy bez rádiografického dôkazu a psoriázy s plakmi alebo pediatrickej psoriázy s plakmi. Pacienti liečení s Benepali majú dostať Bezpečnostnú kartu pacienta.
Benepali je dostupný v silách 25 a 50 mg. Dávkovanie
Reumatoidná artritída
Odporúčaná dávka je 50 mg etanerceptu podávaná jedenkrát týždenne (pozri časť 5.1).
P
s
oriatická artritída, ankylozujúca spondylitída a axiálna spondyloartritída bez rádiografického dôkazu
Odporúčaná dávka je 50 mg etanerceptu podávaná jedenkrát týždenne.
Dostupné údaje naznačujú, že klinická odpoveď sa obvykle dosiahne v priebehu 12 týždňov pri všetkých vyššie uvedených indikáciách. Pokračovanie liečby sa má znovu starostlivo zvážiť
u pacientov, ktorí počas tohto obdobia na liečbu nereagujú.
Psoriáza s plakmi
Odporúčaná dávka etanerceptu je 50 mg podávaných jedenkrát týždenne. Alternatívne sa môže podávať 50 mg dvakrát týždenne až po dobu 12 týždňov a následne, v prípade potreby, 50 mg
jedenkrát týždenne. Liečba s Benepali má pokračovať až do dosiahnutia remisie, čo môže trvať až
24 týždňov. Pre niektorých dospelých pacientov môže byť vhodná ďalšia pokračujúca liečba trvajúca dlhšie ako 24 týždňov (pozri časť 5.1). Liečba sa má ukončiť u tých pacientov, ktorí nevykazujú
žiadnu odpoveď ani po 12 týždňoch. Ak je indikovaná opätovná liečba s Benepali, má sa postupovať
podľa rovnakých odporúčaní pre trvanie liečby. Dávka má byť 50 mg jedenkrát týždenne.
Osobitné skupiny pacientov
Porucha funkcie obličiek a pečene
Nie je potrebná úprava dávky.
Starší ľudia
Nie je potrebná úprava dávky. Spôsob podávania a dávkovanie je rovnaké ako u dospelých vo veku
18-64 rokov.
Pediatrická populácia
Benepali je dostupný iba ako 25 mg naplnená injekčná striekačka, 50 mg naplnená injekčná striekačka a 50 mg naplnené pero.
Preto nie je možné podávať Benepali pediatrickým pacientom, ktorí vyžadujú menej než plnú dávku
25 mg alebo 50 mg. Benepali sa nemá podávať pediatrickým pacientom, ktorí vyžadujú inú dávku než je plných 25 mg alebo 50 mg. Keď sa vyžaduje iná dávka, majú sa použiť iné lieky s etanerceptom ponúkajúce túto možnosť.
U pediatrických pacientov je dávkovanie etanerceptu založené na telesnej hmotnosti. Pacienti
s hmotnosťou nižšou ako 62,5 kg majú dostať presne vypočítanú dávku v mg/kg použijúc balenia
s práškom a rozpúšťadlom na injekčný roztok alebo balenia s práškom na injekčný roztok (pozri tiež nižšie dávkovanie pre osobitné skupiny pacientov). Pacienti s hmotnosťou 62,5 kg alebo vyššou môžu
dostať fixnú dávku formou naplnenej injekčnej striekačky alebo naplneného pera.
Juvenilnáidiopatickáartritída
Odporúčaná dávka je 0,4 mg/kg (maximálne do 25 mg v dávke) podávaná dvakrát týždenne vo forme subkutánnej injekcie s intervalom 3-4 dni medzi jednotlivými dávkami alebo 0,8 mg/kg (maximálne do 50 mg v dávke) podávaná jedenkrát týždenne. Prerušenie liečby sa má zvážiť u pacientov,
u ktorých nedôjde k žiadnej odpovedi po 4 mesiacoch liečby.
10 mg injekčná liekovka môže byť vhodnejšia na podávanie deťom s JIA s telesnou hmotnosťou do
25 kg.
Nevykonali sa žiadne klinické skúšania formálne zamerané na deti vo veku 2 až 3 roky. Ale limitované údaje o bezpečnosti z pacientského registra naznačujú, že v dávke 0,8 mg/kg jedenkrát týždenne podanej subkutánne je bezpečnostný profil u detí vo veku 2 až 3 roky podobný ako sa pozoroval u dospelých a detí vo veku 4 a viac rokov (pozri časť 5.1).
Vo všeobecnosti sa použitie etanerceptu netýka detí do 2 rokov v indikácii juvenilnej idiopatickej artritídy.
P
ediatrická
psoriáza
s
plakmi
(vek
6
a
viac
rokov)
Odporúčaná dávka je 0,8 mg/kg (maximálne do 50 mg v dávke) jedenkrát týždenne a môže trvať až
24 týždňov. Liečba sa má prerušiť u pacientov, u ktorých sa po 12 týždňoch nedostavila odpoveď.
Ak je indikovaná opätovná liečba s Benepali, má sa postupovať podľa vyššie uvedených odporúčaní pre dĺžku trvania liečby. Dávka má byť 0,8 mg/kg (maximálne do 50 mg v dávke) jedenkrát týždenne.
Vo všeobecnosti sa použitie etanerceptu netýka detí do 6 rokov v indikácii psoriázy s plakmi. Spôsobpodávania
Benepali je určený na subkutánne použitie (pozri časť 6.6).
Podrobné pokyny na podanie sa nachádzajú v písomnej informácii pre používateľa, časť 7, „Pokyny na použitie“.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Sepsa alebo riziko sepsy.
Liečba s Benepali sa nemá začať u pacientov s aktívnou infekciou vrátane chronickej alebo lokalizovanej infekcie.
4.4 Osobitné upozornenia a opatrenia pri používaní
V záujme zlepšenia sledovateľnosti biologických liekov sa má v zdravotnej dokumentácii pacienta zrozumiteľne zaznamenať (alebo uviesť) názov a číslo šarže podaného lieku.
Infekcie
Pacienti sa majú vyšetriť na prítomnosť infekcie pred začatím, počas a po ukončení liečby s Benepali, pričom treba brať do úvahy, že stredný eliminačný polčas etanerceptu je približne 70 hodín (rozsah
7 až 300 hodín).
V súvislosti s používaním etanerceptu boli hlásené závažné infekcie, sepsa, tuberkulóza a oportúnne infekcie, vrátane invazívnych mykotických infekcií, listerióza a legionelóza (pozri časť 4.8). Tieto infekcie boli spôsobené baktériami, mykobaktériami, hubami, vírusmi a parazitmi (vrátane protozoí). V niektorých prípadoch neboli tieto infekcie rozpoznané, obzvlášť pri mykotických a iných oportúnnych infekciách, následkom čoho došlo k oneskoreniu vhodnej liečby a niekedy k úmrtiu. Pri hodnotení výskytu infekcie u pacientov sa má vziať do úvahy riziko závažných oportúnnych infekcií u pacienta (napr. expozícia endemickým mykózam).
Pacienti, u ktorých sa počas liečby s Benepali objaví nová infekcia, sa majú prísne monitorovať. Podávanie Benepali sa má prerušiť, ak sa u pacienta rozvinie závažná infekcia. Bezpečnosť a účinnosť etanerceptu sa nehodnotila u pacientov s chronickými infekciami. Lekári majú byť opatrní pri zvažovaní liečby s Benepali u pacientov s anamnézou rekurentných alebo chronických infekcií alebo
u pacientov so základným ochorením predisponujúcim ku vzniku infekcie, ako napr. pokročilý alebo zle kontrolovaný diabetes.
Tuberkulóza
U pacientov liečených etanerceptom boli hlásené prípady aktívnej tuberkulózy vrátane miliárnej tuberkulózy a tuberkulózy s extrapulmonárnou lokalizáciou.
Pred začatím liečby s Benepali sa musia všetci pacienti vyšetriť na aktívnu a inaktívnu (latentnú)
tuberkulózu. Toto vyšetrenie má zahŕňať podrobnú anamnézu s osobnou anamnézou tuberkulózy
alebo možným predošlým kontaktom s tuberkulózou a s predošlou a/alebo súčasnou imunosupresívnou liečbou. U všetkých pacientov sa majú vykonať vhodné skríningové testy, napr. tuberkulínový kožný test a RTG hrudníka (môže sa postupovať podľa národných odporúčaní). Odporúča sa zaznamenať vykonanie týchto testov do Bezpečnostnej karty pacienta. Predpisujúci lekári majú myslieť na riziko falošne negatívnych tuberkulínových kožných testov zvlášť u pacientov, ktorí sú závažne chorí alebo imunokompromitovaní.
Liečba s Benepali sa nesmie začať, ak je diagnostikovaná aktívna tuberkulóza. Ak je diagnostikovaná inaktívna (latentná) tuberkulóza, liečba latentnej tuberkulózy pomocou antituberkulóznej liečby sa musí začať pred začatím liečby s Benepali a v súlade s národnými odporúčaniami. V tejto situácii je potrebné veľmi starostlivo zvážiť pomer prospechu/rizika liečby s Benepali.
Všetci pacienti majú byť poučení o nutnosti vyhľadať lekársku pomoc, ak sa počas liečby s Benepali objavia prejavy/symptómy naznačujúce tuberkulózu (napr. pretrvávajúci kašeľ, chradnutie/strata hmotnosti, mierne zvýšená teplota).
ReaktiváciahepatitídyB
U pacientov, ktorí boli predtým infikovaní vírusom hepatitídy B (HBV) a súčasne dostávali TNF-antagonistov vrátane etanerceptu, bola hlásená reaktivácia hepatitídy B. Hlásenia zahŕňali reaktiváciu hepatitídy B u pacientov, ktorí boli anti-HBc pozitívni, ale anti-HbsAg negatívni. Pred začatím liečby s Benepali majú byť pacienti testovaní na infekciu HBV. Pacientom s pozitívnym testom na infekciu HBV sa odporúča konzultácia s lekárom s odbornosťou na liečbu hepatitídy B. Pri podávaní Benepali pacientom predtým infikovaným HBV je potrebná opatrnosť. Títo pacienti sa majú monitorovať na prejavy a symptómy aktívnej HBV infekcie počas liečby a niekoľko týždňov po ukončení liečby. Nie sú dostupné dostatočné informácie o liečbe pacientov infikovaných HBV, ktorí dostávajú antivírusovú liečbu v kombinácii s TNF-antagonistom. U pacientov, u ktorých sa vyvinie infekcia HBV, sa má podávanie Benepali prerušiť a má sa začať s účinnou antivírusovou terapiou
s príslušnou podpornou liečbou.
ZhoršeniehepatitídyC
U pacientov užívajúcich etanercept boli hlásené prípady zhoršenia hepatitídy C. Benepali sa má u pacientov s prekonanou hepatitídou C používať s opatrnosťou.
Súčasnáliečbasanakinrou
Súčasné podávanie etanerceptu s anakinrou bolo spojené so zvýšeným rizikom závažných infekcií
a neutropénie v porovnaní s podávaním samotného etanerceptu. Táto kombinácia nepreukázala lepší klinický prospech. Preto sa kombinované použitie Benepali s anakinrou neodporúča (pozri časť 4.5
a 4.8).
Súčasnáliečbasabataceptom
V klinických štúdiách súčasné podávanie abataceptu a etanerceptu viedlo k zvýšenému výskytu závažných nežiaducich udalostí. Táto kombinácia nepreukázala lepší klinický prospech; takéto použitie sa neodporúča (pozri časť 4.5).
Alergickéreakcie
Alergické reakcie súvisiace s podávaním etanerceptu boli hlásené často. Alergické reakcie zahŕňali angioedém a urtikáriu, vyskytli sa závažné reakcie. Ak sa objaví akákoľvek závažná alergická alebo anafylaktická reakcia, liečba s Benepali sa má okamžite ukončiť a má sa začať primeraná liečba.
Imunosupresia
Pri TNF-antagonistoch vrátane etanerceptu existuje možnosť ovplyvnenia obranných mechanizmov hostiteľa voči infekciám a malignitám, keďže TNF je mediátorom zápalu a moduluje bunkovú imunitnú odpoveď. V štúdii so 49 dospelými pacientmi s reumatoidnou artritídou liečenou etanerceptom sa nepreukázalo potlačenie oneskoreného typu precitlivenosti, pokles hladín imunoglobulínov alebo zmena v počte populácií efektorových buniek.
U dvoch pacientov s juvenilnou idiopatickou artritídou sa rozvinula varicella a prejavy a symptómy aseptickej meningitídy, ktoré odzneli bez následkov. Pacienti so signifikantnou expozíciou vírusu varicella majú dočasne prerušiť liečbu s Benepali a má sa u nich zvážiť profylaktická liečba imunoglobulínom Varicella-Zoster.
Bezpečnosť a účinnosť etanerceptu sa nehodnotila u pacientov s imunosupresiou. Malignityalymfoproliferatívneochorenia
Solídne a hematopoetické malignity (okrem nádorov kože)
V období po uvedení lieku na trh boli hlásené rôzne typy malígnych ochorení (vrátane karcinómu prsníka a karcinómu pľúc a lymfómu) (pozri časť 4.8).
V kontrolovaných častiach klinických štúdií zameraných na TNF-antagonisty sa pozorovalo viac prípadov lymfómu u pacientov užívajúcich TNF-antagonistu v porovnaní s kontrolnými pacientmi. Avšak výskyt lymfómu bol zriedkavý a obdobie sledovania po liečbe u pacientov užívajúcich placebo bolo kratšie ako u pacientov liečených TNF-antagonistom. V sledovaní po uvedení lieku na trh boli hlásené prípady leukémie u pacientov liečených TNF-antagonistami. Prítomnosť reumatoidnej artritídy zvyšuje u pacientov bazálne riziko pre vznik lymfómu a leukémie v súvislosti
s dlhotrvajúcim, vysoko aktívnym zápalovým ochorením, čo komplikuje odhad rizika.
Na základe súčasných vedomostí nemôžeme u pacientov liečených TNF-antagonistami vylúčiť možné riziko rozvoja lymfómu, leukémie alebo iných hematopoetických a solídnych malignít. Opatrnosť sa vyžaduje najmä pri zvažovaní liečby TNF-antagonistami u pacientov s anamnézou malignity alebo ak sa zvažuje pokračovanie liečby u pacientov, u ktorých sa malignita rozvinula.
V období po uvedení lieku na trh u detí, dospievajúcich a mladých dospelých (do 22 rokov) liečených TNF-antagonistami vrátane etanerceptu (začiatok liečby ≤ 18 rokov) boli hlásené malignity, niektoré fatálne. Približne polovica prípadov boli lymfómy. Ďalšie prípady zastúpené rôznymi rozdielnymi malignitami zahŕňali malignity typicky súvisiace s imunosupresiou. Riziko vývoja malignít u detí
a dospievajúcich liečených TNF-antagonistami nie je možné vylúčiť.
Kožné nádory
U pacientov liečených TNF-antagonistami vrátane etanerceptu boli hlásené prípady melanómu
a nemelanómovej rakoviny kože (Non-Melanoma Skin Cancer, NMSC). Po uvedení lieku na trh sa u pacientov liečených etanerceptom veľmi zriedkavo pozorovali prípady karcinómu z Merkelových
buniek. Pravidelné vyšetrenie kože sa odporúča u všetkých pacientov s rizikovými faktormi pre vznik
kožných nádorov.
Po zlúčení výsledkov z kontrolovaných klinických štúdií sa viac prípadov NMSC pozorovalo
u pacientov užívajúcich etanercept v porovnaní s kontrolnými pacientmi, najmä u pacientov so psoriázou.
Očkovanie
Živé očkovacie látky sa nemajú podávať súčasne s Benepali. Nie sú k dispozícii údaje o sekundárnom prenose infekcie živými vakcínami u pacientov liečených etanerceptom. V dvojito zaslepenej, placebom kontrolovanej, randomizovanej štúdií s dospelými pacientmi so psoriatickou artritídou dostávalo 184 pacientov tiež multivalentnú pneumokokovú polysacharidovú vakcínu v 4. týždni.
V tejto štúdií väčšina pacientov so psoriatickou artritídou dostávajúcich etanercept bola schopná zvýšenej, efektívnej B-bunkovej imunitnej odpovede na pneumokokovú polysacharidovú vakcínu, ale
titre v agregáte boli o niečo nižšie a u niekoľkých pacientov sa titre zvýšili dvakrát v porovnaní s pacientmi, ktorí nedostávali etanercept. Klinický význam nie je známy.
Tvorbaautoprotilátok
Liečenie s Benepali môže mať za následok tvorbu autoimunitných protilátok (pozri časť 4.8).
H
ematologické
r
eakcie
U pacientov liečených etanerceptom boli hlásené zriedkavé prípady pancytopénie a veľmi zriedkavé prípady aplastickej anémie, niektoré s fatálnym koncom. U pacientov liečených s Benepali
s anamnézou krvných dyskrázií je potrebná opatrnosť. Všetkých pacientov a rodičov/opatrovateľov treba poučiť, že ak sa počas liečby s Benepali u pacienta objavia znaky a symptómy naznačujúce
krvné dyskrázie alebo infekcie (napr. pretrvávajúca horúčka, bolesť hrdla, krvné podliatiny, krvácanie a bledosť) majú sa ihneď poradiť s lekárom. Títo pacienti sa majú ihneď vyšetriť vrátane kompletného krvného obrazu a ak sa potvrdí krvná dyskrázia, Benepali sa má vysadiť.
Neurologicképoruchy
U pacientov liečených etanerceptom boli zriedkavo hlásené demyelinizačné ochorenia (pozri časť 4.8.). Okrem toho sa veľmi zriedkavo vyskytli prípady periférnych demyelinizačných polyneuropatií (vrátane Guillainov-Barrého syndrómu, chronickej zápalovej demyelinizačnej polyneuropatie, demyelinizačnej polyneuropatie a multifokálnej motorickej neuropatie). Hoci sa nevykonali žiadne klinické štúdie hodnotiace terapiu etanerceptom u pacientov so sclerosis multiplex, klinické štúdie s inými TNF antagonistami u pacientov so sclerosis multiplex ukázali zvýšenie aktivity ochorenia. Odporúča sa starostlivé zváženie pomeru rizika a prospechu vrátane neurologického zhodnotenia pri predpisovaní Benepali pacientom s existujúcim alebo začínajúcim demyelinizačným ochorením alebo u pacientov so zvýšeným rizikom vzniku demyelinizačného ochorenia.
Kombinovanáterapia
V kontrolovanej klinickej štúdii s 2 ročným trvaním v populácii pacientov s reumatoidnou artritídou, kombinácia etanerceptu a metotrexátu nespôsobila žiadne neočakávané zistenia v rámci bezpečnosti
a bezpečnostný profil etanerceptu podávaného v kombinácii s metotrexátom bol podobný ako profily etanerceptu a metotrexátu sledované v samostatných štúdiách. V súčasnosti prebiehajú dlhodobé
štúdie na stanovenie bezpečnosti tejto kombinácie. Bezpečnosť etanerceptu v kombinácii s inými ochorenie modifikujúcimi antireumatikami (Disease-Modifying Antirheumatic Drugs, DMARD)
z dlhodobého hľadiska nebola stanovená.
Používanie etanerceptu v kombinácii s inou systémovou liečbou alebo fototerapiou v liečbe psoriázy sa zatiaľ neskúmalo.
Poruchafunkcieobličiekapečene
Na základe farmakokinetických údajov (pozri časť 5.2) nie je potrebná úprava dávky u pacientov
s poruchou funkcie obličiek alebo pečene; klinické skúsenosti u takýchto pacientov sú obmedzené.
Kongestívnezlyhaniesrdca
U pacientov s kongestívnym zlyhaním srdca (KZS) musia lekári pri používaní Benepali postupovať opatrne. Po uvedení lieku na trh existujú údaje o zhoršovaní KZS u pacientov užívajúcich etanercept, a to s identifikovateľnými vyvolávajúcimi faktormi i bez nich. Boli hlásené aj zriedkavé (< 0,1 %) nové prípady KZS, vrátane KZS u pacientov bez známeho predtým existujúceho kardiovaskulárneho
ochorenia. Niektorí z týchto pacientov mali menej ako 50 rokov. Dve veľké klinické štúdie hodnotiace používanie etanerceptu v liečbe KZS boli pre neúčinnosť predčasne ukončené. Údaje z jednej z týchto
štúdií, hoci nepresvedčivé, naznačujú u pacientov liečených etanerceptom možnú tendenciu
k zhoršovaniu KZS.
Alkoholováhepatitída
Vo fáze II randomizovanej, placebom kontrolovanej štúdii u 48 hospitalizovaných pacientov liečených etanerceptom alebo placebom na stredne závažnú až závažnú alkoholovú hepatitídu etanercept nebol účinný a miera úmrtnosti u pacientov liečených etanerceptom bola po 6 mesiacoch signifikantne
vyššia. Preto sa Benepali nemá používať na liečbu alkoholovej hepatitídy. Lekári majú byť opatrní pri používaní Benepali u pacientov, ktorí majú stredne závažnú až závažnú alkoholovú hepatitídu.
Wegenerovagranulomatóza
V placebom kontrolovanej štúdii, v ktorej bolo 89 dospelých pacientov liečených pridaním etanerceptu ku štandardnej terapii (vrátane cyklofosfamidu alebo metotrexátu a glukokortikoidov) s mediánom trvania 25 mesiacov sa etanercept ukázal ako neúčinný v liečbe Wegenerovej
granulomatózy. Incidencia nekožných malignít rôznych typov bola signifikantne vyššia u pacientov liečených etanerceptom ako v kontrolnej skupine. Benepali sa neodporúča na liečbu Wegenerovej granulomatózy.
Hypoglykémiaupacientovliečenýchnadiabetes
Po začatí liečby etanerceptom u pacientov užívajúcich lieky na diabetes boli hlásené prípady hypoglykémie vyžadujúce redukciu antidiabetických liekov u niektorých týchto pacientov.
Osobitné skupiny pacientov
Starší ľudia
V štúdiách reumatoidnej artritídy, psoriatickej artritídy a ankylozujúcej spondylitídy vo fáze 3 sa u pacientov vo veku 65 rokov a starších užívajúcich etanercept nepozorovali celkové rozdiely
v nežiaducich účinkoch, závažných nežiaducich účinkoch a závažných infekciách v porovnaní s mladšími pacientmi. Avšak pri liečbe starších pacientov sa má postupovať opatrne a zvláštna
pozornosť sa má venovať výskytu infekcií.
Pediatrická populácia
Očkovanie
Ak je to možné, odporúča sa, aby boli deti a dospievajúci ešte pred začatím liečby etanerceptom imunizovaní v súlade s aktuálnymi smernicami o imunizácii (pozri Očkovanie vyššie).
Zápalovéčrevnéochorenie(InflammatoryBowelDisease,IBD)auveitídaupacientovsjuvenilnouidiopatickouartritídou(JIA)
U pacientov s JIA liečených etanerceptom boli hlásené prípady IBD a uveitídy (pozri časť 4.8).
Benepaliobsahujesodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v dávke, t.j. v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Súčasnáliečbasanakinrou
U dospelých pacientov liečených etanerceptom a anakinrou sa pozoroval vyšší výskyt závažných infekcií pri porovnaní s pacientmi liečenými samotným etanerceptom alebo anakinrou (historické
údaje).
Navyše sa v dvojito zaslepenej, placebom kontrolovanej štúdii u dospelých pacientov s bazálnou liečbou metotrexátom pozoroval vyšší výskyt závažných infekcií (7 %) a neutropénie u pacientov liečených etanerceptom a anakinrou než u pacientov liečených etanerceptom (pozri časti 4.4 a 4.8). Kombinácia etanerceptu a anakinry nepreukázala lepší klinický prospech, a preto sa neodporúča.
Súčasnáliečbasabataceptom
V klinických štúdiách súčasné podávanie abataceptu a etanerceptu viedlo k zvýšenému výskytu závažných nežiaducich udalostí. Táto kombinácia nepreukázala lepší klinický prospech; takéto
použitie sa neodporúča (pozri časť 4.4).
Súčasnáliečbasosulfasalazínom
V klinickej štúdii s dospelými pacientmi, ktorí dostávali určené dávky sulfasalazínu, ku ktorému sa pridal etanercept bol u pacientov v kombinovanej skupine pozorovaný štatisticky významný pokles
v priemernom počte bielych krviniek v porovnaní so skupinami liečenými samotným etanerceptom alebo samotným sulfasalazínom. Klinický význam tejto interakcie nie je známy. Lekári majú byť
opatrní pri zvažovaní kombinovanej terapie so sulfasalazínom.
B
ez
i
nterakcií
V klinických štúdiách neboli pozorované žiadne interakcie pri podávaní etanerceptu
s glukokortikoidmi, salicylátmi (okrem sulfasalazínu), nesteroidovými protizápalovými liekmi
(NSAIDs), analgetikami alebo metotrexátom. Pozri časť 4.4 týkajúcu sa informácií o očkovaní.
Nepozorovali sa klinicky signifikantné farmakokinetické liekové interakcie v štúdiách s metotrexátom, digoxínom ani s warfarínom.
4.6 Fertilita, gravidita a laktácia
Ženyvreprodukčnomveku
Ženám v reprodukčnom veku sa má odporučiť používať vhodnú antikoncepciu, aby sa zabránilo otehotneniu počas liečby s Benepali a počas 3 týždňov po ukončení liečby.
Gravidita
Štúdie vývojovej toxicity uskutočnené na potkanoch a králikoch nepreukázali žiadne poškodenie plodu alebo novonarodených potkanov v dôsledku etanerceptu. Vyššia miera výskytu závažných vrodených chýb sa pozorovala v observačnej štúdii porovnávajúcej gravidity s expozíciou etanerceptu počas prvého trimestra, s graviditami bez expozície etanerceptu alebo iným TNF-antagonistom (upravený pomer šancí 2,4, 95 % CI: 1,0 – 5,5). Typy najčastejšie hlásených závažných vrodených chýb boli totožné s typmi, ktoré sa najčastejšie hlásili vo všeobecnej populácii, a nebol identifikovaný žiadny osobitný typ abnormalít. V štúdii sa nezistila žiadna zmena v miere výskytu spontánneho potratu, narodenia mŕtveho plodu, alebo menej závažných malformácií. Použitie Benepali sa počas gravidity neodporúča.
Etanercept prechádza cez placentu a zistil sa v sére dojčiat, ktoré sa narodili pacientkam liečeným etanerceptom počas tehotenstva. Klinický vplyv tohto zistenia nie je známy, dojčatá však môžu byť vystavené vyššiemu riziku vzniku infekcie. Podávanie živých vakcín dojčatám 16 týždňov potom, ako matka dostala poslednú dávku Benepali, sa vo všeobecnosti neodporúča.
Dojčenie
Zistilo sa, že etanercept sa vylučuje do materského mlieka po podkožnom podaní. U dojčiacich potkanov po podkožnom podaní sa etanercept vylučoval do materského mlieka a zistil sa v plazme mláďat. Pretože sa imunoglobulíny, tak ako mnohé lieky, môžu vylučovať do materského mlieka, rozhodnutie, či ukončiť dojčenie alebo ukončiť liečbu s Benepali sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Predklinické údaje o peri- a postnatálnej toxicite etanerceptu a účinkoch etanerceptu na plodnosť a celkovú reprodukčnú schopnosť nie sú dostupné.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnúdajovobezpečnosti
Najčastejšie hlásenými nežiaducimi reakciami sú reakcie v mieste podania (ako bolesť, opuch, svrbenie, začervenanie a krvácanie v mieste vpichu), infekcie (ako infekcie horných dýchacích ciest,
bronchitída, infekcie močového mechúra a kožné infekcie), alergické reakcie, tvorba autoprotilátok, svrbenie a horúčka.
U etanerceptu boli tiež hlásené závažné nežiaduce reakcie. TNF-antagonisty, tak ako etanercept, ovplyvňujú imunitný systém a ich použitie môže ovplyvniť obranyschopnosť tela voči infekcii
a nádoru. Závažné infekcie vyvolávajúce horúčku postihnú menej ako 1 zo 100 pacientov liečených etanerceptom. Hlásenia zahŕňali fatálne a život ohrozujúce infekcie a sepsu. Pri použití etanerceptu
boli hlásené aj rôzne malignity vrátane zhubných nádorov prsníka, pľúc, kože a lymfatických žliaz
(lymfóm).
Boli hlásené aj závažné hematologické, neurologické a autoimunitné reakcie. Tie zahŕňajú zriedkavé hlásenia pancytopénie a veľmi zriedkavé hlásenia aplastickej anémie. Centrálne a periférne demyelinizačné ochorenia boli hlásené zriedkavo alebo veľmi zriedkavo, obzvlášť pri použití etanerceptu. Hlásený bol aj lupus, stavy podobné lupusu a vaskulitída.
Tabuľkovýzoznamnežiaducichreakcií
Nasledujúci zoznam nežiaducich účinkov je založený na skúsenostiach z klinických štúdií u dospelých a na skúsenostiach po uvedení lieku na trh.
V rámci tried orgánových systémov sú nežiaduce reakcie uvedené v zozname podľa ich frekvencie (počet pacientov, u ktorých sa nežiaduca reakcia očakáva), pri použití nasledujúcich kategórií: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až
< 1/1 000); veľmi zriedkavé (< 1/10 000); neznáme (z dostupných údajov).
Infekcie a nákazy:
Veľmi časté: Infekcie (vrátane infekcií horných dýchacích ciest, bronchitídy, cystitídy, kožných infekcií)*
Menej časté: Závažné infekcie (vrátane pneumónie, celulitídy, septickej artritídy, sepsy a parazitárnej infekcie)*
Zriedkavé: Tuberkulóza, oportúnne infekcie (vrátane invazívnych mykotických, protozoálnych, bakteriálnych, atypických mykobakteriálnych, vírusových infekcií, a Legionelly)*
Neznáme: Listeria, reaktivácia hepatitídy B
Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy): Menej časté: Nemelanómový karcinóm kože* (pozri časť 4.4) Zriedkavé: Lymfóm, melanóm (pozri časť 4.4)
Neznáme: Leukémia, karcinóm z Merkelových buniek (pozri časť 4.4)
Poruchy krvi a lymfatického systému:
Menej časté: Trombocytopénia
Zriedkavé: Anémia, leukopénia, neutropénia, pancytopénia*
Veľmi zriedkavé:
Poruchy imunitného systému:
Aplastická anémia*
Časté: Alergické reakcie (pozri „Poruchy kože a podkožného tkaniva“), tvorba autoprotilátok*
Menej časté: Systémová vaskulitída (vrátane vaskulitídy s cytoplazmatickými protilátkami proti neutrofilom)
Zriedkavé: Závažné alergické/anafylaktické reakcie (vrátane angioedému,
bronchospazmu), sarkoidóza
Neznáme: Syndróm aktivácie makrofágov*, zhoršenie príznakov dermatomyozitídy
Poruchy nervového systému:
Zriedkavé: Záchvaty
Prípady demyelinizácie CNS pripomínajúce sklerózu multiplex alebo lokalizované demyelinizačné ochorenia, ako je zápal
zrakového nervu a tranzverzálna myelitída (pozri časť 4.4).
P
oruchy oka:
Veľmi zriedkavé:
Periférne demyelinizačné prípady vrátane Guillainov-Barrého syndrómu, chronickej zápalovej demyelinizačnej polyneuropatie, demyelinizačnej polyneuropatie a multifokálnej motorickej neuropatie (pozri časť 4.4)

Menej časté: Zápal dúhovky (uveitída), skleritída
Poruchy srdca a srdcovej činnosti:
Zriedkavé: Kongestívne zlyhanie srdca (pozri časť 4.4.).
Poruchy dýchacej sústavy, hrudníka a mediastína:
Menej časté: Intersticiálna choroba pľúc (vrátane pneumonitídy a pulmonálnej fibrózy)*
Poruchy pečene a žlčových ciest:
Menej časté: Zvýšené pečeňové enzýmy*
Zriedkavé: Autoimunitná hepatitída
Poruchy kože a podkožného tkaniva:
Časté: Pruritus
Menej časté: Angioedém, urtikária, vyrážka, vyrážka podobná psoriáze, psoriáza (vrátane nového alebo zhoršenia výsypu a pustulárnej formy hlavne na dlaniach a chodidlách)
Zriedkavé: Kožná vaskulitída (vrátane leukocytoklastickej vaskulitídy), Stevensov-Johnsonov syndróm, erythema multiforme
Veľmi zriedkavé:
Toxická epidermálna nekrolýza
 P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva:
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva:
Zriedkavé: Subakútny kožný lupus erythematosus, diskoidný lupus erythematosus, syndróm podobný lupusu
Celkové poruchy a reakcie v mieste podania:Veľmi časté: Reakcie v mieste podania (vrátane krvácania, hematómu, erytému, svrbenia, bolesti, opuchu)*
Časté: Horúčka
*pozri Opis vybraných nežiaducich reakcií uvedených nižšie.
Opis vybraných nežiaducichreakciíMalignity a lymfoproliferatívne ochoreniaPri sledovaní 4 114 pacientov s reumatoidnou artritídou, ktorí boli v klinických štúdiách liečení etanerceptom bolo po dobu približne 6 rokov pozorovaných 129 nových malignít rôzneho typu. A to
vrátane 231 pacientov, ktorí boli liečení etanerceptom v kombinácii s metotrexátom v dvojročnej, aktívne kontrolovanej klinickej štúdii. Ich výskyt a rozsah boli v týchto klinických štúdiách podobné,
aké je možné očakávať v sledovanej populácii. Celkovo boli hlásené 2 malignity v klinických štúdiách trvajúcich približne 2 roky, ktoré zahrnuli 240 pacientov so psoriatickou artritídou, liečených etanerceptom. V klinickej štúdii v populácii 351 pacientov s ankylozujúcou spondylitídou trvajúcej
viac ako 2 roky bolo hlásených 6 malignít u pacientov liečených etanerceptom. V skupine
2 711 pacientov so psoriázou liečených etanerceptom v dvojito zaslepených a otvorených štúdiách trvajúcich až do 2,5 roka bolo hlásených 30 malignít a 43 prípadov nemelanómovej rakoviny kože.
V klinických štúdiách v skupine 7 416 pacientov s reumatoidnou artritídou, psoriatickou artritídou, ankylozujúcou spondylitídou a psoriázou liečených etanerceptom bolo celkovo hlásených
18 lymfómov.
Rôzne malígne ochorenia boli hlásené aj v období po uvedení lieku na trh (vrátane karcinómu prsníka a pľúc a lymfómu) (pozri časť 4.4).
Reakcie v mieste podania injekcieV porovnaní s placebom bola u pacientov s reumatickými ochoreniami liečených etanerceptom signifikantne vyššia incidencia lokálnych reakcií v mieste podania (36 % vs. 9 %). Reakcie v mieste podania sa zvyčajne objavili v prvom mesiaci. Priemerné trvanie bolo približne 3 až 5 dní. Vo väčšine prípadov reakcií v mieste podania v skupine liečenej etanerceptom sa nepodávala žiadna liečba
a väčšina pacientov, ktorí boli liečení dostala lokálne prípravky ako kortikosteroidy alebo perorálne antihistaminiká. Okrem toho, u niektorých pacientov sa objavili opätovné reakcie v mieste podania,
ktoré sú charakterizované kožnou reakciou na najčerstvejšom mieste podania spolu so súčasným
objavením sa reakcie v mieste predchádzajúceho podania. Vo všeobecnosti boli tieto reakcie prechodné a neopakovali sa počas liečby.
V kontrolovaných klinických štúdiách u pacientov so psoriázou s plakmi sa asi u 13,6 % pacientov liečených etanerceptom objavila reakcia v mieste podania v porovnaní s 3,4 % placebom liečených pacientov počas prvých 12 týždňov liečby.
Závažné infekcie
V placebom kontrolovaných klinických štúdiách sa nepozoroval nárast incidencie závažných infekcií
(smrteľných, život ohrozujúcich alebo vyžadujúcich hospitalizáciu alebo intravenózne antibiotiká). Závažné infekcie sa vyskytli u 6,3 % pacientov s reumatoidnou artritídou liečených etanerceptom až
48 mesiacov. K týmto závažným infekciám patrili: absces (na rôznych miestach), bakteriémia,
bronchitída, burzitída, celulitída, cholecystitída, hnačky, divertikulitída, endokarditída (podozrenie), gastroenteritída, hepatitída B, herpes zoster, vred na dolnej končatine, infekcia ústnej dutiny, osteomyelitída, otitída, peritonitída, pneumónia, pyelonefritída, sepsa, septická artritída, sinusitída, kožná infekcia, kožná ulcerácia, infekcia močového traktu, vaskulitída a infekcia v rane. V 2 roky trvajúcej, aktívne kontrolovanej štúdii, v ktorej boli pacienti liečení buď samostatne etanerceptom, samostatne metotrexátom alebo etanerceptom v kombinácii s metotrexátom bol výskyt závažných infekcií podobný vo všetkých liečených skupinách. Avšak, nemožno vylúčiť, že sa s kombináciou etanerceptu a metotrexátu nemôže spájať zvýšený výskyt infekcií.
Nepozorovali sa rozdiely vo výskyte infekcií medzi pacientmi liečenými etanerceptom a placebom pri psoriáze s plakmi v placebom kontrolovaných štúdiách v trvaní do 24 týždňov. Závažné infekcie, ktoré sa objavili u pacientov liečených etanerceptom zahŕňali celulitídu, gastroenteritídu, pneumóniu, cholecystitídu, osteomyelitídu, gastritídu, apendicitídu, streptokokovú fasciitídu, myozitídu, septický šok, divertikulitídu a absces. V dvojito zaslepených a otvorených štúdiách so psoriatickou artritídou bola závažná infekcia (pneumónia) hlásená u 1 pacienta.
Závažné a smrteľné infekcie boli hlásené pri používaní etanerceptu; k hláseným patogénom patrili baktérie, mykobaktérie (vrátane tuberkulózy), vírusy a huby. Niektoré sa objavili v priebehu pár týždňov po začatí liečby etanerceptom u pacientov so základným ochorením (napr. diabetes, kongestívne zlyhanie srdca, anamnéza aktívnej alebo chronickej infekcie) okrem reumatoidnej
artritídy (pozri časť 4.4). Liečba s Benepali môže zvyšovať mortalitu u pacientov s rozvinutou sepsou.
V súvislosti s etanerceptom boli hlásené oportúnne infekcie vrátane invazívnych mykotických, parazitických (vrátane protozoálnych), vírusových (vrátane herpes zoster), bakteriálnych (vrátane Listeria a Legionella) a atypických mykobakteriálnych infekcií. V súbore údajov z klinických štúdií bola celková incidencia oportúnnych infekcií 0,09 % na 15 402 pacientov, ktorí dostávali etanercept. Miera prispôsobená expozícii bola 0,06 prípadov na 100 pacientorokov. V sledovaní po uvedení lieku na trh bola približne polovica zo všetkých prípadov oportúnnych infekcií invazívne mykotické infekcie. Najčastejšie hlásené invazívne mykotické infekcie zahŕňali rody Candida, Pneumocystis, Aspergillus a Histoplasma. Invazívne mykotické infekcie predstavovali viac ako polovicu fatálnych prípadov medzi pacientmi, u ktorých sa vyvinuli oportúnne infekcie. Väčšina hlásení s fatálnym následkom bola u pacientov s pneumóniou Pneumocystis, nešpecifickými systémovými mykotickými infekciami a aspergilózou (pozri časť 4.4).
Autoprotilátky
Vzorky plazmy dospelých pacientov sa vyšetrovali na autoprotilátky vo viacerých časových intervaloch. U pacientov s reumatoidnou artritídou vyšetrovaných na antinukleárne protilátky (ANA) bolo percento novo vzniknutých pozitívnych ANA (≥ 1:40) vyššie u pacientov liečených etanerceptom (11 %) ako u pacientov užívajúcich placebo (5 %). Percento pacientov, u ktorých sa objavila nová pozitivita protilátok proti dvojšpirálovej DNA (anti-dsDNA) bolo tiež vyššie pri rádioimunologickom stanovení (15 % pacientov liečených etanerceptom v porovnaní so 4 % pacientov užívajúcich placebo) a testom Crithidia luciliae (3 % pacientov liečených etanerceptom a žiaden pacient užívajúci placebo). Pomer pacientov liečených etanerceptom, u ktorých sa objavili antikardiolipínové protilátky bol
v porovnaní s pacientmi, ktorým bolo podávané placebo podobne zvýšený. Vplyv dlhodobej terapie etanerceptom na vývoj autoimunitného ochorenia nie je známy.
U pacientov vrátane pacientov s pozitívnym reumatoidným faktorom bola zriedkavo hlásená tvorba ďalších protilátok v spojitosti so syndrómom podobným lupusu alebo exantémom, ktorý je zhodný so subakútnym kožným lupusom alebo diskoidným lupusom na základe klinického obrazu a biopsie.
Pancytopénia a aplastická anémia
Existujú hlásenia po uvedení lieku na trh týkajúce sa pancytopénie a aplastickej anémie, niektoré z nich boli smrteľné (pozri časť 4.4).
Intersticiálna choroba pľúc
Existujú hlásenia po uvedení lieku na trh týkajúce sa intersticiálnej choroby pľúc (vrátane pneumonitídy a pulmonálnej fibrózy), pričom niektoré z nich boli smrteľné.
Súčasná liečba s anakinrou
V štúdiách, v ktorých dospelí pacienti dostávali súčasnú liečbu etanerceptom plus anakinrou sa pozoroval vyšší výskyt závažných infekcií v porovnaní s etanerceptom samotným a u 2 % pacientov (3/139) sa vyvinula neutropénia (absolútny počet neutrofilov < 1 000/mm3). Počas neutropénie sa vyvinula u jedného pacienta celulitída, ktorá ustúpila po hospitalizácii (pozri časti 4.4 a 4.5).
Zvýšené pečeňové enzýmy
V dvojito zaslepených obdobiach kontrolovaných klinických štúdií etanerceptu vo všetkých indikáciách bola frekvencia (podiel incidencie) nežiaducich účinkov spojených so zvýšením
pečeňových enzýmov u pacientov dostávajúcich etanercept bez súčasného podávania metotrexátu
0,54 % (frekvencia: menej časté). V dvojito zaslepených obdobiach kontrolovaných klinických štúdií umožňujúcich súčasnú liečbu etanerceptom a metotrexátom bola frekvencia (podiel incidencie)
nežiaducich účinkov spojených so zvýšenými pečeňovými enzýmami 4,18 % (frekvencia: časté).
Pediatrická populácia
Nežiaduce účinky u pediatrických pacientov s juvenilnou idiopatickou artritídou
Všeobecne, nežiaduce udalosti u pediatrických pacientov s juvenilnou idiopatickou artritídou boli, čo sa týka početnosti a typu, podobné ako tie u dospelých pacientov. Rozdiely u dospelých a iné zvláštne
okolnosti sa preberajú v nasledujúcich odsekoch.
Typy hlásených infekcií v klinických štúdiách u pacientov s juvenilnou idiopatickou artritídou vo veku
2 až 18 rokov boli vo všeobecnosti mierne až stredne závažné a zhodné s bežne pozorovanými infekciami u ambulantných pediatrických pacientov. Závažné nežiaduce účinky zahŕňali varicellu so
znakmi a príznakmi aseptickej meningitídy, ktorá odznela bez následkov (pozri tiež časť 4.4),
apendicitídu, gastroenteritídu, depresiu/poruchu osobnosti, kožnú ulceráciu a ezofagitídu/gastritídu, septický šok spôsobený streptokokmi skupiny A, diabetes mellitus typu I a infekcie mäkkých tkanív a operačných rán.
V jednej štúdii u detí s juvenilnou idiopatickou artritídou vo veku 4 až 17 rokov, 43 zo 69 (62 %) detí prekonalo infekciu v období, keď dostávali etanercept počas 3 mesiacov trvania štúdie (časť 1, otvorená), pričom frekvencia a závažnosť infekcií bola podobná u 58 pacientov, ktorí ukončili
12 mesačnú predĺženú liečbu v rámci otvorenej štúdie. Druh a podiel nežiaducich udalostí u pacientov s juvenilnou idiopatickou artritídou bol podobný ako u dospelých s reumatoidnou artritídou a väčšinou
boli mierne. Niektoré nežiaduce udalosti boli hlásené častejšie u 69 pacientov s juvenilnou
idiopatickou artritídou, ktorí užívali etanercept 3 mesiace než u 349 dospelých pacientov
s reumatoidnou artritídou. Tieto zahŕňajú bolesť hlavy (19 % pacientov, 1,7 prípadu na pacientorok), nauzeu (9 %, 1,0 prípad na pacientorok), abdominálnu bolesť (19 %, 0,74 prípadu na pacientorok)
a vracanie (13 %, 0,74 prípadu na pacientorok).
Boli hlásené 4 prípady syndrómu aktivácie makrofágov v klinických štúdiách juvenilnej idiopatickej artritídy.
V zdrojoch získaných po uvedení lieku na trh boli hlásené prípady zápalového črevného ochorenia
a uveitídy u pacientov s JIA liečených etanerceptom, vrátane malého počtu prípadov naznačujúcich
pozitívnu odozvu (pozri časť 4.4).
Nežiaduce účinky u pediatrických pacientov so psoriázou s plakmiV 48 týždňovej klinickej štúdii u 211 detí vo veku od 4 do 17 rokov s pediatrickou psoriázou s plakmi boli hlásené nežiaduce účinky podobné tým, ktoré boli pozorované v predchádzajúcich štúdiách
u dospelých so psoriázou s plakmi.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePočas klinických štúdií pacientov s reumatoidnou artritídou sa nepozorovala žiadna dávku limitujúca toxicita. Najvyššia hodnotená hladina dávky bola intravenózna nárazová dávka 32 mg/m2
s následnými subkutánnymi dávkami 16 mg/m2 podávanými dvakrát týždenne. Jeden pacient
s reumatoidnou artritídou si omylom podával 62 mg etanerceptu subkutánne dvakrát týždenne počas
3 týždňov bez výskytu nežiaducich účinkov. Nie je známe antidotum proti etanerceptu.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Imunosupresívum, inhibítory tumor nekrotizujúceho faktora alfa
(TNF-α), ATC kód: L04AB01
Benepali je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.Tumor nekrotizujúci faktor (TNF) je dominantným cytokínom v zápalovom procese reumatoidnej
artritídy. Zvýšené hladiny TNF sú taktiež nachádzané v synovii a psoriatických plakoch u pacientov so psoriatickou artritídou a v plazme a synoviálnom tkanive u pacientov s ankylozujúcou spondylitídou.
U pacientov so psoriázou s plakmi vedie infiltrácia zápalovými bunkami vrátane T-lymfocytov
k zvýšeniu hodnôt TNF v psoriatickej lézii v porovnaní s hodnotami v nepostihnutej koži. Etanercept je kompetetívnym inhibítorom väzby TNF na jeho receptor na povrchu bunky, a tým inhibuje biologickú aktivitu TNF. TNF a lymfotoxín sú prozápalové cytokíny, ktoré sa viažu na dva odlišné povrchové receptory buniek: 55-kilodaltonový (p55) a 75-kilodaltonový (p75) receptor pre tumor nekrotizujúci faktor (TNFR). Oba TNF-receptory sa prirodzene vyskytujú v membránovo-viazanej
a solubilnej forme. Predpokladá sa, že solubilné TNFR regulujú biologickú aktivitu TNF.
TNF a lymfotoxín existujú prevažne ako homotriméry, ktorých biologická aktivita závisí od priečnych väzieb povrchových bunkových TNF-receptorov. Dimérne solubilné receptory majú podobne ako etanercept vyššiu afinitu pre TNF ako monomérne receptory a sú výrazne účinnejšími kompetetívnymi inhibítormi väzby TNF na jeho bunkové receptory. Navyše, použitie Fc fragmentu imunoglobulínu
ako fúzneho elementu pri konštrukcii dimérneho receptora predlžuje polčas v sére.
MechanizmusúčinkuVeľká časť kĺbovej patológie pri reumatoidnej artritíde a ankylozujúcej spondylitíde a kožnej patológii v psoriatických plakoch je sprostredkovaná prozápalovými molekulami, ktoré tvoria systém kontrolovaný TNF. Predpokladaný mechanizmus účinku etanerceptu spočíva v kompetetívnej inhibícii väzby TNF na TNFR na povrchu bunky, a tým jeho biologická inaktivácia zabráni TNF sprostredkovanej bunkovej odpovedi. Etanercept môže tiež modulovať biologickú odpoveď kontrolovanú ďalšími molekulami zápalovej kaskády (napr. cytokínmi, adhezívnymi molekulami
alebo proteinázami), ktoré sú indukované alebo regulované prostredníctvom TNF.
K
l
i
n
i
cká
účinnosť
a
bezpečnosť
Táto časť uvádza údaje zo štyroch randomizovaných, kontrolovaných štúdií u dospelých
s reumatoidnou artritídou, jednej štúdie u dospelých so psoriatickou artritídou, jednej štúdie
u dospelých s ankylozujúcou spondylitídou, jednej štúdie u dospelých s axiálnou spondyloartritídou bez rádiografického dôkazu a štyroch štúdií u dospelých so psoriázou s plakmi, troch štúdií
u pacientov s juvenilnou idiopatickou artritídou a jednej štúdie u pediatrických pacientov so psoriázou s plakmi.
Dospelí pacienti s reumatoidnou artritídou
Účinnosť etanerceptu sa posudzovala v randomizovanej, dvojito zaslepenej placebom kontrolovanej štúdii. Štúdia hodnotila 234 dospelých pacientov s aktívnou reumatoidnou artritídou, u ktorých zlyhala
terapia najmenej jedným, ale nie viac ako štyrmi chorobu modifikujúcimi antireumatikami (DMARD).
Dávky 10 mg alebo 25 mg etanerceptu alebo placeba boli podávané subkutánne dvakrát týždenne 6 po sebe nasledujúcich mesiacov. Výsledky tejto kontrolovanej štúdie boli vyjadrené v percentuálnom
zlepšení reumatoidnej artritídy s použitím kritérií odpovede na terapiu podľa Americkej
reumatologickej spoločnosti (ACR).
Odpovede ACR 20 a 50 boli vyššie u pacientov liečených etanerceptom v 3. a 6. mesiaci než
u pacientov liečených placebom (ACR 20: etanercept 62 % po 3 mesiacoch a 59 % po 6 mesiacoch, placebo 23 % po 3 mesiacoch a 11 % po 6 mesiacoch; ACR 50: etanercept 41 % po 3 mesiacoch
a 40 % po 6 mesiacoch, placebo 8 % po 3 mesiacoch a 5 % po 6 mesiacoch; p < 0,01 pre etanercept oproti placebu vo všetkých časových bodoch, ako pre odpoveď ACR 20, tak aj pre odpoveď ACR 50).
Približne 15 % osôb, ktoré dostávali etanercept dosiahlo odpoveď ACR 70 v 3. mesiaci a v 6. mesiaci v porovnaní s menej ako 5 % osôb v skupine s placebom. Medzi pacientmi užívajúcimi etanercept sa klinická odpoveď obvykle dosiahla počas 1 až 2 týždňov od začiatku terapie a takmer vždy do
3 mesiacov. Pozorovala sa odpoveď v závislosti na dávke; výsledky s dávkou 10 mg sa nachádzali na prechode medzi placebom a 25 mg. Etanercept bol výrazne lepší než placebo vo všetkých ACR
kritériách, rovnako ako aj v ďalších ukazovateľoch aktivity reumatoidnej artritídy, ktoré nie sú
obsiahnuté v ACR kritériách odpovede na terapiu, takým je napr. ranná stuhnutosť. Dotazník hodnotenia zdravia (Health Assessment Questionnaire, HAQ), ktorý zahŕňa invaliditu, vitalitu,
mentálne zdravie, celkový zdravotný stav a jednotlivé zložky zdravotného stavu asociované
s artritídou bol počas štúdie vyplňovaný každé 3 mesiace. U pacientov liečených etanerceptom v porovnaní s kontrolami došlo v 3. a 6. mesiaci k zlepšeniu vo všetkých oblastiach HAQ.
Po prerušení liečby etanerceptom sa príznaky artritídy spravidla vrátili do jedného mesiaca. Na základe výsledkov z otvorených štúdií sa zistilo, že opätovné nasadenie liečby etanerceptom do
24 mesiacov od jej prerušenia malo za následok rovnako veľkú odpoveď ako u pacientov, ktorí etanercept užívali bez prerušenia liečby. V otvorených, rozširujúcich štúdiách sa u pacientov užívajúcich etanercept bez prerušenia pozorovalo, že stabilné odpovede pretrvávajú až do 10 rokov.
Účinnosť etanerceptu a metotrexátu sa porovnávala v randomizovanej, aktívne kontrolovanej štúdii so slepými rádiografickými hodnoteniami ako primárnym koncovým bodom u 632 dospelých pacientov
s aktívnou reumatoidnou artritídou (< 3 roky trvanie), ktorí nikdy neboli liečení metotrexátom. Etanercept sa v dávke 10 mg alebo 25 mg podával subkutánne (s.c.) dvakrát do týždňa po dobu až
24 mesiacov. Dávky metotrexátu sa stupňovali od 7,5 mg týždenne, maximálne až do 20 mg týždenne a to počas prvých 8 týždňov štúdie a pokračovalo sa v nich až do 24 mesiacov. Klinické zlepšenie
vrátane nástupu účinku do 2 týždňov bolo pri podávaní etanerceptu 25 mg podobné ako
v predchádzajúcich štúdiách a pretrvalo až do 24 mesiacov. Pred liečbou na začiatku štúdie mali pacienti stredne závažný stupeň invalidity s priemerným skóre HAQ 1,4 až 1,5. Liečba etanerceptom
25 mg viedla k významnému zlepšeniu po 12 mesiacoch, pričom 44 % pacientov dosiahlo normálne
HAQ skóre (menej ako 0,5). Toto zlepšenie pretrvalo do 2. roku štúdie.
V tejto štúdii sa štrukturálne poškodenie kĺbov hodnotilo rádiograficky a vyjadrovalo sa ako zmena v celkovom skóre ostrosti (Total Sharp Score, TSS) a v jeho zložkách, v erozívnom skóre a v skóre zužovania medzikĺbového priestoru (Joint Space Narrowing Score, JSN). Rtg snímky rúk/zápästí
a nôh sa hodnotili pred liečbou a po 6, 12 a 24 mesiacoch liečby. 10 mg dávka etanerceptu mala trvale
nižší účinok na štrukturálne poškodenie ako dávka 25 mg. Etanercept 25 mg bol signifikantne lepší ako metotrexát v erozívnom skóre, a to ako po 12, tak i po 24 mesiacoch. Pri liečbe metotrexátom
a etanerceptom neboli rozdiely v TSS a JSN štatisticky signifikantné. Pozri výsledky na obrázku
uvedenom nižšie.
Rádiografická progresia: Porovnanie etanerceptu a metotrexátu u pacientov s reumatoidnou artritídou trvajúcou do 3 rokov
V ďalšej aktívne kontrolovanej, dvojito zaslepenej, randomizovanej štúdii sa porovnávala klinická účinnosť, bezpečnosť a rádiografická progresia u pacientov s reumatoidnou artritídou, ktorí boli liečení samotným etanerceptom (25 mg dvakrát týždenne) alebo samotným metotrexátom (7,5 až
20 mg týždenne, priemerná dávka 20 mg) alebo kombináciou etanerceptu a metotrexátu, pričom ich aplikácia začala súčasne; a to u 682 dospelých pacientov s aktívnou reumatoidnou artritídou, trvajúcou
6 mesiacov až 20 rokov (v priemere 5 rokov), ktorí menej ako uspokojivo odpovedali na liečbu
najmenej jedným ochorenie modifikujúcim antireumatikom (DMARD) okrem metotrexátu.
U pacientov liečených etanerceptom v kombinácii s metotrexátom boli signifikantne vyššie odpovede ACR 20, ACR 50 a ACR 70, ako i zlepšenia v skóre DAS a HAQ než u pacientov liečených iba jedným liekom, a to ako 24, tak i po 52 týždňoch (výsledky sú uvedené v nasledujúcej tabuľke). Signifikantne lepšie výsledky etanerceptu v kombinácii s metotrexátom v porovnaní s monoterapiou etanerceptom a monoterapiou metotrexátom sa pozorovali aj po 24 mesiacoch.
Výsledky klinickej účinnosti po 12 mesiacoch: Porovnanie etanerceptu, metotrexátua etanerceptu v kombinácii s metotrexátom u pacientov s reumatoidnou artritídou trvajúcou6 mesiacov až 20 rokov
K
oncový bod
Metotrexát
(
n = 228)
E
t
anercept
(
n = 223)
E
t
anercept
+
Metotrexát
(
n = 231)
O
dpovede
ACR
a
ACR 20 58,8 % 65,5 % 74,5 %†, Φ
ACR 50 36,4 % 43,0 % 63,2 %†, Φ
ACR 70 16,7 % 22,0 % 39,8 %†, Φ
DA
S (Skóreb)
východiskové skóre
(Skóreb) po
52 týždňoch
5,5 5,7 5,5
3,0 3,0 2,3†, Φ
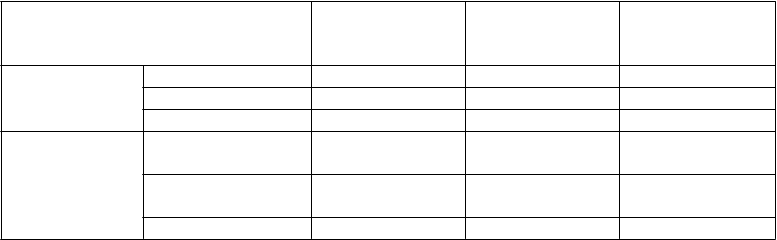
Remisiac 14 % 18 % 37 %†, Φ
H
A
Q Východiskové skóre
1,7 1,7 1,8

52. týždeň 1,1 1,0 0,8†, Φ
a Pacienti, ktorí neukončili 12 mesiacov v štúdii, boli považovaní za neodpovedajúcich na liečbu.
b Hodnoty DAS sú priemery.
c Remisia je definovaná ako DAS < 1,6.
p-hodnoty párových porovnávaní: † = p < 0,05 pre porovnanie etanerceptu + metotrexátu oproti metotrexátu a Φ = p < 0,05 pre porovnanie etanerceptu + metotrexátu oproti etanerceptu.
V skupine liečenej etanerceptom bola rádiografická progresia po 12 mesiacoch signifikantne nižšia
ako v skupine liečenej metotrexátom, pričom kombinácia bola v spomaľovaní rádiografickej progresie významne lepšia ako obe monoterapie (pozri obrázok nižšie).
Rádiografická progresia: Porovnanie etanerceptu, metotrexátu a etanerceptu v kombinácii s metotrexátom u pacientov s reumatoidnou artritídou trvajúcou 6 mesiacov až 20 rokov (výsledky po 12 mesiacoch) p-hodnoty párových porovnávaní: * = p < 0,05 pre porovnanie etanerceptu oproti metotrexátu, †= p
< 0,05 pre porovnanie etanerceptu + metotrexátu oproti metotrexátu a Φ = p < 0,05 pre porovnanie etanerceptu + metotrexátu oproti etanerceptu.
Signifikantne lepšie výsledky etanerceptu v kombinácii s metotrexátom v porovnaní s monoterapiou etanerceptom a monoterapiou metotrexátom sa pozorovali aj po 24 mesiacoch. Podobne, signifikantné výhody monoterapie etanerceptom v porovnaní s monoterapiou metotrexátom sa pozorovali aj po
24 mesiacoch.
V analýze, v ktorej boli všetci pacienti, ktorí vypadli zo štúdie z akéhokoľvek dôvodu považovaní za pacientov s progresiou bolo percento pacientov bez progresie (zmena CSO ≤ 0,05) po 24 mesiacoch vyššie v skupine liečenej etanerceptom v kombinácii s metotrexátom v porovnaní so skupinou liečenou samotným etanerceptom a so skupinou liečenou samotným metotrexátom (62 %, 50 %,
respektíve 36 %; p < 0,05). Rozdiel medzi samotným etanerceptom a samotným metotrexátom bol tiež signifikantný (p < 0,05). Medzi pacientmi, ktorí ukončili plných 24 mesiacov liečby v štúdii bola
miera bez progresie 78 %, 70 %, respektíve 61 %.
Bezpečnosť a účinnosť 50 mg etanerceptu (dve 25 mg subkutánne injekcie) podaného jedenkrát týždenne sa hodnotila v dvojito zaslepenej, placebom kontrolovanej štúdií u 420 pacientov s aktívnou RA. V tejto štúdií 53 pacientov dostávalo placebo, 214 pacientov dostávalo 50 mg etanerceptu jedenkrát týždenne a 153 pacientov dostávalo 25 mg etanerceptu dvakrát týždenne. Profil bezpečnosti a účinnosti dvoch liečebných režimov etanerceptu bol porovnateľný v ôsmom týždni v účinku na znaky a symptómy RA; údaje v 16. týždni nepreukázali porovnateľnosť (non inferioritu) medzi dvomi liečbami. Jednu 50 mg/ml injekciu etanerceptu možno považovať za bioekvivalentnú dvom súčasne podávaným 25 mg/ml injekciám.
Dospelí pacienti so psoriatickou artritídou
Účinnosť etanerceptu sa hodnotila v randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii u 205 pacientov so psoriatickou artritídou. Pacienti boli vo veku od 18 do 70 rokov a mali
aktívnu psoriatickú artritídu (≥ 3 opuchnuté kĺby a ≥ 3 stuhnuté kĺby) aspoň v jednej z nasledujúcich foriem: (1) distálne interfalangeálne (DIP) postihnutie; (2) polyartikulárna artritída (neprítomnosť
reumatoidných uzlíkov a prítomnosť psoriázy); (3) mutilujúca artritída; (4) asymetrická psoriatická artritída alebo (5) ankylóza podobná spondylitíde. Pacienti mali taktiež psoriázu s plakmi
s kvalifikujúcou cieľovou léziou ≥ 2 cm v priemere.
Pacienti boli v minulosti liečení NSAIDs (86 %), DMARDs (80 %) a kortikosteroidmi (24 %).
Pacienti práve liečení metorexátom (stabilní počas ≥ 2 mesiacov) mohli pokračovať pri stabilnej dávke metotrexátu ≤ 25 mg/týždeň. Dávky 25 mg etanerceptu (založené na štúdiách pre zistenie dávky
u pacientov s reumatoidnou artritídou) alebo placeba boli podávané subkutánne dvakrát týždenne
počas 6 mesiacov. Na konci dvojito zaslepenej štúdie mohli pacienti vstúpiť do dlhodobej otvorenej pokračujúcej štúdie s celkovým trvaním až do 2 rokov.
Klinické odpovede sa vyjadrili ako percento pacientov, ktorí dosiahli odpoveď ACR 20, 50 a 70
a percento zlepšenia podľa kritérií odpovede u psoriatickej artritídy (Psoriatic Arthritis Response
Criteria, PsARC). Výsledky sú sumarizované v nižšie uvedenej tabuľke.
Odpoveď pacientov so psoriatickou artritídou v placebom kontrolovanej štúdii
O
dpoveď psoriatickej artritídy
P
e
rcento pacientov
Placebo n = 104
E
t
anercept
a
n = 101
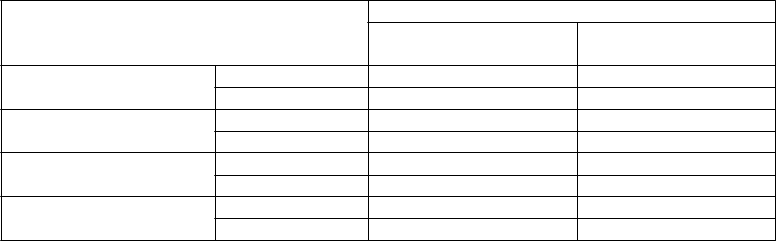 AC
R 20
AC
R 20 Mesiac 3 15 59b
Mesiac 6 13 50b
ACR 50 Mesiac 3 4 38b
Mesiac 6 4 37b
ACR 70 Mesiac 3 0 11b
Mesiac 6 1 9c
PsARC Mesiac 3 31 72b
Mesiac 6 23 70b a 25 mg etanercept s.c. dvakrát týždenne
b p < 0,001, etanercept vs. Placebo
c p < 0,01, etanercept vs. Placebo
Medzi pacientmi so psoriatickou artritídou, ktorí dostávali etanercept bola klinická odpoveď zjavná
v čase prvej návštevy (4 týždne) a pretrvávala počas 6 mesiacov terapie. Etanercept bol signifikantne lepší než placebo vo všetkých charakteristikách aktivity ochorenia (p < 0,001) a odpoveď bola podobná so súčasnou metotrexátovou terapiou alebo bez nej. Kvalita života u pacientov so psoriatickou artritídou sa hodnotila pri každej návšteve s použitím indexu invalidity HAQ. Skóre indexu invalidity bolo signifikantne zlepšené pri všetkých návštevách u pacientov so psoriatickou artritídou liečených etanerceptom v porovnaní s placebom (p < 0,001).
V štúdii psoriatickej artritídy boli hodnotené rádiografické zmeny. RTG snímky rúk a zápästí boli zaznamenané vo východiskovom stave a v 6., 12. a 24. mesiaci. Modifikované TSS v 12. mesiaci je znázornené v tabuľke uvedenej nižšie. V analýze, v ktorej všetci pacienti, ktorí vypadli zo štúdie
z akéhokoľvek dôvodu boli považovaní za pacientov s progresiou bol percentuálny podiel pacientov bez progresie (zmena TSS ≤ 0,5) v 12. mesiaci vyšší v skupine etanerceptu v porovnaní so skupinou placeba (73 % vs. 47 %, p ≤ 0,001). Účinok etanerceptu na rádiografickú progresiu bol zachovaný
u pacientov, ktorí pokračovali v liečbe počas druhého roka. Spomalenie poškodenia periférnych kĺbov sa pozorovalo u pacientov s polyartikulárnym symetrickým postihnutím kĺbov.
Priemerná (SE) ročná zmena celkového skóre ostrosti (TSS) z východiskového stavu
Č
as
Placebo
(
n = 104)
E
t
anercept
(
n = 101)

12. mesiac 1,00 (0,29) -0,03 (0,09)a
SE = štandardná chyba
a p = 0,0001
Liečba etanerceptom viedla k zlepšeniu fyzickej funkcie v priebehu dvojito zaslepenej fázy a toto zlepšenie sa udržalo počas dlhodobej expozície až do 2 rokov.
Nie sú k dispozícii dostatočné údaje o účinnosti etanerceptu u pacientov s artropatiami podobnými ankylozujúcej spondylitíde a psoriatickej artritíde mutilans pre malý počet sledovaných pacientov.
U pacientov so psoriatickou artritídou nebola uskutočnená štúdia s dávkovacím režimom 50 mg jedenkrát týždenne. V tejto populácii bol dôkaz účinnosti pre dávkovací režim jedenkrát týždenne založený na údajoch zo štúdie u pacientov s ankylozujúcou spondylitídou.
Dospelí pacienti s ankylozujúcou spondylitídouÚčinnosť etanerceptu pri ankylozujúcej spondylitíde sa hodnotila v 3 randomizovaných, dvojito zaslepených štúdiách porovnávajúcich podávanie etanerceptu 25 mg dvakrát týždenne s placebom.
Celkovo bolo do štúdie zaradených 401 pacientov, z ktorých 203 bolo liečených etanerceptom. Najväčšia z týchto štúdií (n = 277) zahŕňala pacientov vo veku 18 až 70 rokov s aktívnou
ankylozujúcou spondylitídou definovanou pomocou vizuálnej analógovej škály (VAS) so skóre ≥ 30
pre priemernú dĺžku trvania a intenzitu rannej stuhnutosti a VAS skóre ≥ 30 pre aspoň 2
z nasledujúcich 3 parametrov: pacientovo globálne hodnotenie, priemer hodnôt VAS pre nočnú bolesť chrbta a celkovú bolesť chrbta, priemer z 10 otázok Bath funkčného indexu ankylozujúcej
spondylitídy (
Bath Ankylosing Spondylitis Functional Index, BASFI). Pacienti užívajúci DMARD,
nesteroidové antiflogistiká alebo kortikosteroidy mohli pokračovať v ich užívaní pri stabilných dávkach. Pacienti s kompletnou ankylózou chrbtice neboli do štúdie zahrnutí. Dávky 25 mg etanerceptu (na základe štúdií dávok u pacientov s reumatoidnou artritídou) alebo placebo boli podávané dvakrát týždenne počas 6 mesiacov u 138 pacientov.
Primárny ukazovateľ účinnosti (ASAS 20) bol ≥ 20 % zlepšenie aspoň u 3 zo 4 domén hodnotenia u ankylozujúcej spondylitídy (
Assessment in Ankylosing Spondylitis, ASAS) (zahŕňa pacientovo globálne hodnotenie, bolesť chrbta, BASFI a zápal) a žiadne zhoršenie v ostatných doménach. ASAS 50 a 70 odpovede používali rovnaké kritériá s 50 % alebo 70 % zlepšením.
V porovnaní s placebom sa pri liečbe etanerceptom dosiahlo signifikantné zlepšenie ASAS 20, ASAS 50 a ASAS 70 už 2 týždne po zahájení liečby.
O
dpovede pacientov s ankylozujúcou spondylitídou v placebom kontrolovanej štúdii
O
dpoveď ankylozujúcej spondylitídy
A
SAS 20
P
e
rcento pacientov
Placebo n = 139
E
t
anercept n = 138

Týždne 2 22 46a
Mesiace 3 27 60a
Mesiace 6 23 58a
ASAS 50Týždne 2 7 24a
Mesiace 3 13 45a
Mesiace 6 10 42a
ASAS 70Týždne 2 2 12b
Mesiace 3 7 29b
Mesiace 6 5 28b a p < 0,001, etanercept vs. Placebo
b p = 0,002, etanercept vs. Placebo
Medzi pacientmi s ankylozujúcou spondylitídou dostávajúcimi etanercept bola klinická odpoveď zjavná v čase prvej návštevy (2 týždne) a pretrvávala počas 6 mesačnej terapie. Na začiatku terapie boli u pacientov so súčasnou liečbou alebo bez nej odpovede podobné.
Podobné výsledky sa získali v 2 menších štúdiách s ankylozujúcou spondylitídou.
V štvrtej štúdii bola hodnotená bezpečnosť a účinnosť etanerceptu 50 mg (dvoch 25 mg subkutánnych injekcií) podávaných jedenkrát týždenne verzus etanercept 25 mg podávaný dvakrát týždenne
v dvojito zaslepenej, placebom kontrolovanej klinickej štúdii u 356 pacientov s aktívnou
ankylozujúcou spondylitídou. Profily bezpečnosti a účinnosti režimov 50 mg jedenkrát týždenne a 25 mg dvakrát týždenne boli podobné.
Dospelí pacienti s axiálnou spodyloartritídou bez rádiografického dôkazuÚčinnosť etanerceptu sa u pacientov s axiálnou spondyloartritídou bez rádiografického dôkazu
(nr-AxSpa) hodnotila v randomizovanej, 12-týždňovej dvojito zaslepenej, placebom kontrolovanej štúdii. V štúdii sa vyhodnocovalo 215 dospelých pacientov (modifikovaná populácia podľa liečebného zámeru) s aktívnou formou nr-AxSpa (vo veku 18 až 49 rokov) definovaných ako pacienti, ktorí spĺňajú kritériá axiálnej spondyloartritídy podľa klasifikácie ASAS, ale nesplnili modifikované newyorské kritériá pre AS. U pacientov sa tiež vyžadovalo, aby mali neadekvátnu odpoveď alebo aby neznášali dve alebo viac NSAIDs. V období dvojitého zaslepenia pacienti dostávali etanercept v dávke
50 mg týždenne alebo placebo počas 12 týždňov. Primárnym dôkazom účinnosti (ASAS 40) bolo
40 % zlepšenie v minimálne troch zo štyroch domén ASAS a neprítomnosť zhoršenia v zostávajúcej doméne. Po období dvojitého zaslepenia nasledovalo odslepené obdobie, počas ktorého všetci pacienti dostávali etanercept v dávke 50 mg týždenne počas ďalších 92 týždňov. Na vyhodnotenie zápalu na začiatku a počas týždňov 12 a 104 sa vykonali vyšetrenia sakroiliakálneho kĺbu a chrbtice pomocou MRI.
V porovnaní s placebom viedla liečba etanerceptom k štatisticky významnému zlepšeniu v ASAS 40, ASAS 20 a ASAS 5/6. Významné zlepšenie sa tiež pozorovalo pri čiastočnej remisii ASAS
a BASDAI 50. Výsledky v 12. týždni sú uvedené v tabuľke nižšie.
O
dpoveď účinnosti v placebom kontrolovanej štúdii nr-AxSpa: Percento pacientov, ktorí dosiahli cieľové ukazovatele
D
vojito zaslepené klinické
odpovede v 12. týždni
Placebo
n = 106 až 109*
E
t
anercept
n = 103 až 105*

ASAS** 40 15,7 32,4b
ASAS 20 36,1 52,4c ASAS 5/6 10,4 33,0a ASAS čiastočnej remisie 11,9 24,8c
BASDAI***50 23,9 43,8b
*Niektorí pacienti neposkytli kompletné údaje pre každý cieľový ukazovateľ
**ASAS = Assessments in Spondyloarthritis International Society
***Bath Ankylosing Spondylitis Disease Activity Index
a: p < 0,001, b: < 0,01 a c: < 0,05 medzi etanerceptom a placebom v uvedenom poradí
U pacientov, ktorí dostávali etanercept, sa v 12. týždni objavilo štatisticky významné zlepšenie v skóre SPARCC (
Spondyloarthritis Research Consortium of Canada) pri sakroiliakálnom kĺbe (SIJ) na základe merania MRI. Upravená priemerná zmena z východiskovej hodnoty bola 3,8 u pacientov liečených etanerceptom (n = 95) oproti 0,8 u pacientov liečených placebom (n = 105) (p < 0,001).
V 104. týždni u všetkých pacientov, ktorí dostávali etanercept, priemerná zmena z východiskovej hodnoty v skóre SPARCC, na základe merania MRI, bola pri SIJ 4,64 (n = 153) a 1,40 (n = 154) pre
chrbticu.
Vo väčšine hodnotení kvality života súvisiacej so zdravotným stavom a hodnotení telesných funkcií vrátane BASFI (
Bath Ankylosing Spondylitis Functional Index), skóre celkového zdravotného stavu EuroQol 5D a skóre telesnej zložky SF-36 sa pri etanercepte preukázalo štatisticky významne väčšie zlepšenie od východiskového stavu do 12. týždňa v porovnaní s placebom.
Klinické odpovede medzi pacientmi s nr-AxSpa, ktorí dostávali etanercept, boli zreteľné v čase prvej návštevy (2 týždne) a počas 2 rokov liečby sa udržali. Počas 2 rokov liečby sa udržalo aj zlepšenie kvality života súvisiacej so zdravím a zlepšenie fyzických funkcií. 2-ročné údaje neodhalili žiadne nové bezpečnostné zistenia. V 104. týždni 8 pacientov progredovalo do stupňa 2 bilaterálneho skóre RTG chrbtice, podľa modifikovaných Newyorských kritérií, svedčiacich pre axiálnu spondyloartropatiu.
Dospelí pacienti so psoriázou s plakmiEtanercept sa odporúča na použitie u pacientov podľa definície uvedenej v časti 4.1. Pacienti,
u ktorých „odpoveď zlyhala“ sa v cieľovej populácii definuje nedostatočnou odpoveďou (PASI < 50 alebo PGA nižší stupeň ako dobrá) alebo zhoršením ochorenia počas liečby alebo ak sa liečba jednou z troch dostupných systémových terapií podáva dostatočne dlho a v adekvátnej dávke, aby sa mohla zhodnotiť odpoveď.
Účinnosť etanerceptu oproti iným systémovým terapiám u pacientov so stredne závažnou až závažnou psoriázou (odpovedajúcou na inú systémovú terapiu) sa nehodnotila v priamych porovnávajúcich štúdiách etanerceptu s inými systémovými terapiami. Namiesto toho sa bezpečnosť a účinnosť etanerceptu hodnotila v štyroch randomizovaných, dvojito zaslepených, placebom kontrolovaných štúdiách. Primárny sledovaný parameter účinnosti vo všetkých štyroch štúdiách bol podiel pacientov
v každej liečebnej skupine, ktorí dosiahli PASI 75 (to znamená najmenej 75 % zlepšenie Psoriatickej plochy a Indexu závažnosti oproti východiskovému stavu) po 12 týždňoch.
Štúdia 1 bola štúdia II. Fázy u pacientov s aktívnou, ale klinicky stabilnou psoriázou s plakmi, ktorá postihovala ≥ 10 % povrchu tela, ktorí mali ≥ 18 rokov. Bolo randomizovaných 112 pacientov, ktorí dostávali 25 mg etanerceptu (n = 57) alebo placebo (n = 55) dvakrát do týždňa po dobu 24 týždňov.
Štúdia 2 hodnotila 652 pacientov s chronickou psoriázou s plakmi a mala tie isté zaraďovacie kritériá ako štúdia 1 plus psoriatická plocha a index závažnosti (PASI) v skríningu minimálne 10. Etanercept
sa podával v dávkach 25 mg raz za týždeň, 25 mg dvakrát za týždeň alebo 50 mg dvakrát za týždeň v trvaní 6 mesiacov. Počas prvých 12 týždňov dvojito zaslepenej periódy liečby pacienti dostávali placebo alebo jednu z troch uvedených dávok etanerceptu. Po 12. týždňoch liečby začali pacienti
v skupine s placebom so zaslepenou liečbou etanerceptom (25 mg dvakrát do týždňa); pacienti v aktívne liečených skupinách pokračovali do 24. týždňa v dávke, na ktorú boli pôvodne randomizovaní.
Štúdia 3 hodnotila 583 pacientov a mala také isté zaraďovacie kritériá ako štúdia 2. Pacienti v tejto štúdii dostávali dávku 25 mg alebo 50 mg etanerceptu alebo placebo, dvakrát do týždňa v trvaní
12 týždňov a potom dostali všetci pacienti etanercept 25 mg dvakrát týždenne v otvorenej fáze počas
ďalších 24 týždňov.
Štúdia 4 hodnotila 142 pacientov a mala podobné vstupné kritériá ako štúdie 2 a 3. Pacienti dostávali v tejto štúdii dávku 50 mg etanerceptu alebo placebo jedenkrát týždenne v trvaní 12 týždňov a potom dostávali všetci pacienti v otvorenej fáze etanercept 50 mg jedenkrát týždenne počas ďalších
12 týždňov.
V štúdii 1 bol v skupine liečenej etanerceptom signifikantne vyšší podiel pacientov s PASI 75 odpoveďou v týždni 12 (30 %) v porovnaní s placebo skupinou (2 %) (p < 0,0001). Po 24 týždňoch dosiahlo 56 % pacientov v skupine liečenej etanerceptom PASI 75 v porovnaní s 5 % v skupine
s placebom. Kľúčové výsledky štúdie 2, 3 a 4 sú uvedené nižšie.
Odpovede pacientov so psoriázou s plakmi v štúdiách 2, 3 a 4
Štúdia 2 Štúdia 3 Štúdia 4
Etanercept
Etanercept
Etanercept
Odpo- veď
Placeb o
25 mg 2x za týždeň
50 mg 2x za týždeň
Placeb o
25 mg
2x za týždeň
50 mg
2x za týždeň
Placeb o
50 mg
1x za týždeň
50 mg
1x za týždeň
( %)
n =
166
n =
162
n =
162
n =
164
n =
164
n =
193
n =
196
n =
196 n = 46 n = 96 n = 90
týždeň
12
týždeň
12
týždeň
24a
týždeň
12
týždeň
24a
týždeň
12
týždeň
12
týždeň
12
týždeň
12
týždeň
12
týždeň
24a
PASI 50 14 58* 70 74* 77 9 64* 77* 9 69* 83
PASI 75 4 34* 44 49* 59 3 34* 49* 2 38* 71
DSGAb, čistý
alebo
takmer čistý
5 34* 39 49* 55 4 39* 57* 4 39* 64
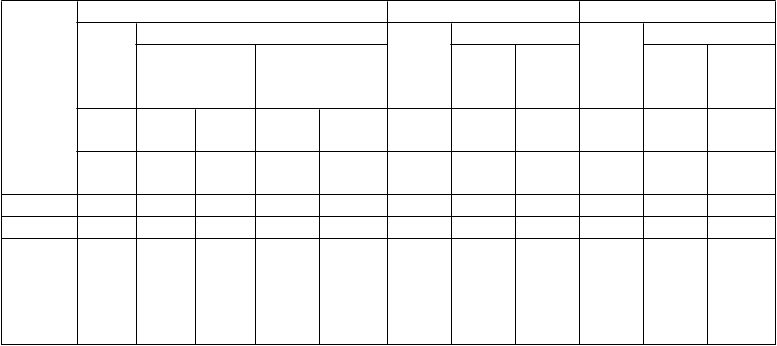
*p ≤ 0,0001 v porovnaní s placebom
a V štúdiách 2 a 4 sa nerobili žiadne štatistické porovnania s placebom v týždni 24 pretože pôvodná placebo skupina začala dostávať etanercept 25 mg dvakrát za týždeň alebo 50 mg jedenkrát za týždeň
od týždňa 13 do týždňa 24.
b Globálne hodnotenie stavu dermatológom. Čistý alebo takmer čistý definovaný ako 0 alebo 1 na škále 0 až 5.
U pacientov trpiacich na psoriázu s plakmi, ktorí dostávali etanercept boli signifikantné odpovede
v porovnaní s placebom zrejmé v čase prvej návštevy (2 týždne) a pretrvali počas 24 týždňov liečby.
Štúdia 2 mala aj obdobie prerušenia počas ktorého sa u pacientov, ktorí dosiahli najmenej 50 % zlepšenie PASI v týždni 24 zastavila liečba. Bez liečby sa u pacientov sledovalo znovu objavenie ložísk (PASI ≥ 150 % referenčnej hodnoty) a čas do nástupu relapsu (definovaného ako strata najmenej polovice zlepšenia dosiahnutého medzi východiskovým stavom a týždňom 24). Počas obdobia prerušenia sa príznaky psoriázy postupne vracali s mediánom času do relapsu 3 mesiace. Nepozorovala sa opätovná erupcia, ani so psoriázou súvisiace závažné nežiaduce udalosti. Našli sa
určité dôkazy podporujúce prospešnosť opakovanej liečby etanerceptom u pacientov, ktorí iniciálne odpovedajú na liečbu.
V štúdii 3 väčšina pacientov (77 %), ktorí boli pôvodne randomizovaní na 50 mg dvakrát do týždňa
a ich dávka etanerceptu sa znížila v týždni 12 na 25 mg dvakrát do týždňa si udržala PASI 75 odpoveď až do týždňa 36. U pacientov, ktorí dostávali 25 mg dvakrát do týždňa počas celej štúdie pokračovalo
zlepšovanie PASI 75 odpovede medzi týždňami 12 a 36.
V štúdii 4 mala skupina liečená etanerceptom vyšší podiel pacientov s PASI 75 v týždni 12 (38 %) v porovnaní so skupinou liečenou placebom (2 %) (p < 0,0001). U pacientov, ktorí dostávali počas štúdie 50 mg jedenkrát do týždňa sa účinnosť neustále zlepšovala a 71 % pacientov dosiahlo PASI 75 v týždni 24.
V dlhotrvajúcich (až do 34 mesiacov) otvorených štúdiách, v ktorých sa etanercept podával bez prerušenia sa klinické odpovede zachovali a bezpečnosť bola porovnateľná s bezpečnosťou pri krátkotrvajúcich štúdiách.
Analýza klinických údajov neukázala žiadne základné charakteristiky ochorenia, ktoré by mohli byť nápomocné pre lekárov pri výbere najvhodnejšieho dávkovania (intermitentného alebo kontinuálneho). Preto výber intermitentnej alebo kontinuálnej liečby má byť založený na posúdení lekára a na individuálnych potrebách pacienta.
Protilátky proti etanerceptu
Protilátky proti etanerceptu sa našli v plazme niektorých osôb liečených etanerceptom. Tieto protilátky vo všeobecnosti neboli neutralizujúce a sú dočasné. Neprejavila sa korelácie medzi tvorbou protilátky
a klinickou odpoveďou alebo nežiaducimi udalosťami.
Pediatrická populácia
Pediatrickí pacienti s juvenilnou idiopatickou artritídou
Bezpečnosť a účinnosť etanerceptu bola hodnotená v dvoch častiach štúdie so 69 deťmi
s polyartikulárnym priebehom juvenilnej idiopatickej artritídy v rôzne rozvinutých štádiách juvenilnej idiopatickej artritídy (polyartritída, oligoartritída, systémový začiatok). Zaradení boli pacienti vo veku od 4 do 17 rokov, so stredne až vysoko aktívnou juvenilnou idiopatickou artritídou s polyartikulárnym priebehom, refraktérnou na metotrexát alebo s intoleranciou metotrexátu; pacienti zostali na stabilnej dávke jedného nesteroidového antiflogistika a/alebo prednizónu (< 0,2 mg/kg/deň alebo maximálne
10 mg). V časti 1 dostávali všetci pacienti 0,4 mg/kg (maximálne 25 mg v dávke) etanerceptu
subkutánne dvakrát týždenne. V časti 2 boli pacienti s klinickou odpoveďou na 90. deň randomizovaní na tých, ktorí zostanú na liečbe etanerceptom alebo tých, ktorí budú užívať placebo počas 4 mesiacov
a hodnotilo sa u nich opätovné vzplanutie ochorenia. Odpoveď sa merala použitím ACR Pedi 30, ktorá je určená ako 30 % zlepšenie v najmenej troch zo šiestich a 30 % zhoršenie v nie viac ako jednom zo šiestich JRA hlavných kritérií, vrátane počtu aktívnych kĺbov, obmedzenia hybnosti, celkového hodnotenia lekárom a pacientom/rodičom, funkčného hodnotenia a rýchlosti sedimentácie erytrocytov (Erythrocyte Sedimentation Rate, ESR). Vzplanutie ochorenia sa definovalo ako 30 % zhoršenie
v troch zo šiestich JRA hlavných kritérií a 30 % zlepšenie v nie viac ako jednom zo šiestich JRA
hlavných kritérií a minimálne dva aktívne kĺby.
V časti 1 tejto štúdie malo 51 zo 69 (74 %) pacientov dokázateľnú klinickú odpoveď, ktorí vstúpili do časti 2. V časti 2 opätovne vzplanulo ochorenie u 6 z 25 (24 %) pacientov, ktorí zostali na liečbe etanerceptom v porovnaní s 20 z 26 (77 %) pacientov, ktorí dostávali placebo (p = 0,007). Od začiatku časti 2 bol priemerný čas do vzplanutia 116 dní u pacientov užívajúcich etanercept a 28 dní
u pacientov dostávajúcich placebo. Z pacientov s dokázateľnou klinickou odpoveďou na 90. deň, ktorí
po vstupe do časti 2 zostali na etanercepte, u niektorých pokračovalo zlepšovanie stavu od 3. do
7. mesiaca, zatiaľ čo u tých, ktorí dostávali placebo k zlepšeniu nedošlo.
V nezaslepenom predĺžení štúdie zameranom na bezpečnosť pokračovalo 58 pediatrických pacientov z vyššie uvedenej štúdie (vo veku od 4 rokov v čase zaradenia) v užívaní etanerceptu až do doby 10 rokov. Miery závažných nežiaducich udalostí a závažných infekcií sa pri dlhodobej expozícii nezvýšili.
Dlhodobá bezpečnosť monoterapie etanerceptom (n = 103), kombinácie etanercept plus metotrexát
(n = 294), alebo monoterapie metotrexátom (n = 197) sa stanovila pre obdobie do 3 rokov v registri
594 detí s juvenilnou idiopatickou artritídou vo veku od 2 do 18 rokov, z ktorých 39 bolo vo veku 2 až
3 roky. Celkovo boli infekcie hlásené častejšie u pacientov liečených etanerceptom v porovnaní so samotným metotrexátom (3,8 vs. 2 %) a infekcie súvisiace s použitím etanerceptu mali závažnejší charakter.
V ďalšej nezaslepenej štúdii s jedným ramenom bolo 60 pacientov s rozšírenou oligoartritídou
(15 pacientov vo veku 2 až 4 roky, 23 pacientov vo veku 5 až 11 rokov a 22 pacientov vo veku 12 až
17 rokov), 38 pacientov s artritídou spojenou s entezitídou (12 až 17 rokov) a 29 pacientov
s psoriatickou artritídou (12 až 17 rokov) liečených etanerceptom v dávke 0,8 mg/kg (maximálne do
50 mg v dávke) podávaným týždenne počas 12 týždňov. Pri každom z podtypov JIA splnila väčšina pacientov kritériá ACR Pedi 30 a preukázala klinické zlepšenie v sekundárnych cieľových ukazovateľoch, ako je počet citlivých kĺbov a celkové hodnotenie lekárom. Profil bezpečnosti bol zhodný s profilom pozorovaným v ďalších štúdiách JIA.
Neuskutočnili sa štúdie u pacientov s juvenilnou idiopatickou artritídou na zhodnotenie účinkov pokračujúcej liečby etanerceptom u pacientov, ktorí neodpovedajú do 3 mesiacov od začiatku liečby etanerceptom. Navyše sa neuskutočnili štúdie na zhodnotenie účinkov prerušenia alebo zníženia odporúčanej dávky etanerceptu po jeho dlhodobom používaní u pacientov s JIA.
Pediatrickí pacienti so psoriázou s plakmi
Účinnosť etanerceptu bola hodnotená v randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii u 211 pediatrických pacientov vo veku od 4 do 17 rokov so stredne závažnou až závažnou psoriázou s plakmi (definované podľa sPGA skóre ≥ 3, vrátane ≥ 10 % z BSA a PASI ≥ 12). Zaradení pacienti boli v minulosti liečení fototerapiou alebo systémovou liečbou alebo neboli dostatočne kontrolovaní topickou liečbou.
Pacienti dostávali etanercept 0,8 mg/kg (maximálne do 50 mg) alebo placebo jedenkrát týždenne po dobu 12 týždňov. V 12. týždni malo pozitívnu odpoveď účinnosti (napr. PASI 75) viac pacientov randomizovaných na etanercept ako pacientov randomizovaných na placebo.
Výsledky štúdie pediatrickej psoriázy s plakmi v 12. týždni
E
t
anercept
0,8 mg/kg jedenkrát týždenne
 (
N = 106)
Placebo
(
N = 105)
(
N = 106)
Placebo
(
N = 105)
PASI 75, n (%) 60 (57 %)a 12 (11 %) PASI 50, n (%) 79 (75 %)a 24 (23 %)
sPGA „čistý“ alebo „takmer čistý
(minimálny)“, n (%)
56 (53 %)a 14 (13 %)
Skratka: sPGA- statické globálne hodnotenie lekárom (static Physician Global Assessment)
a p < 0,0001 porovnané s placebom
Po 12. týždňovej dvojito zaslepenej fáze liečby dostávali všetci pacienti etanercept 0,8 mg/kg (maximálne do 50 mg) jedenkrát týždenne počas ďalších 24 týždňov. Odpovede pozorované počas otvorenej fázy štúdie boli podobné ako tie pozorované v dvojito zaslepenej fáze.
Počas randomizovaného vysadenia lieku sa u signifikantne väčšieho počtu pacientov
re-randomizovaných na placebo objavil relaps ochorenia (strata odpovede PASI 75) v porovnaní
s pacientmi re-randomizovanými na etanercept. Pri pokračujúcej liečbe boli odpovede udržané až do
48 týždňov.
Dlhodobá bezpečnosť a účinnosť etanerceptu v dávke 0,8 mg/kg (do 50 mg) jedenkrát týždenne sa hodnotila v otvorenej predĺženej časti štúdie u 181 pediatrických pacientov so psoriázou s plakmi, a to po 48 týždňoch spomínaných vyššie, až do 2 rokov. Dlhodobé skúsenosti s etanerceptom boli vo všeobecnosti porovnateľné s pôvodnou 48 týždňov trvajúcou štúdiou a nepreukázali žiadne nové zistenia týkajúce sa bezpečnosti.
5.2 Farmakokinetické vlastnosti
Sérové hladiny etanerceptu boli stanovené ELISA (Enzyme-Linked Immunosorbent Assay) metódou, ktorá umožňuje detekovať ELISA-reaktívne degradačné produkty, rovnako ako aj materskú látku.
Absorpcia
Etanercept sa pomaly absorbuje z miesta podania subkutánnej injekcie, maximálnu koncentráciu dosahuje približne 48 hodín po podaní jednotlivej dávky. Absolútna biologická dostupnosť je 76 %.
Pri podávaní dvakrát týždenne sa očakáva, že ustálené koncentrácie budú približne dvakrát vyššie, ako tie namerané po jednotlivých dávkach. Po subkutánnom podaní jednej 25 mg dávky etanerceptu bola priemerná maximálna koncentrácia v plazme zdravých dobrovoľníkov 1,65 ± 0,66 µg/ml a plocha pod
krivkou (AUC) bola 235 ± 96,6 µg × h/ml. Priemerné plazmatické koncentrácie u stabilizovaných liečených RA pacientov boli Cmax 2,4 mg/l vs 2,6 mg/l, Cmin 1,2 mg/l vs 1,4 mg/l a parciálne AUC
297 mg × h/l vs 316 mg × h/l pre etanercept 50 mg jedenkrát týždenne (n = 21) vs etanercept 25 mg dvakrát týždenne (n = 16). V otvorenej jednodávkovej skríženej štúdii s dvomi druhmi liečby
u zdravých dobrovoľníkov sa zistilo, že etanercept podávaný ako jedna 50 mg/ml injekcia je
bioekvivalentný dvom súčasne podaným 25 mg/ml injekciám.
V populačnej farmakokinetickej analýze u pacientov s ankylozujúcou spondylitídou boli parametre AUC rovnovážneho stavu etanerceptu 466 µg × h/ml a 474 µg × h/ml pre etanercept 50 mg jedenkrát týždenne (n = 154), respektíve 25 mg dvakrát týždenne (n = 148).
Distribúcia
Na vyjadrenie závislosti koncentrácie od času je pre etanercept potrebná biexponenciálna krivka. Stredný distribučný objem etanerceptu je 7,6 l, zatiaľ čo distribučný objem v ustálenom stave je 10,4 l.
Eliminácia
Etanercept sa z tela vylučuje pomaly. Polčas je dlhý, asi 70 hodín. Klírens je približne 0,066 l/h
u pacientov s reumatoidnou artritídou, čo je o niečo nižšia hodnota než 0,11 l/h, ktorá sa pozorovala u zdravých dobrovoľníkov. Farmakokinetika etanerceptu u pacientov s reumatoidnou artritídou, ankylozujúcou spondylitídou a psoriázou s plakmi je podobná.
Nie je nijaký zjavný rozdiel vo farmakokinetike medzi mužmi a ženami. Linearita
Dávková distribúcia nebola formálne vyhodnotená, ale v rámci dávkového rozmedzia sa nezistila
saturácia klírensu.
Osobitné skupiny pacientov
Porucha funkcie obličiek
Aj keď po podaní rádioaktívne značeného etanerceptu pacientom a dobrovoľníkom dochádza k vylučovaniu rádioaktivity močom, neboli zaznamenané zvýšené koncentrácie etanerceptu
u pacientov s akútnym renálnym zlyhaním. Porucha funkcie obličiek nevyžaduje zmenu v dávkovaní.
P
orucha funkcie pečene
U pacientov s akútnym hepatálnym zlyhaním sa nepozorovali zvýšené koncentrácie etanerceptu. Prítomnosť poruchy funckie pečene nevyžaduje zmenu v dávkovaní.
Starší ľudía
Vplyv pokročilého veku sa sledoval v populačnej farmakokinetickej analýze plazmatických hladín etanerceptu. Odhady klírensu a distribučného objemu u pacientov medzi 65 a 87 rokmi boli podobné ako u pacientov mladších ako 65 rokov.
Pediatrická populácia
Pediatrickí pacienti s juvenilnou idiopatickou artritídou
V skúšaní použitia etanerceptu pri polyartikulárnom priebehu juvenilnej idiopatickej artritídy sa
69 pacientom (vo veku 4 až 17 rokov) podával etanercept v dávke 0,4 mg/kg dvakrát týždenne počas troch mesiacov. Profily plazmatických koncentrácií boli podobné ako u dospelých pacientov
s reumatoidnou artritídou. Najmladšie deti (vo veku 4 rokov) mali redukovaný klírens (zvýšený klírens po prepočítaní na hmotnosť) v porovnaní so staršími deťmi (vo veku 12 rokov) a dospelými.
Simulácia dávkovania poukazuje na to, že kým staršie deti (vo veku 10 až 17 rokov) budú mať
plazmatické hladiny podobné dospelým, u mladších detí budú hladiny značne nižšie.
Pediatrickí pacienti so psoriázou s plakmi
Pacientom s pediatrickou psoriázou s plakmi (vo veku 4 až 17 rokov) sa podávali dávky 0,8 mg/kg
(maximálne v dávke do 50 mg na týždeň) etanerceptu jedenkrát týždenne počas doby až do
48 týždňov. Priemerná minimálna rovnovážna koncentrácia v sére bola v rozmedzí od 1,6 až 2,1 µg/ml v týždni 12, 24 a 48. Tieto priemerné koncentrácie u pacientov s pediatrickou psoriázou s plakmi boli podobné ako koncentrácie pozorované u pacientov s juvenilnou idiopatickou artritídou (liečených dávkou 0,4 mg/kg etanerceptu dvakrát týždenne, maximálne v dávke do 50 mg na týždeň). Tieto priemerné koncentrácie boli podobné tým, ktoré boli pozorované u dospelých pacientov so psoriázou
s plakmi liečených dávkou 25 mg etanerceptu dvakrát týždenne.
5.3 Predklinické údaje o bezpečnosti
V toxikologických štúdiách s etanerceptom sa nepreukázala žiadna dávku limitujúca alebo orgánovo špecifická toxicita. Na základe série in vitro a in vivo štúdií nie je etanercept považovaný za genotoxický. Štúdie karcinogenity a štandardné hodnotenia fertility a postnatálnej toxicity etanerceptu neboli uskutočnené kvôli tvorbe neutralizujúcich protilátok u hlodavcov.
Etanercept nespôsobil úmrtnosť alebo nápadné známky toxicity u myší a potkanov po podaní jednotlivej dávky 2 000 mg/kg subkutánne alebo po jednorazovej intravenóznej dávke 1 000 mg/kg. Etanercept nevyvolal dávku limitujúcu alebo orgánovo špecifickú toxicitu u opíc rodu Cynomolgus ani vtedy, ak sa im dvakrát týždenne počas 4 alebo 26 po sebe nasledujúcich týždňoch subkutánne aplikovala dávka (15 mg/kg), ktorá mala za následok 27-násobne vyššiu plazmatickú koncentráciu liečiva na základe AUC než bola dosiahnutá u ľudí pri podávaní odporúčanej dávky 25 mg.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
sacharóza chlorid sodný
monohydrát dihydrogénfosforečnanu sodného heptahydrát hydrogénfosforečnanu disodného
voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
30 mesiacov.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Naplnenú injekčnú striekačku alebo pero uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Po vybratí injekčnej striekačky alebo pera z chladničky počkajte približne 30 minút, aby sa umožnilo roztoku Benepali v injekčnej striekačke alebo v pere dosiahnuť izbovú teplotu. Nezohrievajte ho žiadnym iným spôsobom. Potom sa odporúča jeho okamžité použitie.
Benepali sa môže uchovávať pri teplote maximálne do 25 °C jedenkrát počas obdobia do 4 týždňov; po tomto období sa nemá opätovne uchovávať v chladničke. Benepali sa má zlikvidovať, ak sa nepoužije do štyroch týždňov po vybratí z chladničky.
6.5 Druh obalu a obsah balenia
50mginjekčnýroztoknaplnenývinjekčnejstriekačke
Naplnená injekčná striekačka z číreho skla (I. typu) s ihlou z nehrdzavejúcej ocele s gumeným krytom ihly a gumeným piestom obsahujúca 0,98 ml roztoku.
Benepali je dostupný v baleniach obsahujúcich 4 naplené injekčné striekačky a vo viacnásobných baleniach obsahujúcich 12 (3 balenia po 4) naplnených injekčných striekačiek. Na trh nemusia byť uvedené všetky veľkosti balenia.
50mginjekčnýroztoknaplnenývinjekčnompere
Naplnené pero obsahujúce naplnenú injekčnú striekačku Benepali. Injekčná striekačka vnútri pera je vyrobená z číreho skla I. typu s ihlou z nehrdzavejúcej ocele s kalibrom 27 s gumeným krytom ihly
a gumeným piestom.
Benepali je dostupný v baleniach obsahujúcich 4 naplené perá a vo viacnásobných baleniach obsahujúcich 12 (3 balenia po 4) naplnených pier. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
50mginjekčnýroztoknaplnenývinjekčnejstriekačke
Pred podaním injekcie sa má umožniť, aby naplnená jednorazová injekčná striekačka Benepali dosiahla izbovú teplotu (približne 30 minút). Počas tohto obdobia dosahovania izbovej teploty sa kryt ihly nemá odstrániť. Roztok má byť číry až mierne opaleskujúci, bezfarebný alebo bledožltý a môže obsahovať malé priesvitné alebo biele bielkovinové častice.
Podrobné pokyny na podanie sa nachádzajú v písomnej informácii pre používateľa, časť 7, „Pokyny na použitie“.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
50mginjekčnýroztoknaplnenývinjekčnompere
Pred podaním injekcie sa má umožniť, aby jednorazové naplnené pero Benepali dosiahlo izbovú teplotu (približne 30 minút). Počas tohto obdobia dosahovania izbovej teploty sa kryt ihly nemá
odstrániť. Pohľadom cez priehľadné kontrolné okienko má byť roztok číry až mierne opaleskujúci, bezfarebný alebo bledožltý a môže obsahovať malé priesvitné alebo biele bielkovinové častice.
Podrobné pokyny na podanie sa nachádzajú v písomnej informácii pre používateľa, časť 7, „Pokyny na použitie“.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIISamsung Bioepis UK Limited
5th floor
Profile West
950 Great West Road
Brentford
Middlesex TW8 9ES Veľká Británia
8. REGISTRAČNÉ ČÍSLOEU/1/15/1074/001
EU/1/15/1074/002
EU/1/15/1074/003
EU/1/15/1074/004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 14 január 2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.'
P
ís
o
m
ná informácia pre používateľa
B
enepali 25 mg injekčný roztok naplnený v injekčnej striekačke
etanercept
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že nahlásite akékoľvek vedľajšie účinky, ak sa u vás vyskytnú. Informácie o tom ako hlásiť vedľajšie účinky, nájdete na konci časti 4.
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Váš lekár vám tiež dá Bezpečnostnú kartu pacienta, ktorá obsahuje dôležité informácie, o ktorých musíte vedieť pred a počas liečby s Benepali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
- Tento liek bol predpísaný iba vám alebo dieťaťu vo vašej starostlivosti. Nedávajte ho nikomu inému. Môže mu uškodiť, dokonca aj vtedy, ak má rovnaké prejavy ochorenia ako vy alebo
dieťa, o ktoré sa staráte.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika.
To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:1. Čo je Benepali a na čo sa používa
2. Čo potrebujete vedieť predtým, ako použijete Benepali
3. Ako používať Benepali
4. Možné vedľajšie účinky
5. Ako uchovávať Benepali
6. Obsah balenia a ďalšie informácie
7. Pokyny na použitie (pozri druhú stranu)
1. Čo je Benepali a na čo sa používaBenepali obsahuje liečivo etanercept.
Benepali je liek, ktorý sa vyrába z dvoch ľudských bielkovín. Blokuje aktivitu inej bielkoviny v ľudskom tele, ktorá spôsobuje zápal. Benepali účinkuje zmiernením zápalu, ktorý je spojený s určitými ochoreniami.
U dospelých (vo veku 18 a viac rokov) sa môže Benepali použiť pri:
• stredne závažnej až závažnej
reumatoidnej artritíde,
•
psoriatickej artritíde,
• závažnej
axiálnej spondyloartritíde vrátane
ankylozujúcej spondylitídy,
• stredne závažnej až závažnej
psoriáze.
Vo všetkých prípadoch sa Benepali používa obvykle vtedy, keď je bežne používaná liečba nedostatočná alebo pre vás nevhodná.
Pri
reumatoidnej artritíde sa Benepali používa obvykle v kombinácii s metotrexátom, hoci sa môže použiť i samostatne, ak je pre vás liečba metotrexátom nevhodná. Či použitý samostatne alebo v kombinácii s metotrexátom, môže Benepali spomaliť poškodenie vašich kĺbov spôsobené reumatoidnou artritídou a zlepšiť vašu schopnosť vykonávať každodenné aktivity.
U pacientov so
psoriatickou artritídou s mnohopočetným postihnutím kĺbov môže Benepali zlepšiť schopnosť vykonávať každodenné aktivity.
U pacientov s mnohopočetnými symetrickými bolestivými alebo opuchnutými kĺbmi (napr. ruky, zápästia a nohy) môže Benepali spomaliť štrukturálne poškodenie týchto kĺbov zapríčinené ochorením.
Benepali sa taktiež predpisuje na liečbu nasledujúcich ochorení u detí a dospievajúcich.
• Pre tie druhy juvenilnej idiopatickej artritídy, keď liečba metotrexátom nebola dostatočne účinná alebo nie je pre nich vhodná:
• Polyartritída (s pozitívnym alebo negatívnym reumatoidným faktorom) a rozšírená oligoartritída u pacientov od 2 rokov a vážiacich 62,5 kg alebo viac.
• Psoriatická artritída u pacientov od 12 rokov a vážiacich 62,5 kg alebo viac.
• Artritída spojená s entezitídou u pacientov od 12 rokov a vážiacich 62,5 kg alebo viac, kde všeobecne používaná liečba nebola dostatočne účinná alebo nebola pre nich vhodná.
• Závažná psoriáza u pacientov vo veku od 6 rokov a vážiacich 62,5 kg alebo viac, ktorí nedostatočne odpovedali na fototerapiu (alebo ju nemôžu používať) alebo inú systémovú liečbu.
2. Čo potrebujete vedieť predtým, ako použijete Benepali
Nepoužívajte Benepali
• ak ste vy alebo dieťa vo vašej starostlivosti alergický na etanercept alebo na ktorúkoľvek z ďalších zložiek Benepali (uvedených v časti 6). Ak máte vy alebo dieťa alergické reakcie, akými sú pocit zovretia hrudníka, dýchavica – “pískanie”, závraty alebo vyrážku, nepodávajte si ďalšie injekcie Benepali a okamžite kontaktujte vášho lekára.
• ak vy alebo dieťa máte alebo ste ohrozený rozvojom závažnej infekcie krvi nazývanej sepsa.
Ak si nie ste istý, kontaktujte, prosím, svojho lekára.
• ak máte vy alebo dieťa akúkoľvek infekciu. Ak si nie ste istý, obráťte sa, prosím, na svojho lekára.
Upozornenia a opatrenia
Predtým, ako začnete používať Benepali, obráťte sa na svojho lekára.
• Alergická reakcia: Keď sa u vás alebo u dieťaťa prejaví alergická reakcia ako je pocit zovretia hrudníka, dýchavica – “pískanie”, závrat alebo vyrážka, nepodávajte si viac Benepali a kontaktujte okamžite svojho lekára.
• Infekcie/chirurgický výkon: Keď sa u vás alebo dieťaťa rozvíja nová infekcia alebo sa vy alebo dieťa chystáte na nejaký väčší chirurgický zákrok, váš lekár možno bude chcieť sledovať liečbu s Benepali.
• Infekcie/diabetes: Informujte svojho lekára, ak ste vy alebo dieťa mali v minulosti opakované infekcie alebo trpíte diabetom alebo existujú iné okolnosti, ktoré zvyšujú riziko infekcie.
• Infekcie/sledovanie: Informujte vášho lekára o každej nedávnej ceste mimo Európy. Ak sa u vás alebo dieťaťa vyvinú symptómy infekcie ako horúčka, triaška alebo kašeľ, oznámte to okamžite vášmu lekárovi. Váš lekár sa môže rozhodnúť pokračovať v sledovaní vás alebo dieťaťa kvôli príznakom infekcie potom, ak ste prestali používať Benepali.
• Tuberkulóza: Nakoľko u pacientov liečených s Benepali boli hlásené prípady tuberkulózy, váš lekár skontroluje prejavy a symptómy tuberkulózy pred začatím liečby s Benepali. To môže zahŕňať podrobnú anamnézu, RTG hrudníka a tuberkulínový test. Vykonanie týchto testov má byť zaznamenané do Bezpečnostnej karty pacienta. Je veľmi dôležité, aby ste povedali lekárovi, či ste niekedy vy alebo dieťa mali tuberkulózu alebo či ste boli v blízkom kontakte s niekým,
kto mal tuberkulózu. Ak sa počas liečby alebo po liečbe objavia symptómy tuberkulózy (ako
pretrvávajúci kašeľ, strata hmotnosti, vysilenosť, mierne zvýšená teplota) alebo inej infekcie, okamžite to oznámte lekárovi.
• Hepatitída B: Povedzte vášmu lekárovi, že vy alebo dieťa máte alebo ste v minulosti mali hepatitídu B. Váš lekár má vykonať test na prítomnosť infekcie hepatitídou B predtým, ako vy alebo dieťa začnete liečbu s Benepali. Liečba s Benepali môže viesť k reaktivácii hepatitídy B u pacientov, ktorí boli predtým infikovaní vírusom hepatitídy B. Ak sa to stane, mali by ste prerušiť používanie Benepali.
• Hepatitída C: Povedzte vášmu lekárovi, ak vy alebo dieťa máte hepatitídu C. Váš lekár možno bude chcieť sledovať liečbu s Benepali v prípade, ak sa infekcia zhorší.
• Poruchy krvi: Ihneď vyhľadajte lekára, ak máte vy alebo dieťa akýkoľvek prejav alebo symptóm ako pretrvávajúca horúčka, bolesť hrdla, krvné podliatiny, krvácanie alebo bledosť. Tieto symptómy môžu poukazovať na existenciu potenciálne život ohrozujúcej poruchy krvi, ktorá si môže vyžadovať vysadenie Benepali.
• Nervový systém a poruchy očí: Keď máte vy alebo dieťa sclerosis multiplex, neuritis n. optici (zápal zrakového nervu) alebo tranzverzálnu myelitídu (zápal miechy), oznámte to svojmu lekárovi. Váš lekár rozhodne, či je liečba s Benepali vhodná.
• Kongestívne zlyhanie srdca: Informujte svojho lekára, ak ste vy alebo dieťa mali v minulosti kongestívne zlyhanie srdca, pretože za týchto okolností sa Benepali musí používať s opatrnosťou.
• Rakovina: Povedzte svojmu lekárovi, ak máte alebo ste niekedy mali lymfóm (typ krvného zhubného nádoru) alebo akýkoľvek iný zhubný nádor predtým, ako dostanete Benepali. Pacienti so závažnou reumatoidnou artritídou, ktorí trpia ochorením dlhšiu dobu, môžu mať riziko pre vznik lymfómu vyššie ako je priemer. Deti a dospelí, ktorí užívajú Benepali môžu mať vyššie riziko lymfómu alebo iného zhubného nádoru (rakoviny). U niektorých detských alebo dospievajúcich pacientov, ktorí dostávali etanercept alebo lieky s podobným mechanizmom účinku ako etanercept, sa vyvinuli zhubné nádory vrátane neobvyklých typov, ktoré niekedy viedli k smrti. U niektorých pacientov užívajúcich Benepali sa objavila rakovina kože. Povedzte vášmu lekárovi, ak sa u vás alebo dieťaťa objaví akákoľvek zmena vzhľadu kože alebo výrastky na koži.
• Kiahne: Ak ste vy alebo dieťa vystavený nákaze kiahní pri používaní Benepali, oznámte to lekárovi. Váš lekár rozhodne, či je vhodná preventívna liečba kiahní.
• Alkoholová závislosť: Benepali sa nemá používať na liečbu hepatitídy, ktorá bola vyvolaná závislosťou na alkohole. Povedzte vášmu lekárovi, ak ste vy alebo dieťa vo vašej starostlivosti v minulosti mali problém s nadmerným užívaním alkoholu.
• Wegenerova granulomatóza: Benepali sa neodporúča používať na liečbu Wegenerovej granulomatózy, zriedkavého zápalového ochorenia. Ak vy alebo dieťa vo vašej starostlivosti máte Wegenerovu granulomatózu, povedzte to vášmu lekárovi.
• Antidiabetické lieky (lieky na liečbu cukrovky): Povedzte vášmu lekárovi, že vy alebo dieťa máte cukrovku alebo užívate lieky na liečbu cukrovky. Váš lekár môže rozhodnúť, či vy alebo dieťa potrebujete menej antidiabetických liekov, pokiaľ používate Benepali.
• Očkovanie: Niektoré očkovacie látky, akou je napríklad perorálna polio vakcína sa nemajú podávať počas liečby s Benepali. Skôr než vy alebo dieťa dostanete akúkoľvek vakcínu, poraďte sa s lekárom.
Deti a dospievajúci
Benepali nie je indikovaný na použitie u detí a dospievajúcich vážiacich menej ako 62,5 kg.
• Očkovanie: Ak je to možné, u detí sa majú vykonať všetky očkovania predpísané pre daný vek, pred začatím užívania Benepali. Niektoré očkovacie látky, akou je napríklad perorálna polio vakcína sa nemajú podávať počas užívania Benepali. Skôr než vy alebo dieťa dostane akúkoľvek vakcínu, poraďte sa s lekárom.
• Zápalové črevné ochorenia (inflammatory bowel disease = IBD): U pacientov s juvenilnou idiopatickou artritídou (JIA) liečených etanerceptom sa pozorovali prípady IBD. Povedzte lekárovi, ak sa u dieťaťa objavia akékoľvek kŕče alebo bolesť brucha, hnačka, úbytok hmotnosti alebo krv v stolici.
Vo všeobecnosti sa Benepali nemá používať u detí s polyartritídou alebo rozšírenou oligoartritídou mladších ako 2 roky alebo vážiacich menej ako 62,5 kg, alebo u detí s artritídou spojenou s entezitídou alebo psoriatickou artritídou mladších ako 12 rokov alebo vážiacich menej ako 62,5 kg, alebo u detí
s psoriázou mladších ako 6 rokov alebo vážiacich menej ako 62,5 kg.
Iné lieky a Benepali
Ak teraz vy alebo dieťa užívate alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky (vrátane sulfasalazínu), aj tie, ktoré vám nepredpísal lekár, povedzte to svojmu lekárovi alebo lekárnikovi.
Vy alebo dieťa nemáte používať Benepali s liekmi, ktoré obsahujú ako liečivo anakinru alebo abatacept.
Tehotenstvo a dojčenie
Ženám v reprodukčnom veku sa má odporučiť používať vhodnú antikoncepciu, aby sa zabránilo
otehotneniu počas liečby s Benepali a počas troch týždňov po ukončení liečby.
Použitie Benepali sa počas tehotenstva neodporúča. Ak ste tehotn á alebo dojčíte, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom predtým, ako začnete používať tento liek.
Ak ste dostávali Benepali počas tehotenstva, váš novorodenec môže byť vystavený vyššiemu riziku vzniku infekcie. Navyše, jedna štúdia zistila viac vrodených chýb, keď matka dostávala etanercept počas tehotenstva v porovnaní s matkami, ktoré nedostávali etanercept alebo iné podobné lieky (TNF- antagonisty), ale žiadne konkrétne formy vrodených chýb sa nehlásili. Je dôležité, aby ste lekárov novorodenca a ďalších zdravotníckych pracovníkov informovali o používaní Benepali počas tehotenstva predtým, ako novorodenec dostane akúkoľvek vakcínu (ďalšie informácie, pozri časť 2
„Očkovanie“).
Ženy používajúce Benepali nemajú dojčiť, pretože Benepali sa vylučuje do materského mlieka.
Vedenie vozidiel a obsluha strojov
Nie sú dostupné informácie o tom, či používanie Benepali ovplyvňuje schopnosť viesť vozidlo alebo
obsluhovať stroje.
Benepali obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v dávke, t.j. v podstate zanedbateľné množstvo sodíka.
3. Ako používať Benepali
Vždy používajte tento liek presne tak, ako vám povedal váš lekár. Ak si nie ste niečím istý, overte si to u svojho lekára alebo lekárnika.
Ak máte pocit, že je účinok Benepali príliš silný alebo veľmi slabý, povedzte to svojmu lekárovi alebo lekárnikovi.
Použitie u dospelých pacientov (vo veku 18 a viac rokov)
Reumatoidnáartritída,psoriatickáartritídaaaxiálnaspondyloartritídavrátaneankylozujúcej
spondylitídy
Zvyčajná dávka je 25 mg dvakrát týždenne alebo 50 mg jedenkrát týždenne podávaná ako injekcia pod kožu.
Avšak váš lekár môže stanoviť alternatívnu frekvenciu podávania Benepali.
Psoriázasplakmi
Alternatívne možno podávať 50 mg dvakrát týždenne až do 12 týždňov, následne dávky 25 mg dvakrát týždenne alebo 50 mg jedenkrát týždenne.
Váš lekár na základe vašej odpovede rozhodne, ako dlho máte používať Benepali a či je potrebná opakovaná liečba. Ak Benepali po 12 týždňoch nemá účinok na váš stav, váš lekár vám môže povedať, aby ste prestali používať tento liek.
Použitie u detí a dospievajúcich
Dávka a frekvencia podávania pre dieťa alebo dospievajúceho bude závisieť od telesnej hmotnosti
a ochorenia. Váš lekár určí správnu dávku pre dieťa a predpíše primeranú silu etanerceptu. Pediatrickým pacientom vážiacim 62,5 kg alebo viac sa môže podávať dávka 25 mg dvakrát týždenne alebo 50 mg jedenkrát týždenne použitím fixnej dávky formou naplnenej injekčnej striekačky alebo naplneného pera.
Sú dostupné iné lieky obsahujúce etanercept s formou dávkovania vhodnou pre deti.
Zvyčajná dávka pri polyartritíde alebo rozšírenej oligoartritíde u pacientov od 2 rokov a vážiacich
62,5 kg alebo viac, alebo artritíde spojenej s entezitídou alebo psoriatickej artritíde u pacientov od
12 rokov a vážiacich 62,5 kg alebo viac, je 25 mg podávaných dvakrát týždenne alebo 50 mg podávaných jedenkrát týždenne.
Zvyčajná dávka pri psoriáze u pacientov vo veku od 6 rokov a vážiacich 62,5 kg alebo viac je 50 mg
a má sa podávať jedenkrát týždenne. Ak Benepali nemá po 12 týždňoch na stav dieťaťa žiaden účinok, váš lekár vám môže povedať, aby ste prestali používať tento liek.
Lekár vám poskytne podrobné pokyny na prípravu a odmeranie primeranej dávky.
Spôsob a cesta podávania
Benepali sa podáva injekčne pod kožu (subkutánne použitie).
Podrobné pokyny na podanie Benepali sa nachádza v časti 7 „Pokyny na použitie”. Roztok
Benepali sa nesmie miešať so žiadnym iným liekom.
Aby ste nezabudli, zapíšte si do zápisníka, v ktorých dňoch v týždni máte Benepali používať.
Ak použijete viac Benepali, ako máte
Ak ste použili viac Benepali, ako máte (buď podaním väčšieho množstva pri jednej príležitosti alebo
príliš častým používaním), okamžite to povedzte lekárovi alebo lekárnikovi. Vždy majte pri sebe vonkajší obal lieku, aj keď je prázdny.
Ak si zabudnete podať Benepali
Ak zabudnete na injekciu, podajte ju hneď, ako si na to spomeniete, pokiaľ nemáte nasledujúci deň
dostať ďalšiu dávku, v tom prípade nepodávajte vynechanú dávku. Potom pokračujte v podávaní lieku v obvyklých dňoch. Ak si spomeniete na vynechanú dávku až v deň, kedy máte dostať ďalšiu dávku,
nepoužívajte dvojnásobnú dávku (dve dávky v jeden deň), aby ste nahradili vynechanú dávku.
Ak prestanete používať Benepali
Vaše príznaky sa po prerušení môžu vrátiť.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo lekárnika.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
Alergické reakcie
Ak sa stane čokoľvek z nasledujúceho, nepodávajte viac Benepali. Okamžite to oznámte lekárovi
alebo navštívte pohotovosť v najbližšej nemocnici.
• Problémy pri prehĺtaní alebo dýchaní,
• opuch tváre, krku, dlaní alebo chodidiel,
• pocit nervozity alebo úzkosti, pocity chvenia, náhle začervenanie kože a/alebo návaly tepla,
• závažná vyrážka, svrbenie alebo žihľavka (vyvýšené fliačky červenej alebo bledej kože, ktoré často svrbia).
Závažné alergické reakcie sú zriedkavé. Avšak, ktorýkoľvek z vyššie uvedených symptómov môže indikovať alergickú reakciu na Benepali, preto okamžite vyhľadajte lekársku pomoc.
Závažné vedľajšie účinky
Ak spozorujete čokoľvek z nasledujúceho, vy alebo dieťa možno budete potrebovať okamžitú lekársku
pomoc.
• Príznaky závažnej infekcie (vrátane zápalu pľúc, hlbokých infekcií kože, infekcií kĺbov
a infekcie krvi) ako vysoká horúčka, ktorá môže byť spojená s kašľom, ťažkosťami pri dýchaní, zimnicou, slabosťou alebo horúca, červená, citlivá, bolestivá oblasť na koži alebo kĺboch,
• príznaky poruchy krvi ako krvácanie, vznik modriny alebo bledosť,
• príznaky poruchy nervového systému ako znecitlivenie alebo brnenie, zmeny zraku, bolesť očí alebo vznik slabosti v ruke alebo nohe,
• príznaky zlyhania srdca alebo zhoršenia zlyhania srdca ako slabosť alebo ťažkosti pri dýchaní počas aktivity, opuch členkov, pocit plnosti v krku alebo bruchu, ťažkosti pri dýchaní alebo kašeľ v noci, namodralá farba nechtov alebo pier,
• príznaky zhubných nádorových ochorení: zhubné nádorové ochorenia môžu postihnúť ktorúkoľvek časť tela vrátane kože a krvi a možné príznaky budú závisieť od druhu a miesta výskytu zhubného nádorového ochorenia. Medzi tieto príznaky môže patriť úbytok hmotnosti, horúčka, opuch (s bolesťou alebo bez nej), pretrvávajúci kašeľ, prítomnosť hrčiek alebo výrastkov na koži,
• príznaky autoimunitných reakcií (kde sa vytvárajú protilátky, ktoré môžu poškodiť zdravé tkanivá), napr. bolesť, svrbenie, slabosť a abnormálne dýchanie, myslenie, pocity alebo videnie,
• príznaky lupusu alebo syndrómu podobného lupusu ako zmeny hmotnosti, pretrvávajúca vyrážka, horúčka, bolesť kĺbov alebo svalov alebo únava,
• príznaky zápalu krvných ciev ako je bolesť, horúčka, začervenanie alebo zvýšenie teploty kože alebo svrbenie.
Tieto sú zriedkavé alebo menej časté vedľajšie účinky, ale závažné stavy (niektoré z nich môžu zriedkavo byť fatálne). Ak sa vyskytne niektorý z vyššie uvedených príznakov, okamžite to oznámte lekárovi alebo navštívte pohotovosť v najbližšej nemocnici.
Nižšie sú uvedené známe vedľajšie účinky Benepali v skupinách so znižujúcou sa frekvenciou:
• Veľmi časté (môžu postihovať viac ako 1 z 10 ľudí):
Infekcie (vrátane nádchy, sínusitídy, bronchitídy, infekcií močového traktu a infekcií kože);
reakcie v mieste podania injekcie (vrátane krvácania, vzniku modriny, začervenania, svrbenia, bolesti a opuchu).
Reakcie v mieste podania injekcie (tie sa po prvom mesiaci liečby nevyskytujú tak často).
U niektorých pacientov sa vyskytla reakcia v mieste predchádzajúceho podania injekcie.
• Časté (môžu postihovať menej ako 1 z 10 ľudí):
Alergické reakcie; horúčka; svrbenie; protilátky proti normálnym tkanivám (vznik autoprotilátok).
•
Menej časté (môžu postihovať menej ako 1 zo 100 ľudí):
Nízky počet krvných doštičiek; rakovina kože (okrem melanómov); lokalizovaný opuch kože
(angioedém); žihľavka (vyvýšené fliačky červenej alebo bledej kože, ktoré často svrbia); zápaly očí; psoriáza (nová alebo jej zhoršenie); vyrážka; zápal alebo trvalé poškodenie pľúc s tvorbou
jaziev; zápal krvných ciev postihujúci rozličné orgány; zvýšené hodnoty pečeňových testov
(u pacientov, ktorí tiež dostávajú liečbu metotrexátom, je frekvencia zvýšených pečeňových testov častá).
•
Zriedkavé (môžu postihovať menej ako 1 z 1 000 ľudí):
Závažné alergické reakcie (vrátane závažného lokalizovaného opuchu kože a dýchavice -
„pískania“); lymfóm (typ krvného zhubného nádoru); melanóm (typ rakoviny kože); kombinovaný nízky počet krvných doštičiek, červených a bielych krviniek; poruchy nervového systému (so závažnou svalovou slabosťou a príznakmi a symptómami podobnými skleróze multiplex alebo zápalu očných nervov alebo zápalu miechy); tuberkulóza; kongestívne zlyhanie srdca; záchvaty; lupus alebo syndróm podobný lupusu (symptómy môžu zahŕňať pretrvávajúcu vyrážku, horúčku, bolesť kĺbov a únavu); nízky počet červených krviniek, nízky počet bielych krviniek, nízky počet neutrofilov (typ bielych krviniek); kožná vyrážka, ktorá môže viesť k mnohým pľuzgierom a olupovaniu kože; zápal pečene vyvolaný poruchou vlastného imunitného systému (autoimunitná hepatitída); imunitné ochorenie, ktoré môže postihnúť pľúca, kožu a lymfatické uzliny (sarkoidóza); oportúnne infekcie (infekcie vyskytujúce sa z dôvodu
oslabeného imunitného systému).
•
Veľmi zriedkavé (môžu postihovať menej ako 1 z 10 000 ľudí):
Zlyhanie kostnej drene produkovať kľúčové krvinky; poškodenie nervov, vrátane Guillainov- Barrého syndrómu (závažného ochorenia, ktoré môže postihnúť dýchanie a poškodiť telesné orgány); toxická epidermálna nekrolýza (život ohrozujúce ochorenie kože).
•
Neznáme (frekvenciu nie je možné určiť z dostupných údajov):
Leukémia (rakovina postihujúca krv a kostnú dreň); karcinóm z Merkelových buniek (typ rakoviny kože); nadmerná aktivácia bielych krviniek v súvislosti so zápalom (syndróm aktivácie makrofágov), opätovný výskyt hepatitídy B (infekcia pečene); zhoršenie ochorenia nazývaného dermatomyozitída (zápal svalov a slabosť sprevádzaná kožnou vyrážkou); Listeria (bakteriálna infekcia).
Vedľajšie účinky u detí a dospievajúcichVedľajšie účinky a ich frekvencie pozorované u detí a dospievajúcich sú podobné vyššie opísaným vedľajším účinkom.
Hlásenie vedľajších účinkovAk sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa

týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať BenepaliTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na škatuli a na štítku naplnenej injekčnej striekačky po „EXP“. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Naplnenú injekčnú striekačku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Po vybratí injekčnej striekačky z chladničky počkajte približne 30 minút, aby sa umožnilo roztoku Benepali v naplnenej injekčnej striekačke dosiahnuť izbovú teplotu. Nezohrievajte ho žiadnym iným spôsobom. Potom sa odporúča jeho okamžité použitie.
Benepali môžete uchovávať mimo chladničky pri teplote maximálne do 25 °C jedenkrát počas obdobia do 4 týždňov; po tomto období sa nemá opätovne uchovávať v chladničke. Benepali sa má zlikvidovať, ak sa nepoužije do štyroch týždňov po vybratí z chladničky. Odporúča sa, aby ste si zaznamenali
dátum, kedy ste Benepali vybrali z chladničky a dátum, po ktorom sa má Benepali zlikvidovať (nie viac ako 4 týždne po vybratí z chladničky).
Skontrolujte roztok v injekčnej striekačke. Má byť číry až mierne opaleskujúci, bezfarebný až bledožltý a môže obsahovať malé biele alebo takmer priesvitné bielkovinové častice. Tento vzhľad je pri Benepali normálny. Roztok nepoužívajte ak je zafarbený, zakalený alebo ak sú prítomné častice, ktoré sa líšia od častíc opísaných vyššie. Ak máte obavu týkajúcu sa vzhľadu roztoku, potom kontaktujte svojho lekárnika.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Čo Benepali obsahuje
- Liečivo je etanercept. Každá naplnená injekčná striekačka obsahuje 25 mg etanerceptu.
- Ďalšie zložky sú sacharóza, chlorid sodný, monohydrát dihydrogénfosforečnanu sodného, heptahydrát hydrogénfosforečnanu disodného a voda na injekciu.
Ako vyzerá Benepali a obsah balenia
Benepali sa dodáva ako naplnená injekčná striekačka obsahujúca číry až mierne opaleskujúci,
bezfarebný až bledožltý injekčný roztok (injekcia).
Benepali je dostupný v baleniach obsahujúcich 4 naplené injekčné striekačky, viacnásobných baleniach obsahujúcich 2 krabice, z ktorých každá obsahuje 4 naplené injekčné striekačky a viacnásobných baleniach obsahujúcich 6 krabíc, z ktorých každá obsahuje 4 naplnené injekčné striekačky. Na trh nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutia o registrácii
Samsung Bioepis UK Limited
5th floor
Profile West
950 Great West Road
Brentford
Middlesex TW8 9ES Veľká Británia
Výrobca
Biogen (Denmark) Manufacturing ApS
Biogen Allé 1
3400 Hillerød
Dánsko
P
ís
o
m
ná informácia pre používateľa
B
enepali 50 mg injekčný roztok naplnený v injekčnej striekačke
etanercept
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že nahlásite akékoľvek vedľajšie účinky, ak sa u vás vyskytnú. Informácie o tom ako hlásiť vedľajšie účinky, nájdete na konci časti 4.
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Váš lekár vám tiež dá Bezpečnostnú kartu pacienta, ktorá obsahuje dôležité informácie, o ktorých musíte vedieť pred a počas liečby s Benepali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
- Tento liek bol predpísaný iba vám alebo dieťaťu vo vašej starostlivosti. Nedávajte ho nikomu inému. Môže mu uškodiť, dokonca aj vtedy, ak má rovnaké prejavy ochorenia ako vy alebo dieťa, o ktoré sa staráte.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika.
To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:1. Čo je Benepali a na čo sa používa
2. Čo potrebujete vedieť predtým, ako použijete Benepali
3. Ako používať Benepali
4. Možné vedľajšie účinky
5. Ako uchovávať Benepali
6. Obsah balenia a ďalšie informácie
7. Pokyny na použitie (pozri druhú stranu)
1. Čo je Benepali a na čo sa používaBenepali obsahuje liečivo etanercept.
Benepali je liek, ktorý sa vyrába z dvoch ľudských bielkovín. Blokuje aktivitu inej bielkoviny v ľudskom tele, ktorá spôsobuje zápal. Benepali účinkuje zmiernením zápalu, ktorý je spojený s určitými ochoreniami.
U dospelých (vo veku 18 a viac rokov) sa môže Benepali použiť pri:
• stredne závažnej až závažnej
reumatoidnej artritíde,
•
psoriatickej artritíde,
• závažnej
axiálnej spondyloartritíde vrátane
ankylozujúcej spondylitídy,
• stredne závažnej až závažnej
psoriáze.
Vo všetkých prípadoch sa Benepali používa obvykle vtedy, keď je bežne používaná liečba nedostatočná alebo pre vás nevhodná.
Pri
reumatoidnej artritíde sa Benepali používa obvykle v kombinácii s metotrexátom, hoci sa môže použiť i samostatne, ak je pre vás liečba metotrexátom nevhodná. Či použitý samostatne alebo v kombinácii s metotrexátom, môže Benepali spomaliť poškodenie vašich kĺbov spôsobené reumatoidnou artritídou a zlepšiť vašu schopnosť vykonávať každodenné aktivity.
U pacientov so psoriatickou artritídou s mnohopočetným postihnutím kĺbov môže Benepali zlepšiť schopnosť vykonávať každodenné aktivity.
U pacientov s mnohopočetnými symetrickými bolestivými alebo opuchnutými kĺbmi (napr. ruky, zápästia a nohy) môže Benepali spomaliť štrukturálne poškodenie týchto kĺbov zapríčinené ochorením.
Benepali sa taktiež predpisuje na liečbu nasledujúcich ochorení u detí a dospievajúcich.
• Pre tie druhy juvenilnej idiopatickej artritídy, keď liečba metotrexátom nebola dostatočne účinná alebo nie je pre nich vhodná:
• Polyartritída (s pozitívnym alebo negatívnym reumatoidným faktorom) a rozšírená oligoartritída u pacientov od 2 rokov a vážiacich 62,5 kg alebo viac.
• Psoriatická artritída u pacientov od 12 rokov a vážiacich 62,5 kg alebo viac.
• Artritída spojená s entezitídou u pacientov od 12 rokov a vážiacich 62,5 kg alebo viac, kde všeobecne používaná liečba nebola dostatočne účinná alebo nebola pre nich vhodná.
• Závažná psoriáza u pacientov vo veku od 6 rokov a vážiacich 62,5 kg alebo viac, ktorí nedostatočne odpovedali na fototerapiu (alebo ju nemôžu používať) alebo inú systémovú liečbu.
2. Čo potrebujete vedieť predtým, ako použijete Benepali
Nepoužívajte Benepali
• ak ste vy alebo dieťa vo vašej starostlivosti alergický na etanercept alebo na ktorúkoľvek z ďalších zložiek Benepali (uvedených v časti 6). Ak máte vy alebo dieťa alergické reakcie, akými sú pocit zovretia hrudníka, dýchavica – “pískanie”, závraty alebo vyrážku, nepodávajte si ďalšie injekcie Benepali a okamžite kontaktujte vášho lekára.
• ak vy alebo dieťa máte alebo ste ohrozený rozvojom závažnej infekcie krvi nazývanej sepsa.
Ak si nie ste istý, kontaktujte, prosím, svojho lekára.
• ak máte vy alebo dieťa akúkoľvek infekciu. Ak si nie ste istý, obráťte sa, prosím, na svojho lekára.
Upozornenia a opatrenia
Predtým, ako začnete používať Benepali, obráťte sa na svojho lekára.
• Alergická reakcia: Keď sa u vás alebo u dieťaťa prejaví alergická reakcia ako je pocit zovretia hrudníka, dýchavica – “pískanie”, závrat alebo vyrážka, nepodávajte si viac Benepali a kontaktujte okamžite svojho lekára.
• Infekcie/chirurgický výkon: Keď sa u vás alebo dieťaťa rozvíja nová infekcia alebo sa vy alebo dieťa chystáte na nejaký väčší chirurgický zákrok, váš lekár možno bude chcieť sledovať liečbu s Benepali.
• Infekcie/diabetes: Informujte svojho lekára, ak ste vy alebo dieťa mali v minulosti opakované infekcie alebo trpíte diabetom alebo existujú iné okolnosti, ktoré zvyšujú riziko infekcie.
• Infekcie/sledovanie: Informujte vášho lekára o každej nedávnej ceste mimo Európy. Ak sa u vás alebo dieťaťa vyvinú symptómy infekcie ako horúčka, triaška alebo kašeľ, oznámte to okamžite vášmu lekárovi. Váš lekár sa môže rozhodnúť pokračovať v sledovaní vás alebo dieťaťa kvôli príznakom infekcie potom, ak ste prestali používať Benepali.
• Tuberkulóza: Nakoľko u pacientov liečených s Benepali boli hlásené prípady tuberkulózy, váš lekár skontroluje prejavy a symptómy tuberkulózy pred začatím liečby s Benepali. To môže zahŕňať podrobnú anamnézu, RTG hrudníka a tuberkulínový test. Vykonanie týchto testov má byť zaznamenané do Bezpečnostnej karty pacienta. Je veľmi dôležité, aby ste povedali lekárovi, či ste niekedy vy alebo dieťa mali tuberkulózu alebo či ste boli v blízkom kontakte s niekým,
kto mal tuberkulózu. Ak sa počas liečby alebo po liečbe objavia symptómy tuberkulózy (ako pretrvávajúci kašeľ, strata hmotnosti, vysilenosť, mierne zvýšená teplota) alebo inej infekcie, okamžite to oznámte lekárovi.
• Hepatitída B: Povedzte vášmu lekárovi, že vy alebo dieťa máte alebo ste v minulosti mali hepatitídu B. Váš lekár má vykonať test na prítomnosť infekcie hepatitídou B predtým, ako vy alebo dieťa začnete liečbu s Benepali. Liečba s Benepali môže viesť k reaktivácii hepatitídy B u pacientov, ktorí boli predtým infikovaní vírusom hepatitídy B. Ak sa to stane, mali by ste prerušiť používanie Benepali.
• Hepatitída C: Povedzte vášmu lekárovi, ak vy alebo dieťa máte hepatitídu C. Váš lekár možno bude chcieť sledovať liečbu s Benepali v prípade, ak sa infekcia zhorší.
• Poruchy krvi: Ihneď vyhľadajte lekára, ak máte vy alebo dieťa akýkoľvek prejav alebo symptóm ako pretrvávajúca horúčka, bolesť hrdla, krvné podliatiny, krvácanie alebo bledosť. Tieto symptómy môžu poukazovať na existenciu potenciálne život ohrozujúcej poruchy krvi, ktorá si môže vyžadovať vysadenie Benepali.
• Nervový systém a poruchy očí: Keď máte vy alebo dieťa sclerosis multiplex, neuritis n. optici (zápal zrakového nervu) alebo tranzverzálnu myelitídu (zápal miechy), oznámte to svojmu lekárovi. Váš lekár rozhodne, či je liečba s Benepali vhodná.
• Kongestívne zlyhanie srdca: Informujte svojho lekára, ak ste vy alebo dieťa mali v minulosti kongestívne zlyhanie srdca, pretože za týchto okolností sa Benepali musí používať s opatrnosťou.
• Rakovina: Povedzte svojmu lekárovi, ak máte alebo ste niekedy mali lymfóm (typ krvného zhubného nádoru) alebo akýkoľvek iný zhubný nádor predtým, ako dostanete Benepali. Pacienti so závažnou reumatoidnou artritídou, ktorí trpia ochorením dlhšiu dobu, môžu mať riziko pre vznik lymfómu vyššie ako je priemer. Deti a dospelí, ktorí užívajú Benepali môžu mať vyššie riziko lymfómu alebo iného zhubného nádoru (rakoviny). U niektorých detských alebo dospievajúcich pacientov, ktorí dostávali etanercept alebo lieky s podobným mechanizmom účinku ako etanercept, sa vyvinuli zhubné nádory vrátane neobvyklých typov, ktoré niekedy viedli k smrti. U niektorých pacientov užívajúcich Benepali sa objavila rakovina kože. Povedzte vášmu lekárovi, ak sa u vás alebo dieťaťa objaví akákoľvek zmena vzhľadu kože alebo výrastky na koži.
• Kiahne: Ak ste vy alebo dieťa vystavený nákaze kiahní pri používaní Benepali, oznámte to lekárovi. Váš lekár rozhodne, či je vhodná preventívna liečba kiahní.
• Alkoholová závislosť: Benepali sa nemá používať na liečbu hepatitídy, ktorá bola vyvolaná závislosťou na alkohole. Povedzte vášmu lekárovi, ak ste vy alebo dieťa vo vašej starostlivosti v minulosti mali problém s nadmerným užívaním alkoholu.
• Wegenerova granulomatóza: Benepali sa neodporúča používať na liečbu Wegenerovej granulomatózy, zriedkavého zápalového ochorenia. Ak vy alebo dieťa vo vašej starostlivosti máte Wegenerovu granulomatózu, povedzte to vášmu lekárovi.
• Antidiabetické lieky (lieky na liečbu cukrovky): Povedzte vášmu lekárovi, že vy alebo dieťa máte cukrovku alebo užívate lieky na liečbu cukrovky. Váš lekár môže rozhodnúť, či vy alebo dieťa potrebujete menej antidiabetických liekov, pokiaľ používate Benepali.
• Očkovanie: Niektoré očkovacie látky, akou je napríklad perorálna polio vakcína sa nemajú podávať počas liečby s Benepali. Skôr než vy alebo dieťa dostanete akúkoľvek vakcínu, poraďte sa s lekárom.
Deti a dospievajúci
Benepali nie je indikovaný na použitie u detí a dospievajúcich vážiacich menej ako 62,5 kg.
• Očkovanie: Ak je to možné, u detí sa majú vykonať všetky očkovania predpísané pre daný vek, pred začatím užívania Benepali. Niektoré očkovacie látky, akou je napríklad perorálna polio vakcína sa nemajú podávať počas užívania Benepali. Skôr než vy alebo dieťa dostane akúkoľvek vakcínu, poraďte sa s lekárom.
• Zápalové črevné ochorenia (inflammatory bowel disease = IBD): U pacientov s juvenilnou idiopatickou artritídou (JIA) liečených etanerceptom sa pozorovali prípady IBD. Povedzte lekárovi, ak sa u dieťaťa objavia akékoľvek kŕče alebo bolesť brucha, hnačka, úbytok hmotnosti alebo krv v stolici.
Vo všeobecnosti sa Benepali nemá používať u detí s polyartritídou alebo rozšírenou oligoartritídou mladších ako 2 roky alebo vážiacich menej ako 62,5 kg, alebo u detí s artritídou spojenou s entezitídou alebo psoriatickou artritídou mladších ako 12 rokov alebo vážiacich menej ako 62,5 kg, alebo u detí
s psoriázou mladších ako 6 rokov alebo vážiacich menej ako 62,5 kg.
Iné lieky a Benepali
Ak teraz vy alebo dieťa užívate alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky
(vrátane sulfasalazínu), aj tie, ktoré vám nepredpísal lekár, povedzte to svojmu lekárovi alebo lekárnikovi.
Vy alebo dieťa nemáte používať Benepali s liekmi, ktoré obsahujú ako liečivo anakinru alebo abatacept.
Tehotenstvo a dojčenie
Ženám v reprodukčnom veku sa má odporučiť používať vhodnú antikoncepciu, aby sa zabránilo
otehotneniu počas liečby s Benepali a počas troch týždňov po ukončení liečby.
Použitie Benepali sa počas tehotenstva neodporúča. Ak ste tehotná alebo dojčíte, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom predtým, ako začnete používať tento liek.
Ak ste dostávali Benepali počas tehotenstva, váš novorodenec môže byť vystavený vyššiemu riziku vzniku infekcie. Navyše, jedna štúdia zistila viac vrodených chýb, keď matka dostávala etanercept počas tehotenstva v porovnaní s matkami, ktoré nedostávali etanercept alebo iné podobné lieky (TNF- antagonisty), ale žiadne konkrétne formy vrodených chýb sa nehlásili. Je dôležité, aby ste lekárov novorodenca a ďalších zdravotníckych pracovníkov informovali o používaní Benepali počas tehotenstva predtým, ako novorodenec dostane akúkoľvek vakcínu (ďalšie informácie, pozri časť 2
„Očkovanie“).
Ženy používajúce Benepali nemajú dojčiť, pretože Benepali sa vylučuje do materského mlieka.
Vedenie vozidiel a obsluha strojov
Nie sú dostupné informácie o tom, či používanie Benepali ovplyvňuje schopnosť viesť vozidlo alebo obsluhovať stroje.
Benepali obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v dávke, t.j. v podstate zanedbateľné množstvo
sodíka.
3. Ako používať Benepali
Vždy používajte tento liek presne tak, ako vám povedal váš lekár. Ak si nie ste niečím istý, overte si to u svojho lekára alebo lekárnika.
Ak máte pocit, že je účinok Benepali príliš silný alebo veľmi slabý, povedzte to svojmu lekárovi alebo lekárnikovi.
Používanie u dospelých pacientov (vo veku 18 a viac rokov)
Reumatoidnáartritída,psoriatickáartritídaaaxiálnaspondyloartritídavrátaneankylozujúcej
spondylitídy
Zvyčajná dávka je 50 mg jedenkrát týždenne ako injekcia pod kožu.
Avšak váš lekár môže stanoviť alternatívnu frekvenciu podávania Benepali.
Psoriáza
s
p
l
akmi
Zvyčajná dávka je 50 mg jedenkrát týždenne.
Alternatívne možno podávať 50 mg dvakrát týždenne až do 12 týždňov, následne dávky 50 mg jedenkrát týždenne.
Váš lekár na základe vašej odpovede rozhodne, ako dlho máte používať Benepali a či je potrebná opakovaná liečba. Ak Benepali po 12 týždňoch nemá účinok na váš stav, váš lekár vám môže povedať, aby ste prestali používať tento liek.
Použitie u detí a dospievajúcich
Dávka a frekvencia podávania pre dieťa alebo dospievajúceho bude závisieť od telesnej hmotnosti a ochorenia. Váš lekár určí správnu dávku pre dieťa a predpíše primeranú silu etanerceptu.
Pediatrickým pacientom vážiacim 62,5 kg alebo viac sa môže podávať dávka dávka 25 mg dvakrát týždenne alebo 50 mg jedenkrát týždenne použitím fixnej dávky formou naplnenej injekčnej
striekačky alebo naplneného pera.
Sú dostupné iné lieky obsahujúce etanercept s formou dávkovania vhodnou pre deti.
Zvyčajná dávka pri polyartritíde alebo rozšírenej oligoartritíde u pacientov od 2 rokov a vážiacich
62,5 kg alebo viac, alebo artritíde spojenej s entezitídou alebo psoriatickej artritíde u pacientov od
12 rokov a vážiacich 62,5 kg alebo viac, je 25 mg podávaných dvakrát týždenne alebo 50 mg podávaných jedenkrát týždenne.
Zvyčajná dávka pri psoriáze u pacientov vo veku od 6 rokov a vážiacich 62,5 kg alebo viac je 50 mg
a má sa podávať jedenkrát týždenne. Ak Benepali nemá po 12 týždňoch na stav dieťaťa žiaden účinok, váš lekár vám môže povedať, aby ste prestali používať tento liek.
Lekár vám poskytne podrobné pokyny na prípravu a odmeranie primeranej dávky.
Spôsob a cesta podávania
Benepali sa podáva injekčne pod kožu (subkutánne použitie).
Podrobné pokyny na podanie Benepali sa nachádza v časti 7 „Pokyny na použitie”. Roztok
Benepali sa nesmie miešať so žiadnym iným liekom.
Aby ste nezabudli, zapíšte si do zápisníka, v ktorých dňoch v týždni máte Benepali používať.
Ak použijete viac Benepali, ako máte
Ak ste použili viac Benepali, ako máte (buď podaním väčšieho množstva pri jednej príležitosti alebo príliš častým používaním), okamžite to povedzte lekárovi alebo lekárnikovi. Vždy majte pri sebe
vonkajší obal lieku, aj keď je prázdny.
Ak si zabudnete podať Benepali
Ak zabudnete na injekciu, podajte ju hneď, ako si na to spomeniete, pokiaľ nemáte nasledujúci deň dostať ďalšiu dávku, v tom prípade nepodávajte vynechanú dávku. Potom pokračujte v podávaní lieku
v obvyklých dňoch. Ak si spomeniete na vynechanú dávku až v deň, kedy máte dostať ďalšiu dávku, nepoužívajte dvojnásobnú dávku (dve dávky v jeden deň), aby ste nahradili vynechanú dávku.
Ak prestanete používať Benepali
Vaše príznaky sa po prerušení môžu vrátiť.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo lekárnika.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
Alergické reakcie
Ak sa stane čokoľvek z nasledujúceho, nepodávajte viac Benepali. Okamžite to oznámte lekárovi
alebo navštívte pohotovosť v najbližšej nemocnici.
• Problémy pri prehĺtaní alebo dýchaní,
• opuch tváre, krku, dlaní alebo chodidiel,
• pocit nervozity alebo úzkosti, pocity chvenia, náhle začervenanie kože a/alebo návaly tepla,
• závažná vyrážka, svrbenie alebo žihľavka (vyvýšené fliačky červenej alebo bledej kože, ktoré často svrbia).
Závažné alergické reakcie sú zriedkavé. Avšak, ktorýkoľvek z vyššie uvedených symptómov môže indikovať alergickú reakciu na Benepali, preto okamžite vyhľadajte lekársku pomoc.
Závažné vedľajšie účinky
Ak spozorujete čokoľvek z nasledujúceho, vy alebo dieťa možno budete potrebovať okamžitú lekársku
pomoc.
• Príznaky závažnej infekcie (vrátane zápalu pľúc, hlbokých infekcií kože, infekcií kĺbov
a infekcie krvi) ako vysoká horúčka, ktorá môže byť spojená s kašľom, ťažkosťami pri dýchaní, zimnicou, slabosťou alebo horúca, červená, citlivá, bolestivá oblasť na koži alebo kĺboch,
• príznaky poruchy krvi ako krvácanie, vznik modriny alebo bledosť,
• príznaky poruchy nervového systému ako znecitlivenie alebo brnenie, zmeny zraku, bolesť očí alebo vznik slabosti v ruke alebo nohe,
• príznaky zlyhania srdca alebo zhoršenia zlyhania srdca ako slabosť alebo ťažkosti pri dýchaní počas aktivity, opuch členkov, pocit plnosti v krku alebo bruchu, ťažkosti pri dýchaní alebo kašeľ v noci, namodralá farba nechtov alebo pier,
• príznaky zhubných nádorových ochorení: zhubné nádorové ochorenia môžu postihnúť ktorúkoľvek časť tela vrátane kože a krvi a možné príznaky budú závisieť od druhu a miesta výskytu zhubného nádorového ochorenia. Medzi tieto príznaky môže patriť úbytok hmotnosti, horúčka, opuch (s bolesťou alebo bez nej), pretrvávajúci kašeľ, prítomnosť hrčiek alebo výrastkov na koži,
• príznaky autoimunitných reakcií (kde sa vytvárajú protilátky, ktoré môžu poškodiť zdravé tkanivá), napr. bolesť, svrbenie, slabosť a abnormálne dýchanie, myslenie, pocity alebo videnie,
• príznaky lupusu alebo syndrómu podobného lupusu ako zmeny hmotnosti, pretrvávajúca vyrážka, horúčka, bolesť kĺbov alebo svalov alebo únava,
• príznaky zápalu krvných ciev ako je bolesť, horúčka, začervenanie alebo zvýšenie teploty kože alebo svrbenie.
Tieto sú zriedkavé alebo menej časté vedľajšie účinky, ale závažné stavy (niektoré z nich môžu zriedkavo byť fatálne). Ak sa vyskytne niektorý z vyššie uvedených príznakov, okamžite to oznámte lekárovi alebo navštívte pohotovosť v najbližšej nemocnici.
Nižšie sú uvedené známe vedľajšie účinky Benepali v skupinách so znižujúcou sa frekvenciou:
• Veľmi časté (môžu postihovať viac ako 1 z 10 ľudí):
Infekcie (vrátane nádchy, sínusitídy, bronchitídy, infekcií močového traktu a infekcií kože);
reakcie v mieste podania injekcie (vrátane krvácania, vzniku modriny, začervenania, svrbenia, bolesti a opuchu).
Reakcie v mieste podania injekcie (tie sa po prvom mesiaci liečby nevyskytujú tak často).
U niektorých pacientov sa vyskytla reakcia v mieste predchádzajúceho podania injekcie.
• Časté (môžu postihovať menej ako 1 z 10 ľudí):
Alergické reakcie; horúčka; svrbenie; protilátky proti normálnym tkanivám (vznik autoprotilátok).
•
Menej časté (môžu postihovať menej ako 1 zo 100 ľudí):
Nízky počet krvných doštičiek; rakovina kože (okrem melanómov); lokalizovaný opuch kože
(angioedém); žihľavka (vyvýšené fliačky červenej alebo bledej kože, ktoré často svrbia); zápaly očí; psoriáza (nová alebo jej zhoršenie); vyrážka; zápal alebo trvalé poškodenie pľúc s tvorbou
jaziev; zápal krvných ciev postihujúci rozličné orgány; zvýšené hodnoty pečeňových testov
(u pacientov, ktorí tiež dostávajú liečbu metotrexátom, je frekvencia zvýšených pečeňových testov častá).
•
Zriedkavé (môžu postihovať menej ako 1 z 1 000 ľudí):
Závažné alergické reakcie (vrátane závažného lokalizovaného opuchu kože a dýchavice -
„pískania“); lymfóm (typ krvného zhubného nádoru); melanóm (typ rakoviny kože); kombinovaný nízky počet krvných doštičiek, červených a bielych krviniek; poruchy nervového systému (so závažnou svalovou slabosťou a príznakmi a symptómami podobnými skleróze multiplex alebo zápalu očných nervov alebo zápalu miechy); tuberkulóza; kongestívne zlyhanie srdca; záchvaty; lupus alebo syndróm podobný lupusu (symptómy môžu zahŕňať pretrvávajúcu vyrážku, horúčku, bolesť kĺbov a únavu); nízky počet červených krviniek, nízky počet bielych krviniek, nízky počet neutrofilov (typ bielych krviniek); kožná vyrážka, ktorá môže viesť k mnohým pľuzgierom a olupovaniu kože; zápal pečene vyvolaný poruchou vlastného imunitného systému (autoimunitná hepatitída); imunitné ochorenie, ktoré môže postihnúť pľúca, kožu a lymfatické uzliny (sarkoidóza); oportúnne infekcie (infekcie vyskytujúce sa z dôvodu
oslabeného imunitného systému).
•
Veľmi zriedkavé (môžu postihovať menej ako 1 z 10 000 ľudí):
Zlyhanie kostnej drene produkovať kľúčové krvinky; poškodenie nervov, vrátane Guillainov- Barrého syndrómu (závažného ochorenia, ktoré môže postihnúť dýchanie a poškodiť telesné orgány); toxická epidermálna nekrolýza (život ohrozujúce ochorenie kože).
•
Neznáme (frekvenciu nie je možné určiť z dostupných údajov):
Leukémia (rakovina postihujúca krv a kostnú dreň); karcinóm z Merkelových buniek (typ rakoviny kože); nadmerná aktivácia bielych krviniek v súvislosti so zápalom (syndróm aktivácie makrofágov), opätovný výskyt hepatitídy B (infekcia pečene); zhoršenie ochorenia nazývaného dermatomyozitída (zápal svalov a slabosť sprevádzaná kožnou vyrážkou); Listeria (bakteriálna infekcia).
Vedľajšie účinky u detí a dospievajúcichVedľajšie účinky a ich frekvencie pozorované u detí a dospievajúcich sú podobné vyššie opísaným vedľajším účinkom.
Hlásenie vedľajších účinkovAk sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa

týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať BenepaliTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na škatuli a na štítku naplnenej injekčnej striekačky po „EXP“. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Naplnenú injekčnú striekačku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Po vybratí injekčnej striekačky z chladničky počkajte približne 30 minút, aby sa umožnilo roztoku Benepali v naplnenej injekčnej striekačke dosiahnuť izbovú teplotu. Nezohrievajte ho žiadnym iným spôsobom. Potom sa odporúča jeho okamžité použitie.
Benepali môžete uchovávať mimo chladničky pri teplote maximálne do 25 °C jedenkrát počas obdobia do 4 týždňov; po tomto období sa nemá opätovne uchovávať v chladničke. Benepali sa má zlikvidovať, ak sa nepoužije do štyroch týždňov po vybratí z chladničky. Odporúča sa, aby ste si zaznamenali
dátum, kedy ste Benepali vybrali z chladničky a dátum, po ktorom sa má Benepali zlikvidovať (nie viac ako 4 týždne po vybratí z chladničky).
Skontrolujte roztok v injekčnej striekačke. Má byť číry až mierne opaleskujúci, bezfarebný až bledožltý a môže obsahovať malé biele alebo takmer priesvitné bielkovinové častice. Tento vzhľad je pri Benepali normálny. Roztok nepoužívajte ak je zafarbený, zakalený alebo ak sú prítomné častice, ktoré sa líšia od častíc opísaných vyššie. Ak máte obavu týkajúcu sa vzhľadu roztoku, potom kontaktujte svojho lekárnika.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Čo Benepali obsahuje
- Liečivo etanercept. Každá naplnená injekčná striekačka obsahuje 50 mg etanerceptu.
- Ďalšie zložky sú sacharóza, chlorid sodný, monohydrát dihydrogénfosforečnanu sodného, heptahydrát hydrogénfosforečnanu disodného a voda na injekciu.
Ako vyzerá Benepali a obsah balenia
Benepali sa dodáva ako naplnená injekčná striekačka obsahujúca číry až mierne opaleskujúci,
bezfarebný až bledožltý injekčný roztok (injekcia).
Benepali je dostupný v baleniach obsahujúcich 4 naplené injekčné striekačky a vo viacnásobných baleniach pozostávajúcich z 3 škatúľ, z ktorých každá obsahuje 4 naplnené injekčné striekačky. Na trh nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutia o registrácii
Samsung Bioepis UK Limited
5th floor
Profile West
950 Great West Road
Brentford
Middlesex TW8 9ES Veľká Británia
Výrobca
Biogen (Denmark) Manufacturing ApS
Biogen Allé 1
3400 Hillerød
Dánsko
P
ís
o
m
ná informácia pre používateľa
B
enepali 50 mg injekčný roztok naplnený v injekčnom pere
etanercept
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že nahlásite akékoľvek vedľajšie účinky, ak sa u vás vyskytnú. Informácie o tom ako hlásiť vedľajšie účinky, nájdete na konci časti 4.
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete používať tento liek, pretože obsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Váš lekár vám tiež dá Bezpečnostnú kartu pacienta, ktorá obsahuje dôležité informácie, o ktorých musíte vedieť pred a počas liečby s Benepali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
- Tento liek bol predpísaný iba vám alebo dieťaťu vo vašej starostlivosti. Nedávajte ho nikomu inému. Môže mu uškodiť, dokonca aj vtedy, ak má rovnaké prejavy ochorenia ako vy alebo
dieťa, o ktoré sa staráte.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika.
To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Pozri časť 4.
V tejto písomnej informácii sa dozviete:1. Čo je Benepali a na čo sa používa
2. Čo potrebujete vedieť predtým, ako použijete Benepali
3. Ako používať Benepali
4. Možné vedľajšie účinky
5. Ako uchovávať Benepali
6. Obsah balenia a ďalšie informácie
7. Pokyny na použitie (pozri druhú stranu)
1. Čo je Benepali a na čo sa používaBenepali obsahuje liečivo etanercept.
Benepali je liek, ktorý sa vyrába z dvoch ľudských bielkovín. Blokuje aktivitu inej bielkoviny v ľudskom tele, ktorá spôsobuje zápal. Benepali účinkuje zmiernením zápalu, ktorý je spojený s určitými ochoreniami.
U dospelých (vo veku 18 a viac rokov) sa môže Benepali použiť pri:
• stredne závažnej až závažnej
reumatoidnej artritíde,
•
psoriatickej artritíde,
• závažnej
axiálnej spondyloartritíde vrátane
ankylozujúcej spondylitídy,
• stredne závažnej až závažnej
psoriáze.
Vo všetkých prípadoch sa Benepali používa obvykle vtedy, keď je bežne používaná liečba nedostatočná alebo pre vás nevhodná.
Pri
reumatoidnej artritíde sa Benepali používa obvykle v kombinácii s metotrexátom, hoci sa môže použiť i samostatne, ak je pre vás liečba metotrexátom nevhodná. Či použitý samostatne alebo v kombinácii s metotrexátom, môže Benepali spomaliť poškodenie vašich kĺbov spôsobené reumatoidnou artritídou a zlepšiť vašu schopnosť vykonávať každodenné aktivity.
U pacientov so
psoriatickou artritídou s mnohopočetným postihnutím kĺbov môže Benepali zlepšiť schopnosť vykonávať každodenné aktivity.
U pacientov s mnohopočetnými symetrickými bolestivými alebo opuchnutými kĺbmi (napr. ruky, zápästia a nohy) môže Benepali spomaliť štrukturálne poškodenie týchto kĺbov zapríčinené ochorením.
Benepali sa taktiež predpisuje na liečbu nasledujúcich ochorení u detí a dospievajúcich.
• Pre tie druhy juvenilnej idiopatickej artritídy, keď liečba metotrexátom nebola dostatočne účinná alebo nie je pre nich vhodná:
• Polyartritída (s pozitívnym alebo negatívnym reumatoidným faktorom) a rozšírená oligoartritída u pacientov od 2 rokov a vážiacich 62,5 kg alebo viac.
• Psoriatická artritída u pacientov od 12 rokov a vážiacich 62,5 kg alebo viac.
• Artritída spojená s entezitídou u pacientov od 12 rokov a vážiacich 62,5 kg alebo viac, kde všeobecne používaná liečba nebola dostatočne účinná alebo nebola pre nich vhodná.
• Závažná psoriáza u pacientov vo veku od 6 rokov a vážiacich 62,5 kg alebo viac, ktorí nedostatočne odpovedali na fototerapiu (alebo ju nemôžu používať) alebo inú systémovú liečbu.
2. Čo potrebujete vedieť predtým, ako použijete Benepali
Nepoužívajte Benepali
• ak ste vy alebo dieťa vo vašej starostlivosti alergický na etanercept alebo na ktorúkoľvek z ďalších zložiek Benepali (uvedených v časti 6). Ak máte vy alebo dieťa alergické reakcie, akými sú pocit zovretia hrudníka, dýchavica – “pískanie”, závraty alebo vyrážku, nepodávajte si ďalšie injekcie Benepali a okamžite kontaktujte vášho lekára.
• ak vy alebo dieťa máte alebo ste ohrozený rozvojom závažnej infekcie krvi nazývanej sepsa.
Ak si nie ste istý, kontaktujte, prosím, svojho lekára.
• ak máte vy alebo dieťa akúkoľvek infekciu. Ak si nie ste istý, obráťte sa, prosím, na svojho lekára.
Upozornenia a opatrenia
Predtým, ako začnete používať Benepali, obráťte sa na svojho lekára.
• Alergická reakcia: Keď sa u vás alebo u dieťaťa prejaví alergická reakcia ako je pocit zovretia hrudníka, dýchavica – “pískanie”, závrat alebo vyrážka, nepodávajte si viac Benepali a kontaktujte okamžite svojho lekára.
• Infekcie/chirurgický výkon: Keď sa u vás alebo dieťaťa rozvíja nová infekcia alebo sa vy alebo dieťa chystáte na nejaký väčší chirurgický zákrok, váš lekár možno bude chcieť sledovať liečbu s Benepali.
• Infekcie/diabetes: Informujte svojho lekára, ak ste vy alebo dieťa mali v minulosti opakované infekcie alebo trpíte diabetom alebo existujú iné okolnosti, ktoré zvyšujú riziko infekcie.
• Infekcie/sledovanie: Informujte vášho lekára o každej nedávnej ceste mimo Európy. Ak sa u vás alebo dieťaťa vyvinú symptómy infekcie ako horúčka, triaška alebo kašeľ, oznámte to okamžite vášmu lekárovi. Váš lekár sa môže rozhodnúť pokračovať v sledovaní vás alebo dieťaťa kvôli príznakom infekcie potom, ak ste prestali používať Benepali.
• Tuberkulóza: Nakoľko u pacientov liečených s Benepali boli hlásené prípady tuberkulózy, váš lekár skontroluje prejavy a symptómy tuberkulózy pred začatím liečby s Benepali. To môže zahŕňať podrobnú anamnézu, RTG hrudníka a tuberkulínový test. Vykonanie týchto testov má byť zaznamenané do Bezpečnostnej karty pacienta. Je veľmi dôležité, aby ste povedali lekárovi, či ste niekedy vy alebo dieťa mali tuberkulózu alebo či ste boli v blízkom kontakte s niekým,
kto mal tuberkulózu. Ak sa počas liečby alebo po liečbe objavia symptómy tuberkulózy (ako
pretrvávajúci kašeľ, strata hmotnosti, vysilenosť, mierne zvýšená teplota) alebo inej infekcie, okamžite to oznámte lekárovi.
• Hepatitída B: Povedzte vášmu lekárovi, že vy alebo dieťa máte alebo ste v minulosti mali hepatitídu B. Váš lekár má vykonať test na prítomnosť infekcie hepatitídou B predtým, ako vy alebo dieťa začnete liečbu s Benepali. Liečba s Benepali môže viesť k reaktivácii hepatitídy B u pacientov, ktorí boli predtým infikovaní vírusom hepatitídy B. Ak sa to stane, mali by ste prerušiť používanie Benepali.
• Hepatitída C: Povedzte vášmu lekárovi, ak vy alebo dieťa máte hepatitídu C. Váš lekár možno bude chcieť sledovať liečbu s Benepali v prípade, ak sa infekcia zhorší.
• Poruchy krvi: Ihneď vyhľadajte lekára, ak máte vy alebo dieťa akýkoľvek prejav alebo symptóm ako pretrvávajúca horúčka, bolesť hrdla, krvné podliatiny, krvácanie alebo bledosť. Tieto symptómy môžu poukazovať na existenciu potenciálne život ohrozujúcej poruchy krvi, ktorá si môže vyžadovať vysadenie Benepali.
• Nervový systém a poruchy očí: Keď máte vy alebo dieťa sclerosis multiplex, neuritis n. optici (zápal zrakového nervu) alebo tranzverzálnu myelitídu (zápal miechy), oznámte to svojmu lekárovi. Váš lekár rozhodne, či je liečba s Benepali vhodná.
• Kongestívne zlyhanie srdca: Informujte svojho lekára, ak ste vy alebo dieťa mali v minulosti kongestívne zlyhanie srdca, pretože za týchto okolností sa Benepali musí používať s opatrnosťou.
• Rakovina: Povedzte svojmu lekárovi, ak máte alebo ste niekedy mali lymfóm (typ krvného zhubného nádoru) alebo akýkoľvek iný zhubný nádor predtým, ako dostanete Benepali. Pacienti so závažnou reumatoidnou artritídou, ktorí trpia ochorením dlhšiu dobu, môžu mať riziko pre vznik lymfómu vyššie ako je priemer. Deti a dospelí, ktorí užívajú Benepali môžu mať vyššie riziko lymfómu alebo iného zhubného nádoru (rakoviny). U niektorých detských alebo dospievajúcich pacientov, ktorí dostávali etanercept alebo lieky s podobným mechanizmom účinku ako etanercept, sa vyvinuli zhubné nádory vrátane neobvyklých typov, ktoré niekedy viedli k smrti. U niektorých pacientov užívajúcich Benepali sa objavila rakovina kože. Povedzte vášmu lekárovi, ak sa u vás alebo dieťaťa objaví akákoľvek zmena vzhľadu kože alebo výrastky na koži.
• Kiahne: Ak ste vy alebo dieťa vystavený nákaze kiahní pri používaní Benepali, oznámte to lekárovi. Váš lekár rozhodne, či je vhodná preventívna liečba kiahní.
• Alkoholová závislosť: Benepali sa nemá používať na liečbu hepatitídy, ktorá bola vyvolaná závislosťou na alkohole. Povedzte vášmu lekárovi, ak ste vy alebo dieťa vo vašej starostlivosti v minulosti mali problém s nadmerným užívaním alkoholu.
• Wegenerova granulomatóza: Benepali sa neodporúča používať na liečbu Wegenerovej granulomatózy, zriedkavého zápalového ochorenia. Ak vy alebo dieťa vo vašej starostlivosti máte Wegenerovu granulomatózu, povedzte to vášmu lekárovi.
• Antidiabetické lieky (lieky na liečbu cukrovky): Povedzte vášmu lekárovi, že vy alebo dieťa máte cukrovku alebo užívate lieky na liečbu cukrovky. Váš lekár môže rozhodnúť, či vy alebo dieťa potrebujete menej antidiabetických liekov, pokiaľ používate Benepali.
• Očkovanie: Niektoré očkovacie látky, akou je napríklad perorálna polio vakcína sa nemajú podávať počas liečby s Benepali. Skôr než vy alebo dieťa dostanete akúkoľvek vakcínu, poraďte sa s lekárom.
Deti a dospievajúci
Benepali nie je indikovaný na použitie u detí a dospievajúcich vážiacich menej ako 62,5 kg.
• Očkovanie: Ak je to možné, u detí sa majú vykonať všetky očkovania predpísané pre daný vek, pred začatím užívania Benepali. Niektoré očkovacie látky, akou je napríklad perorálna polio vakcína sa nemajú podávať počas užívania Benepali. Skôr než vy alebo dieťa dostane akúkoľvek vakcínu, poraďte sa s lekárom.
• Zápalové črevné ochorenia (inflammatory bowel disease = IBD): U pacientov s juvenilnou idiopatickou artritídou (JIA) liečených etanerceptom sa pozorovali prípady IBD. Povedzte lekárovi, ak sa u dieťaťa objavia akékoľvek kŕče alebo bolesť brucha, hnačka, úbytok hmotnosti alebo krv v stolici.
Vo všeobecnosti sa Benepali nemá používať u detí s polyartritídou alebo rozšírenou oligoartritídou mladších ako 2 roky alebo vážiacich menej ako 62,5 kg, alebo u detí s artritídou spojenou s entezitídou alebo psoriatickou artritídou mladších ako 12 rokov alebo vážiacich menej ako 62,5 kg, alebo u detí
s psoriázou mladších ako 6 rokov alebo vážiacich menej ako 62,5 kg.
Iné lieky a Benepali
Ak teraz vy alebo dieťa užívate alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky (vrátane sulfasalazínu), aj tie, ktoré vám nepredpísal lekár, povedzte to svojmu lekárovi alebo lekárnikovi.
Vy alebo dieťa nemáte používať Benepali s liekmi, ktoré obsahujú ako liečivo anakinru alebo abatacept.
Tehotenstvo a dojčenie
Ženám v reprodukčnom veku sa má odporučiť používať vhodnú antikoncepciu, aby sa zabránilo
otehotneniu počas liečby s Benepali a počas troch týždňov po ukončení liečby.
Použitie Benepali sa počas tehotenstva neodporúča. Ak ste tehotn á alebo dojčíte, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom predtým, ako začnete používať tento liek.
Ak ste dostávali Benepali počas tehotenstva, váš novorodenec môže byť vystavený vyššiemu riziku vzniku infekcie. Navyše, jedna štúdia zistila viac vrodených chýb, keď matka dostávala etanercept počas tehotenstva v porovnaní s matkami, ktoré nedostávali etanercept alebo iné podobné lieky (TNF- antagonisty), ale žiadne konkrétne formy vrodených chýb sa nehlásili. Je dôležité, aby ste lekárov novorodenca a ďalších zdravotníckych pracovníkov informovali o používaní Benepali počas tehotenstva predtým, ako novorodenec dostane akúkoľvek vakcínu (ďalšie informácie, pozri časť 2
„Očkovanie“).
Ženy používajúce Benepali nemajú dojčiť, pretože Benepali sa vylučuje do materského mlieka.
Vedenie vozidiel a obsluha strojov
Nie sú dostupné informácie o tom, či používanie Benepali ovplyvňuje schopnosť viesť vozidlo alebo
obsluhovať stroje.
Benepali obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v dávke, t.j. v podstate zanedbateľné množstvo sodíka.
3. Ako používať Benepali
Vždy používajte tento liek presne tak, ako vám povedal váš lekár. Ak si nie ste niečím istý, overte si to u svojho lekára alebo lekárnika.
Ak máte pocit, že je účinok Benepali príliš silný alebo veľmi slabý, povedzte to svojmu lekárovi alebo lekárnikovi.
Použitie u dospelých pacientov (vo veku 18 a viac rokov)
Reumatoidnáartritída,psoriatickáartritídaaaxiálnaspondyloartritídavrátaneankylozujúcej
spondylitídy
Zvyčajná dávka je 50 mg jedenkrát týždenne ako injekcia pod kožu.
Avšak váš lekár môže stanoviť alternatívnu frekvenciu podávania Benepali.
Psoriázasplakmi
Zvyčajná dávka je 50 mg jedenkrát týždenne.
Alternatívne možno podávať 50 mg dvakrát týždenne až do 12 týždňov, následne dávky 50 mg jedenkrát týždenne.
Váš lekár na základe vašej odpovede rozhodne, ako dlho máte používať Benepali a či je potrebná opakovaná liečba. Ak Benepali po 12 týždňoch nemá účinok na váš stav, váš lekár vám môže povedať, aby ste prestali používať tento liek.
Použitie u detí a dospievajúcich
Dávka a frekvencia podávania pre dieťa alebo dospievajúceho bude závisieť od telesnej hmotnosti a ochorenia. Váš lekár určí správnu dávku pre dieťa a predpíše primeranú silu etanerceptu.
Pediatrickým pacientom vážiacim 62,5 kg alebo viac sa môže podávať dávka 25 mg dvakrát týždenne alebo 50 mg jedenkrát týždenne použitím fixnej dávky formou naplnenej injekčnej striekačky alebo naplneného pera.
Sú dostupné iné lieky obsahujúce etanercept s formou dávkovania vhodnou pre deti.
Zvyčajná dávka pri polyartritíde alebo rozšírenej oligoartritíde u pacientov od 2 rokov a vážiacich
62,5 kg alebo viac, alebo artritíde spojenej s entezitídou alebo psoriatickej artritíde u pacientov od
12 rokov a vážiacich 62,5 kg alebo viac, je 25 mg podávaných dvakrát týždenne alebo 50 mg podávaných jedenkrát týždenne.
Zvyčajná dávka pri psoriáze u pacientov vo veku od 6 rokov a vážiacich 62,5 kg alebo viac je 50 mg
a má sa podávať jedenkrát týždenne. Ak Benepali nemá po 12 týždňoch na stav dieťaťa žiaden účinok, váš lekár vám môže povedať, aby ste prestali používať tento liek.
Lekár vám poskytne podrobné pokyny na prípravu a odmeranie primeranej dávky.
Spôsob a cesta podávania
Benepali sa podáva injekčne pod kožu (subkutánne použitie).
Podrobné pokyny na podanie Benepali sa nachádza v časti 7 „Pokyny na použitie”. Roztok
Benepali sa nesmie miešať so žiadnym iným liekom.
Aby ste nezabudli, zapíšte si do zápisníka, v ktorých dňoch v týždni máte Benepali používať.
Ak použijete viac Benepali, ako máte
Ak ste použili viac Benepali, ako máte (buď podaním väčšieho množstva pri jednej príležitosti alebo príliš častým používaním), okamžite to povedzte lekárovi alebo lekárnikovi. Vždy majte pri sebe vonkajší obal lieku, aj keď je prázdny.
Ak si zabudnete podať Benepali
Ak zabudnete na injekciu, podajte ju hneď, ako si na to spomeniete, pokiaľ nemáte nasledujúci deň dostať ďalšiu dávku, v tom prípade nepodávajte vynechanú dávku. Potom pokračujte v podávaní lieku v obvyklých dňoch. Ak si spomeniete na vynechanú dávku až v deň, kedy máte dostať ďalšiu dávku,
nepoužívajte dvojnásobnú dávku (dve dávky v jeden deň), aby ste nahradili vynechanú dávku.
Ak prestanete používať Benepali
Vaše príznaky sa po prerušení môžu vrátiť.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo lekárnika.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
A
l
ergické reakcie
Ak sa stane čokoľvek z nasledujúceho, nepodávajte viac Benepali. Okamžite to oznámte lekárovi
alebo navštívte pohotovosť v najbližšej nemocnici.
• Problémy pri prehĺtaní alebo dýchaní,
• opuch tváre, krku, dlaní alebo chodidiel,
• pocit nervozity alebo úzkosti, pocity chvenia, náhle začervenanie kože a/alebo návaly tepla,
• závažná vyrážka, svrbenie alebo žihľavka (vyvýšené fliačky červenej alebo bledej kože, ktoré často svrbia).
Závažné alergické reakcie sú zriedkavé. Avšak, ktorýkoľvek z vyššie uvedených symptómov môže indikovať alergickú reakciu na Benepali, preto okamžite vyhľadajte lekársku pomoc.
Závažné vedľajšie účinky
Ak spozorujete čokoľvek z nasledujúceho, vy alebo dieťa možno budete potrebovať okamžitú lekársku
pomoc.
• Príznaky závažnej infekcie (vrátane zápalu pľúc, hlbokých infekcií kože, infekcií kĺbov
a infekcie krvi) ako vysoká horúčka, ktorá môže byť spojená s kašľom, ťažkosťami pri dýchaní, zimnicou, slabosťou alebo horúca, červená, citlivá, bolestivá oblasť na koži alebo kĺboch,
• príznaky poruchy krvi ako krvácanie, vznik modriny alebo bledosť,
• príznaky poruchy nervového systému ako znecitlivenie alebo brnenie, zmeny zraku, bolesť očí alebo vznik slabosti v ruke alebo nohe,
• príznaky zlyhania srdca alebo zhoršenia zlyhania srdca ako slabosť alebo ťažkosti pri dýchaní počas aktivity, opuch členkov, pocit plnosti v krku alebo bruchu, ťažkosti pri dýchaní alebo kašeľ v noci, namodralá farba nechtov alebo pier,
• príznaky zhubných nádorových ochorení: zhubné nádorové ochorenia môžu postihnúť ktorúkoľvek časť tela vrátane kože a krvi a možné príznaky budú závisieť od druhu a miesta výskytu zhubného nádorového ochorenia. Medzi tieto príznaky môže patriť úbytok hmotnosti, horúčka, opuch (s bolesťou alebo bez nej), pretrvávajúci kašeľ, prítomnosť hrčiek alebo výrastkov na koži,
• príznaky autoimunitných reakcií (kde sa vytvárajú protilátky, ktoré môžu poškodiť zdravé tkanivá), napr. bolesť, svrbenie, slabosť a abnormálne dýchanie, myslenie, pocity alebo videnie,
• príznaky lupusu alebo syndrómu podobného lupusu ako zmeny hmotnosti, pretrvávajúca vyrážka, horúčka, bolesť kĺbov alebo svalov alebo únava,
• príznaky zápalu krvných ciev ako je bolesť, horúčka, začervenanie alebo zvýšenie teploty kože alebo svrbenie.
Tieto sú zriedkavé alebo menej časté vedľajšie účinky, ale závažné stavy (niektoré z nich môžu zriedkavo byť fatálne). Ak sa vyskytne niektorý z vyššie uvedených príznakov, okamžite to oznámte lekárovi alebo navštívte pohotovosť v najbližšej nemocnici.
Nižšie sú uvedené známe vedľajšie účinky Benepali v skupinách so znižujúcou sa frekvenciou:
• Veľmi časté (môžu postihovať viac ako 1 z 10 ľudí):
Infekcie (vrátane nádchy, sinusitídy, bronchitídy, infekcií močového traktu a infekcií kože);
reakcie v mieste podania injekcie (vrátane krvácania, vzniku modriny, začervenania, svrbenia, bolesti a opuchu).
Reakcie v mieste podania injekcie (tie sa po prvom mesiaci liečby nevyskytujú tak často).
U niektorých pacientov sa vyskytla reakcia v mieste predchádzajúceho podania injekcie.
• Časté (môžu postihovať menej ako 1 z 10 ľudí):
Alergické reakcie; horúčka; svrbenie; protilátky proti normálnym tkanivám (vznik autoprotilátok).
•
Menej časté (môžu postihovať menej ako 1 zo 100 ľudí):
Nízky počet krvných doštičiek; rakovina kože (okrem melanómov); lokalizovaný opuch kože (angioedém); žihľavka (vyvýšené fliačky červenej alebo bledej kože, ktoré často svrbia); zápaly očí; psoriáza (nová alebo jej zhoršenie); vyrážka; zápal alebo trvalé poškodenie pľúc s tvorbou jaziev; zápal krvných ciev postihujúci rozličné orgány; zvýšené hodnoty pečeňových testov
(u pacientov, ktorí tiež dostávajú liečbu metotrexátom, je frekvencia zvýšených pečeňových testov častá).
•
Zriedkavé (môžu postihovať menej ako 1 z 1 000 ľudí):
Závažné alergické reakcie (vrátane závažného lokalizovaného opuchu kože a dýchavice -
„pískania“); lymfóm (typ krvného zhubného nádoru); melanóm (typ rakoviny kože);
kombinovaný nízky počet krvných doštičiek, červených a bielych krviniek; poruchy nervového systému (so závažnou svalovou slabosťou a príznakmi a symptómami podobnými skleróze multiplex alebo zápalu očných nervov alebo zápalu miechy); tuberkulóza; kongestívne zlyhanie srdca; záchvaty; lupus alebo syndróm podobný lupusu (symptómy môžu zahŕňať pretrvávajúcu vyrážku, horúčku, bolesť kĺbov a únavu); nízky počet červených krviniek, nízky počet bielych krviniek, nízky počet neutrofilov (typ bielych krviniek); kožná vyrážka, ktorá môže viesť k mnohým pľuzgierom a olupovaniu kože; zápal pečene vyvolaný poruchou vlastného imunitného systému (autoimunitná hepatitída); imunitné ochorenie, ktoré môže postihnúť pľúca, kožu a lymfatické uzliny (sarkoidóza); oportúnne infekcie (infekcie vyskytujúce sa z dôvodu
oslabeného imunitného systému).
•
Veľmi zriedkavé (môžu postihovať menej ako 1 z 10 000 ľudí):
Zlyhanie kostnej drene produkovať kľúčové krvinky; poškodenie nervov, vrátane Guillainov- Barrého syndrómu (závažného ochorenia, ktoré môže postihnúť dýchanie a poškodiť telesné orgány); toxická epidermálna nekrolýza (život ohrozujúce ochorenie kože).
•
Neznáme (frekvenciu nie je možné určiť z dostupných údajov):
Leukémia (rakovina postihujúca krv a kostnú dreň); karcinóm z Merkelových buniek (typ rakoviny kože); nadmerná aktivácia bielych krviniek v súvislosti so zápalom (syndróm aktivácie
makrofágov), opätovný výskyt hepatitídy B (infekcia pečene); zhoršenie ochorenia nazývaného
dermatomyozitída (zápal svalov a slabosť sprevádzaná kožnou vyrážkou); Listeria (bakteriálna infekcia).
Vedľajšie účinky u detí a dospievajúcichVedľajšie účinky a ich frekvencie pozorované u detí a dospievajúcich sú podobné vyššie opísaným
vedľajším účinkom.
Hlásenie vedľajších účinkovAk sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa

týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať BenepaliTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na škatuli a na štítku naplneného pera po „EXP“. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke. Naplnené perá uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Po vybratí naplneného pera z chladničky počkajte približne 30 minút, aby sa umožnilo roztoku Benepali v pere dosiahnuť izbovú teplotu. Nezohrievajte ho žiadnym iným spôsobom. Potom sa odporúča jeho okamžité použitie.
Benepali môžete uchovávať mimo chladničky pri teplote maximálne do 25 °C jedenkrát počas obdobia do 4 týždňov; po tomto období sa nemá opätovne uchovávať v chladničke. Benepali sa má zlikvidovať, ak sa nepoužije do štyroch týždňov po vybratí z chladničky. Odporúča sa, aby ste si zaznamenali
dátum, kedy ste Benepali vybrali z chladničky a dátum, po ktorom sa má Benepali zlikvidovať (nie viac ako 4 týždne po vybratí z chladničky).
Pohľadom cez priehľadné kontrolné okienko skontrolujte roztok v pere. Roztok má byť číry až mierne opaleskujúci, bezfarebný až bledožltý a môže obsahovať malé biele alebo takmer priesvitné bielkovinové častice. Tento vzhľad je pri Benepali normálny. Roztok nepoužívajte ak je zafarbený, zakalený alebo ak sú prítomné častice, ktoré sa líšia od častíc opísaných vyššie. Ak máte obavu týkajúcu sa vzhľadu roztoku, potom kontaktujte vášho lekárnika.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Čo Benepali obsahuje
- Liečivo je etanercept. Každé naplnené pero obsahuje 50 mg etanerceptu.
- Ďalšie zložky sú sacharóza, chlorid sodný, monohydrát dihydrogénfosforečnanu sodného, heptahydrát hydrogénfosforečnanu disodného a voda na injekciu.
Ako vyzerá Benepali a obsah balenia
Benepali sa dodáva ako injekčný roztok naplnený v injekčnom pere (injekčný roztok). Pero obsahuje
číry až mierne opaleskujúci, bezfarebný až bledožltý injekčný roztok (injekcia).
Benepali je dostupný v baleniach obsahujúcich 4 naplené perá a vo viacnásobných baleniach pozostávajúcich z 3 škatúľ, z ktorých každá obsahuje 4 naplnené perá. Na trh nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutia o registrácii
Samsung Bioepis UK Limited
5th floor
Profile West
950 Great West Road
Brentford
Middlesex TW8 9ES Veľká Británia
Výrobca
Biogen (Denmark) Manufacturing ApS Biogen Allé 1
3400 Hillerød
Dánsko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa rozhodnutia o registrácii:
B
e
l
gië/Belgique/Belgien
Biogen Belgium NV/S.A Tél/Tel: + 32 (0)2 808 5947
Lietuva
Ewopharma AG Atstovybė
Tel: +370 52 14 02 60
Б
ълг
ария
Ewopharma AG Representative Office
Teл.: + 359 249 176 81
Luxembourg/Luxemburg Biogen Belgium NV/SA Tél/Tel: +35 227 772 038
Č
eská republika
Biogen (Czech Republic) s.r.o. Tel: + 420 228 884 152
Magyarország
Biogen Hungary Kft.
Tel.: + 36 (0)6 1 848 04 64
D
anmark
Biogen (Denmark) A/S
Tlf: + 45 78 79 37 53
Malta
Biogen Idec Limited (UK)
Tel: + 356 27 78 15 79
D
eutschland
Biogen GmbH
Tel: + 49 (0)30 223 864 72
Nederland
Biogen Netherlands B.V. Tel: + 31 (0)20 808 02 70
E
esti
Ewopharma AG Eesti filiaal
Tel: + 372 6 68 30 56
Norge
Biogen Norway AS
Tlf: + 47 21 93 95 87
Ε
λλάδα
Biogen Idec Limited (UK)
Τηλ: + 30 211 176 8555
Österreich
Biogen Austria GmbH
Tel: + 43 (0)1 267 51 42
E
s
paña
Biogen Spain, S.L. Tel: + 34 931 790 519
Polska
Biogen Poland Sp. z o.o. Tel.: + 48 22 116 86 94
F
rance
Biogen France SAS
Tél: + 33 (0)1 776 968 14
Portugal
Biogen Portugal Sociedade Farmacêutica,
Unipessoal, Lda
Tel: + 351 308 800 792
H
rvatska
Ewopharma d.o.o
Tel: + 385 (0)1 777 64 37
România
Ewopharma AG Representative Office
Tel: + 40 377 881 045
Ireland
Biogen Idec (Ireland) Ltd.
Tel: +353 (0)1 513 33 33
Slovenija
Biogen Pharma d.o.o.
Tel: + 386 (0)1 888 81 07
Ísl
and
Biogen Idec Limited (UK) Sími: + 354 800 9836
Slovenská republika
Biogen Slovakia s.r.o.
Tel: + 421 (0)2 333 257 10
It
alia
Biogen Italia s.r.l.
Tel: + 39 (0)6 899 701 50
Suomi/Finland
Biogen Finland Oy
Puh/Tel: + 358 (0)9 427 041 08
Κύ
πρ
ος
Biogen Idec Limited (UK) Τηλ: + 357 22 00 04 93
Sverige
Biogen Sweden AB
Tel: +46 (0)8 525 038 36
L
atvija
Ewopharma AG pārstāvniecība
Tel: + 371 66 16 40 32
United Kingdom
Biogen Idec Limited
Tel: +44 (0)20 360 886 22
T
áto písomná informácia bola naposledy aktualizovaná v
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.