
u vrátiť späť na 28 dní.
Osobitné populácie
Starší pacienti
U starších pacientov sa neodporúčajú žiadne špecifické úpravy dávky. Keďže u starších pacientov je
vyššia pravdepodobnosť zníženej funkcie obličiek, môže byť vhodné sledovať ich funkciu.
Pacienti s poruchou funkcie obličiek
Azacitidín môže byť podávaný pacientom s poruchou funkcie obličiek bez úpravy úvodnej dávky
(pozri časť 5.2). Ak sa vyskytne nevysvetliteľný pokles hydrogenuhličitanov v sére na menej ako
20 mmol/l, dávka sa má v nasledujúcom cykle znížiť o 50 %. Ak sa vyskytne nevysvetliteľný vzostup kreatinínu v sére alebo močovinového dusíka v krvi (blood urea nitrogen, BUN) na úroveň ≥ 2-
násobne vyššiu, ako sú východiskové hodnoty a nad horný limitnormálnej hodnoty (upper limit of
normal, ULN), ďalší cyklus sa má odložiť dovtedy, kým sa hodnoty nevrátia na normálnu alebo východiskovú úroveň a v nasledujúcom liečebnom cykle sa máznížiť dávka o 50 % (pozri časť 4.4).
Pacienti s poruchou funkcie pečene
U pacientov s poruchou funkcie pečene neboli vykonané žiadne oficiálne štúdie (pozri časť 4.4).
Pacienti so závažnou poruchou funkcie pečene sa majú pozorne sledovať kvôli výskytu nežiaducich účinkov. U pacientov s poruchou funkcie pečene sa pred začatím liečby neodporúča žiadna špecifická úprava úvodnej dávky a následné úpravy dávky majú vychádzať z hematologických laboratórnych hodnôt. Azacitidín je kontraindikovaný u pacientov s malígnymi pečeňovými nádormi v pokročilom štádiu (pozri časti 4.3 a 4.4).
Pediatrická populácia
Bezpečnosť a účinnosť azacitidínu u detí vo veku 0 – 17 rokov neboli doteraz stanovené. Aktuálne dostupné údaje sú popísané v častiach 4.8, 5.1 a 5.2, ale neumožňujú uviesť odporúčania týkajúce sa
dávkovania.
Spôsobpodávania
Rekonštituovaný Azacitidine Glenmark sa má podávať subkutánnou injekciou do ramena, stehna alebo brucha. Miesta injekčnej aplikácie sa majú meniť. Nové injekcie sa majú aplikovať najmenej
2,5 cm od predchádzajúceho miesta vpichu a nikdy nie do oblastí, v ktorých je miesto vpichu
bolestivé, s podliatinami, začervenané alebo stvrdnuté.
Po rekonštitúcii sa suspenzia nemá filtrovať. Pokyny na rekonštitúciu lieku pred podaním, pozri časť
6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Malígne pečeňové nádory v pokročilom štádiu (pozri časť 4.4).
Dojčenie (pozri časť 4.6).
4.4 Osobitné upozornenia a opatrenia pri používaní
Hematologická toxicita
Liečba azacitidínom je spojená s anémiou, neutropéniou a trombocytopéniou, najmä počas prvých
2 cyklov (pozri časť 4.8). V prípade potreby, ale aspoň pred každým liečebným cyklom, sa má stanoviť kompletný krvný obraz s cieľom sledovania odpovede a toxicity. Po podaní odporúčanej
dávky v prvom cykle sa má dávka na základe hodnoty nadir a hematologickej odpovede pre následné cykly znížiť alebo jej podanie odložiť na neskôr (pozri časť 4.2). Pacienti majú byť poučení, aby ihneď hlásili prípady horúčky. Pacienti a lekári majú sledovať prejavy a príznaky krvácania.
Porucha funkcie pečene
U pacientov s poruchou funkcie pečene neboli vykonané žiadne oficiálne štúdie. U pacientov s rozsiahlou nádorovou záťažou z dôvodu metastatického ochorenia bola hlásená progresívna pečeňová kóma a úmrtie počas liečby azacitidínom, a to najmä u pacientov s východiskovými hodnotami albumínu v sére < 30 g/l. Azacitidín je kontraindikovaný u pacientov s malígnymi pečeňovými nádormi v pokročilom štádiu (pozri časť 4.3).
Porucha funkcie obličiek
Obličkové abnormality počínajúc od zvýšených hodnôt kreatinínu v sére až po zlyhanie obličiek
a úmrtie boli pozorované u pacientov intravenózne liečených azacitidínom v kombinácii s inými chemoterapeutikami. Okrem toho sa u 5 pacientov s chronickou myeloidnou leukémiou (CML), ktorí boli liečení azacitidínom a etopozidom, vyvinula renálna tubulárna acidóza, definovaná ako pokles hladiny hydrogenuhličitanov v sére na < 20 mmol/l spojený s alkalickým močom a hypokaliémiou (draslík v sére < 3 mmol/l). Ak sa vyskytne nevysvetliteľný pokles hydrogénuhličitanov v sére
(< 20 mmol/l) alebo vzostup sérového kreatinínu alebo BUN, dávka sa má znížiť alebo jej podanie
odložiťna neskôr (pozri časť 4.2).
Pacientom sa má odporučiť, aby okamžite hlásili oligúriu a anúriu lekárovi.
Hoci neboli zaznamenané žiadne klinicky významné rozdiely vo frekvencii nežiaducich reakcií medzi pacientmi s normálnou funkciou obličiek v porovnaní s pacientmi s poruchou funkcie obličiek, pacienti s poruchou funkcie obličiek sa majú dôkladne sledovať na toxicitu, pretože azacitidín a/alebo jeho metabolity sa primárne vylučujú obličkami (pozri časť 4.2).
Laboratórne testy
Pred začatím liečby a pred každým liečebným cyklom je potrebné stanoviť hodnoty pečeňových testov, kreatinínu v sére a hydrogenuhličitanov v sére. Pred začatím liečby a v prípade potreby
(minimálne však pred každým liečebným cyklom) sa má stanoviť kompletný krvný obraz s cieľom
sledovania odpovede a toxicity, pozri tiež časť 4.8.
Ochorenie srdca a pľúc
Pacienti s anamnézou závažného kongestívneho zlyhávania srdca, klinicky nestabilného ochorenia srdca alebo pľúc boli vylúčení z pivotných registračných štúdií (AZA PH GL 2003 CL 001 a AZA- AML-001), a preto nebola u týchto pacientov stanovená bezpečnosť a účinnosť azacitidínu. Posledné údaje z klinického skúšania u pacientov so známou anamnézou kardiovaskulárneho alebo pľúcneho ochorenia preukázali významné zvýšenie výskytu srdcových príhod v súvislosti s azacitidínom (pozri časť 4.8). Preto sa odporúča opatrnosť pri predpisovaní azacitidínu týmto pacientom. Pred liečbou a počas liečby je potrebné zvážiť kardiopulmonálne vyšetrenie.
Nekrotizujúcafasciitída
U pacientov liečených azacitidínom bola hlásená nekrotizujúca fasciitída, vrátane fatálnych prípadov.
U pacientov, u ktorých sa rozvíja nekrotizujúca fasciitída, sa má liečba azacitidínom ukončiť a má sa
okamžite začať s vhodnou liečbou.
Syndrómz rozpadu nádoru
Pacienti vykazujúci pred liečbou vysokú nádorovú záťaž sú ohrození syndrómom z rozpadu nádoru. Títo pacienti sa majú dôkladne sledovať a majú byť vykonané vhodné opatrenia.
4.5 Liekové a iné interakcie
Na základe údajov in vitro sa metabolizmus azacitidínu nezdá byť sprostredkovaný izoenzýmami cytochrómu P450 (CYP), UDP-glukuronozyltransferázami (UGT), sulfotransferázami (SULT) ani glutationtransferázami (GST); interakcie súvisiace s týmito metabolickými enzýmami in vivo sú preto
považované za nepravdepodobné.
Klinicky významné inhibičné alebo indukčné účinky azacitidínu na enzýmy cytochrómu P450 sú nepravdepodobné (pozri časť 5.2).
Neuskutočnili sa žiadne formálne klinické štúdie liekových interakcií s azacitidínom.
4.6 Fertilita, gravidita a laktácia
Ženyvo fertilnom veku / Antikoncepcia u mužovažien
Ženy vo fertilnom veku a muži majú používať účinnú antikoncepciu počas liečby a aj 3 mesiace po
liečbe.
Gravidita
Nie sú k dispozícii dostatočné údaje o použití azacitidínu u gravidných žien. Štúdie na myšiach
preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí. Na základe výsledkov zo štúdií na zvieratách a mechanizmu jeho účinku sa azacitidín nemá používať počas gravidity, najmä počas prvého trimestra, pokiaľ jeho použitie nie je jednoznačne nevyhnutné. Prínos liečby sa má individuálne zvážiť vzhľadom na možné riziko pre plod.
Dojčenie
Nie je známe, či sa azacitidín/metabolity vylučujú do ľudského mlieka. Z dôvodu potenciálne
závažných nežiaducich reakcií u dojčeného dieťaťa, je dojčenie počas liečby azacitidínom kontraindikované.
Fertilita
Nie sú k dispozícii žiadne údaje o vplyve azacitidínu na plodnosť u ľudí. U zvierat boli pri použití azacitidínu dokumentované nežiaduce reakcie na plodnosť samcov (pozri časť 5.3). Mužom sa má
odporučiť, aby sa vyhli splodeniu dieťaťa počas liečby, pričom musia v priebehu liečby a ešte
3 mesiace po jej ukončení používať účinnú antikoncepciu. Pred začatím liečby sa má mužom
odporučiť, aby navštívili poradňu ohľadne uchovania spermií.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Azacitidín má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pri používaní azacitidínu sa zaznamenala únava. Preto sa pri vedení alebo obsluhovaní strojov odporúča opatrnosť.
4.8 Nežiaduce účinky
Súhrn profilu bezpečnosti
Dospelá populácia s MDS, CMML a AML (20 - 30 % blastov v kostnej dreni)
Nežiaduce reakcie považované za možno alebo pravdepodobne súvisiace s podávaním azacitidínu sa
vyskytli u 97 % pacientov.
Najčastejšie závažné nežiaduce reakcie pozorované v rámci pivotnej štúdie (AZA PH GL 2003 CL
001), ktoré boli tiež pozorované v podporných štúdiách (CALGB 9221 a CALGB 8921), zahŕňali febrilnú neutropéniu (8,0 %) a anémiu (2,3 %). Ďalšie závažné nežiaduce reakcie z týchto 3 štúdií zahŕňali infekcie, ako je neutropenická sepsa (0,8 %) a zápal pľúc (2,5 %) (niektoré prípady s fatálnym výsledkom), trombocytopénia (3,5 %), reakcie precitlivenosti (0,25 %)a prípady krvácania (napr. mozgové krvácanie [0,5 %], gastrointestinálne krvácanie [0,8 %] a inrakraniálne krvácanie
[0,5 %]).
Najčastejšie hlásené nežiaduce reakcie počas liečby azacitidínom boli hematologické reakcie (71,4 %) vrátane trombocytopénie, neutropénie a leukopénie (zvyčajne 3. - 4. stupňa), gastrointestinálne reakcie (60,6 %) vrátane nevoľnosti, vracania (zvyčajne 1. - 2. stupňa) alebo reakciev mieste vpichu (77,1 %, zvyčajne 1. - 2. stupňa).
D
ospelá populácia vo veku 65 rokov alebo starší s AML s > 30 % blastov v kostnej dreni
Najčastejšie závažné nežiaduce reakcie (≥ 10 %) pozorované z AZA-AML-001 v rámci skupiny
s azacitidínom zahŕňali febrilnú neutropéniu (25,0 %), zápal pľúc (20,3 %) a pyrexiu (10,6 %). Iné
menej často hlásené závažné nežiaduce reakcie v skupine s azacitidínom zahŕňali sepsu (5,1 %), anémiu (4,2 %), neutropenickú sepsu (3,0 %), infekciu močových ciest (3,0 %), trombocytopéniu (2,5 %), neutropéniu (2,1 %), celulitídu (2,1 %), závrat (2,1 %) a dyspnoe (2,1 %).
Najčastejšie hlásené nežiaduce reakcie (≥ 30 %) počas liečby azacitidínom boli gastrointestinálne príhody vrátane zápchy (41,9 %), nevoľnosti (39,8 %) a hnačky (36,9 %) (zvyčajne 1. - 2. stupňa), celkové poruchy a reakcie v mieste podania vrátane pyrexie (37,7 %; zvyčajne 1. - 2.stupňa) a hematologické príhody vrátane febrilnej neutropénie (32,2 %) a neutropénie (30,1 %) (zvyčajne3. - 4. stupňa).
Zoznam nežiaducichreakcií v tabuľkeNižšie uvedená tabuľka 1 obsahuje nežiaduce reakcie súvisiace s liečbou azacitidínom získané z
hlavných klinických štúdií s MDS a AML a zo sledovania po uvedení lieku na trh.
Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti. Nežiaduce reakcie sú uvedené v tabuľke nižšie podľa najvyššej frekvencie pozorovanej v akejkoľvek z hlavných klinických štúdií.
Tabuľka 1: Nežiaduce reakcie hlásené u pacientov s MDS alebo AML liečených azacitidínom(klinické štúdie a obdobie po uvedení lieku na trh)Trieda orgánových systémov
|
Veľmi časté
|
Časté
|
Menej časté
|
Zriedkavé
|
Neznáme
|
Infekcie a nákazy
| zápal pľúc* (vrátane bakteriálneho,
vírusového
a plesňového), nazofaryngitída
| sepsa* (vrátane bakteriálnej, vírusovej
a plesňovej), neutropenická
sepsa*, infekcia dýchacích ciest (vrátane horných
dýchacích ciest a bronchitídy),
infekcia močových
ciest, celulitída, divertikulitída,
orálna plesňová
infekcia,
sinusitída, faryngitída, rinitída, herpes simplex, kožná infekcia
|
|
| nekrotizujúca fasciitída*
|
Poruchy krvi a lymfatického systému
| febrilná
neutropénia*, neutropénia, leukopénia, trombocytopénia, anémia
| pancytopénia*,
zlyhanie kostnej drene
|
|
|
|
P
oruchy imunitného systému
|
|
|
reakcie z
precitlivenosti
|
|
|
P
oruchy metabolizmu a výživy
|
anorexia, znížená chuť do jedla,
hypokaliémia
|
dehydratácia
|
|
syndróm z
rozpadu
nádoru
|
|
P
sychické poruchy
|
nespavosť
|
zmätenosť, úzkosť
|
|
|
|
P
oruchy nervového systému
|
závrat, bolesťhlavy
|
intrakraniálne krvácanie*,
synkopa, somnolencia,
letargia
|
|
|
|
P
oruchy oka
|
|
krvácanie do oka,
krvácanie do
spojoviek
|
|
|
|
P
oruchy srdca a
srdcovej činnosti
|
|
perikardiálny
výpotok
|
perikarditída
|
|
|
P
oruchy ciev
|
|
hypotenzia*, hypertenzia,
ortostatická
hypotenzia,
hematóm
|
|
|
|
P
oruchy dýchacej sústavy, hrudníkaa mediastína
|
dyspnoe, epistaxa
|
pleurálny výpotok,
námahové dyspnoe,
faryngolaryngálna bolesť
|
|
intersticiálne
ochorenie
pľúc
|
|
P
oruchy gastrointestinálneho traktu
|
hnačka, vracanie, zápcha, nevoľnosť,
bolesť brucha
(vrátane bolesti hornej časti brucha a abdominálneho diskomfortu)
|
gastrointestinálne krvácanie* (vrátane
krvácaniaz úst),
krvácanie z hemoroidov, stomatitída, krvácanie ďasien, dyspepsia
|
|
|
|
P
oruchy pečenea
ž
l
čových ciest
|
|
|
zlyhanie
pečene*, progresívna
hepatálna kóma
|
|
|
P
oruchy kože a podkožného tkaniva
|
petechie, svrbenie
(vrátane generalizovaného), vyrážka, ekchymóza
|
purpura, alopécia,
urtikária, erytém, makulárna vyrážka
|
akútna febrilná
neutrofilná dermatóza, pyoderma gangrenosum
|
|
|
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
artralgia, muskulo-
skeletálna bolesť
(vrátane chrbta, kostí
a bolesti končatín)
|
svalové spazmy,
myalgia
|
|
|
|
P
oruchy obličiek a močových ciest
|
|
renálne zlyhanie*, hematúria, zvýšená hladina sérového
kreatinínu
|
renálna tubulárna acidóza
|
|
|
C
elkové poruchy a reakcie v mieste podania
|
pyrexia*, únava, asténia, bolesť na
hrudi, erytém v mieste vpichu injekcie, bolesť v
mieste vpichu injekcie, reakcia
v mieste vpichu injekcie
(nešpecifikovaná)
|
podliatiny,
hematóm,
stvrdnutie, vyrážka, svrbenie, zápal, zmena sfarbenia kože, uzlíky a krvácanie (v mieste vpichu injekcie), malátnosť, zimnica, krvácaniev mieste zavedeniakatétra
|
|
nekróza
v mieste injekcie
(v mieste
vpichu)
|
|
L
aboratórnea
f
u
nkčné vyšetrenia
|
pokles telesnej hmotnosti
|
|
|
|
|
* = zriedkavo sa zaznamenali fatálne prípady
PopisvybranýchnežiaducichreakciíHematologické nežiaduce reakcieNajčastejšie pozorované (≥ 10 %) hematologické nežiaduce reakcie súvisiace s liečbou azacitidínom zahŕňajú anémiu, trombocytopéniu, neutropéniu, febrilnú neutropéniu a leukopéniu, zvyčajne 3. alebo
4. stupňa. V priebehu prvých 2 cyklov existuje vyššie riziko výskytu týchto reakcií, potom
sa u pacientov tieto reakcie vyskytujú s menšou frekvenciou a obnovuje sa hematologická funkcia. Väčšina hematologických nežiaducich reakcií bola kontrolovaná bežným sledovaním kompletného krvného obrazu a oneskorením podania azacitidínu v ďalšom cykle, profylaktickými antibiotikami a/alebo podľa potreby podpornou liečbou neutropénie rastovým faktorom (napr. G-CSF) a anémie alebo trombocytopénie transfúziami.
InfekcieMyelosupresia môže viesť k neutropénii a zvýšenému riziku infekcie. U pacientov dostávajúcich azacitidín boli hlásené závažné nežiaduce reakcie ako sú sepsa, vrátane neutropenickej sepsy, a zápal pľúc, pričom niektoré mali fatálny výsledok. Infekcie možno kontrolovať použitím liekov proti infekcii a podpornou liečbou neutropénie rastovým faktorom (napr. G-CSF).
KrvácanieU pacientov dostávajúcich azacitidín sa môže vyskytnúť krvácanie. Boli hlásené závažné nežiaduce
reakcie ako napríklad gastrointestinálne krvácanie a intrakraniálne krvácanie. U pacientov sa majú sledovať prejavy a príznaky krvácania, a to najmä u pacientov s existujúcou alebo s liečbou súvisiacou
trombocytopéniou.
Precitlivenosť
U pacientov dostávajúcich azacitidín boli hlásené závažné reakcie z precitlivenosti. V prípade reakcie podobnej anafylaktickej reakcii sa má liečba azacitidínom ihneď ukončiť a má sa začať vhodná
symptomatická liečba.
Nežiaduce reakcie kože a podkožného tkaniva
Väčšina nežiaducich reakcií kože a podkožného tkaniva súvisela s miestom vpichu injekcie. Žiadna
z týchto nežiaducich reakcií neviedla k prerušeniu podávania azacitidínu, ani k zníženiu dávky azacitidínu počas pivotných štúdií. Väčšina nežiaducich reakcií sa vyskytla počas prvých 2 cyklov
a v následných cykloch sa ich počet znižoval. Subkutánne nežiaduce reakcie, ako napríklad vyrážka, zápal a svrbenie v mieste vpichu injekcie, vyrážka, erytém a kožné lézie, môžu vyžadovať súbežnú liečbu napríklad antihistaminikami, kortikosteroidmi a nesteroidovými protizápalovými liekmi (non-
steroidal anti-inflammatory drugs, NSAID). Tieto kožné reakcie sa musia odlíšiť od infekcií mäkkých tkanív, ktoré sa niekedy objavujú v mieste vpichu injekcie. Po uvedení lieku na trh boli pri liečbe
azacitidínom hlásené infekcie mäkkých tkanív, vrátane celulitídy a nekrotizujúcej fasciitídy,ktoré
v zriedkavých prípadoch viedli k smrti. Pre postup pri liečbe infekčných nežiaducich reakcií, pozričasť
4.8 Infekcie.
Gastrointestinálne nežiaduce reakcie
Najčastejšie hlásené nežiaduce gastrointestinálne nežiaduce reakcie súvisiace s liečbou azacitidínom zahŕňali zápchu, hnačku, nevoľnosť a vracanie. Tieto nežiaduce reakcie boli liečené symptomaticky antiemetikami v prípade nevoľnosti a vracania, antidiaroikami v prípade hnačky a laxatívami a/alebo prípravkami na zmäkčenie stolice v prípade zápchy.
Renálne nežiaduce reakcie
U pacientov liečených azacitidínom sa zaznamenali renálne abnormality v rozsahu od zvýšenej
hladiny kreatinínu v sére a hematúrie po renálnu tubulárnu acidózu, renálne zlyhanie a úmrtie (pozri
časť 4.4).
Hepatálne nežiaduce reakcie
U pacientov s výraznou nádorovou záťažou z dôvodu metastatického ochorenia sa počas liečby azacitidínom zaznamenalo zlyhanie pečene, progresívna hepatálna kóma a úmrtie (pozri časť 4.4).
Srdcové príhody
Údaje z klinického skúšania, ktoré povolilo zaradenie pacientov so známou anamnézou kardiovaskulárneho alebo pľúcneho ochorenia, preukázali zvýšenie srdcových príhod u pacientov s novodiagnostikovanou AML liečenou azacitidínom (pozri časť 4.4).
Staršia populácia
K dispozícii je obmedzené množstvo informácií o bezpečnosti použitia azacitidínu u pacientov
≥ 85 rokov (so 14 [5,9 %] pacientmi ≥ 85 rokov v štúdii AZA-AML-001).
Pediatrická populácia
V klinickej štúdii AZA-JMML-001 užívalo 28 pediatrických pacientov (vo veku od 1 mesiaca do menej ako 18 rokov) azacitidín na liečbu MDS (n = 10) alebo liečbu juvenilnej myelomonocytovej
leukémie (JMML) (n = 18) (pozri časť 5.1).
U všetkých 28 pacientov sa vyskytla najmenej 1 nežiaduca udalosť a u 17 (60,7 %) sa vyskytla najmenej 1 udalosť súvisiaca s liečbou. Najčastejšie hlásenými nežiaducimi udalosťami v celej pediatrickej populácii boli pyrexia, hematologické udalosti vrátane anémie,
trombocytopénie a febrilnej neutropénie a gastrointestinálne udalosti vrátane zápchy a vracania.
U troch (3) účastníkov sa vyskytla počas liečby udalosť, ktorá viedla k prerušeniu podávania skúšaného lieku (pyrexia, progresia ochorenia a bolesť brucha).
V štúdii AZA-AML-004 sa 7 pediatrických pacientov (vo veku od 2 do 12 rokov) liečilo azacitidínom
5.1).
U všetkých 7 pacientov sa vyskytla minimálne 1 nežiaduca udalosť súvisiaca s liečbou. Najčastejšie hlásenými nežiaducimi udalosťami boli neutropénia, nauzea, leukopénia, trombocytopénia,
hnačka a zvýšená hladina alanínaminotransferázy (ALT). U dvoch pacientov sa vyskytla nežiaduca udalosť súvisiaca s liečbou, ktorá viedla k prerušeniu podávania dávok (febrilná neutropénia, neutropénia).
U obmedzeného počtu pediatrických pacientov liečených azacitidínom neboli počas klinického skúšania zistené žiadne nové signály týkajúce sa bezpečnosti. Celkový profil bezpečnosti zodpovedal profilu v dospelej populácii.
Hláseniepodozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePočas klinických štúdií sa vyskytol jeden prípad predávkovania azacitidínom. U tohto pacienta sa vyskytla hnačka, nevoľnosť a vracanie po podaní jednorazovej intravenóznej dávky približne
290 mg/m2, čo je takmer 4-násobok odporúčanej začiatočnej dávky.
V prípade predávkovania sa má u pacienta sledovať krvný obraz a podľa potreby sa mu má podať
podporná liečba. Nie je známa žiadna špecifická protilátka pri predávkovaní azacitidínom.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Cytostatiká, analógy pyrimidínu; ATC kód: L01BC07
Mechanizmus účinkuU azacitidínu sa predpokladá, že vykazuje svoje antineoplastické účinky pomocou viacerých mechanizmov vrátane cytotoxicity pôsobiacej na abnormálne hematopoetické bunky v kostnej dreni a hypometylácie DNA. Cytotoxické účinky azacitidínu môžu byť výsledkom viacerých mechanizmovvrátane inhibície syntézy DNA, RNA a proteínov, inkorporácie do RNA a
DNA a aktivácie dráh vedúcich k poškodeniu DNA. Neproliferujúce bunky sú relatívne necitlivé na
azacitidín. Inkorporácia azacitidínu do DNA má za následok inaktiváciu DNA metyltransferáz, čo vedie k hypometylácii DNA. Hypometylácia DNA u aberantne metylovaných génov zapojených do regulácie normálneho bunkového cyklu, diferenciácie a dráh bunkovej smrti, môže spôsobiť opätovnú exprimáciu týchto génov a obnovenie funkcií potláčajúcich tvorbu nádorov v nádorových bunkách. Relatívny význam hypometylácie DNA v porovnaní s cytotoxicitou alebo inými účinkami azacitidínu na klinické výsledky nebol stanovený.
Klinickáúčinnosť a bezpečnosťDospelá populácia (MDS, CMML a AML [20 - 30 % blastov v kostnej dreni])Účinnosť a bezpečnosť azacitidínu boli sledované v medzinárodnej, multicentrickej, kontrolovanej, otvorenej, randomizovanej, komparatívnej štúdii fázy 3 s paralelnými skupinami (AZA PH GL 2003
CL 001) u dospelých pacientov so stredne-2 a vysokorizikovým MDS podľa medzinárodného
prognostického hodnotiaceho systému (IPSS), u pacientov s refraktérnou anémious prevahou blastov (refractory anaemia with excess blasts, RAEB), u pacientov s refraktérnou anémiou s prevahou blastov v transformácii (refractory anaemia with excess blasts in transformation, RAEB-T) a u
pacientov s modifikovanou chronickou myelomonocytovou leukémiou (mCMML) podľa francúzsko- americko-britského (FAB) klasifikačného systému. Pacienti s RAEB-T (21 – 30 % blastov) sa podľa
podpornou liečbou (best supportive care, BSC); (n = 179) sa porovnával s konvenčnými režimami liečby (conventional care regimens, CCR). CCR sa skladali zo samostatnej BSC (n = 105), nízkej dávky cytarabínu a BSC (n = 49) alebo zo štandardnej indukčnej chemoterapie a BSC (n = 25). Pacienti boli pred randomizáciou zaradení svojím lekárom do 1 z 3 režimov CCR. Ak neboli pacienti randomizovaní na liečbu azacitidínom, boli liečení týmto vopred vybraným režimom. Ako súčasť kritérií pre zaradenie museli pacienti dosiahnuť výkonnostný stav podľa kritérií Eastern Cooperative Oncology Group (ECOG) na úrovni 0-2. Pacienti so sekundárnym MDS bolivylúčení zo štúdie. Primárnym koncovým ukazovateľom štúdie bolo celkové prežívanie. Azacitidín sa podával vo forme subkutánnej dávky 75 mg/m2 denne po dobu 7 dní, po ktorých nasledovala 21-dňová prestávka, (28- dňový liečebný cyklus), pričom medián počtu cyklov bol 9 (rozsah = 1 - 39) a priemerný počet cyklov bol 10,2. V rámci populácie
intent to treat (ITT, populácia všetkých randomizovaných pacientov) bol strednývek 69 rokov (rozsah bol 38 až 88 rokov).
V rámci ITT analýzy 358 pacientov (179 pacientov liečených azacitidínom a 179 liečených CCR), viedla liečba azacitidínom k mediánu prežívania 24,46 mesiacov oproti 15,02 mesiacom u pacientov liečených CCR, čo je rozdiel 9,4 mesiacov, so stratifikovanou log-rank p-hodnotou 0,0001. Miera rizika pre liečebný účinok bola 0,58 (95 % CI: 0,43; 0,77). Dvojročné miery prežívania boli 50,8 %
u pacientov dostávajúcich azacitidín oproti 26,2 % u pacientov dostávajúcich CCR (p < 0,0001).
 LEGENDA: AZA = azacitidín, CCR = konvenčné režimy liečby (conventional care regimens),CI =interval spoľahlivosti (confidence interval), HR = miera rizika (hazard ratio)
LEGENDA: AZA = azacitidín, CCR = konvenčné režimy liečby (conventional care regimens),CI =interval spoľahlivosti (confidence interval), HR = miera rizika (hazard ratio)Prínosy liečby azacitidínom v dĺžke prežívania boli konzistentné oproti všetkým možnostiam liečby
CCR (samostatne BSC, nízke dávky cytarabínu s BSC alebo štandardná indukčná
chemoterapia s BSC) použitými v kontrolnej skupine.
Pri analýze cytogenetických podskupín IPSS bol zistený podobný medián celkového prežívania vo všetkých skupinách (priaznivá, intermediálna, nepriaznivá cytogenetika, vrátane monozómie 7).
V rámci analýz vekových podskupín bol vo všetkých skupinách (< 65 rokov, ≥ 65 rokov a ≥ 75 rokov)
zistený nárast mediánu celkového prežívania.
Liečba azacitidínom bola spojená s mediánom doby do úmrtia alebo do transformácie na AML 13,0 mesiaca oproti 7,6 mesiaca u pacientov podstupujúcich liečbu CCR, čo je zlepšenieo 5,4 mesiaca so stratifikovanou log-rank p-hodnotou 0,0025.
Liečba azacitidínom bola tiež spojená s poklesom cytopénií a s nimi súvisiacich príznakov. Liečba azacitidínom viedla k zníženej potrebe transfúzie erytrocytov (red blood cell, RBC) a trombocytov.
Z pacientov v skupine liečenej azacitidínom, ktorí boli na začiatku liečby závislí od transfúzie RBC, sa
45,0 % počas liečby stalo nezávislými od transfúzie RBC v porovnaní s 11,4 %
pacientov v kombinácii skupín CCR (štatisticky významný (p < 0,0001) rozdiel bol 33,6 % (95 % CI:
22,4; 44,6)). U pacientov v skupine liečenej azacitidínom, ktorí boli na začiatku závislí od transfúzie
RBC a stali sa od nej nezávislými, bol medián doby nezávislosti od transfúzie RBC 13 mesiacov.
Odpoveď bola vyhodnotená skúšajúcim alebo nezávislou komisiou (Independet Review Committee, IRC). Celková odpoveď (úplná remisia [complete remission, CR] + čiastočná remisia [partial remission, PR]) stanovená skúšajúcim bola 29 % v skupine liečenej azacitidínom a 12 % v kombinácii skupín CCR (p = 0,0001). Celková odpoveď (CR + PR) stanovená IRC v štúdii AZA PH GL 2003 CL
001 bola 7 % (12/179) v skupine liečenej azacitidínom v porovnaní s 1 % (2/179) v kombinácii skupín
CCR (p = 0,0113). Rozdiely medzi hodnotením IRC a hodnotením skúšajúceho boli dôsledkom kritérií medzinárodnej pracovnejskupiny (International Working Group, IWG), vyžadujúcimi zlepšenie periférneho krvného obrazu a zachovanie tohto zlepšenia po dobu najmenej 56 dní.
Prínos v prežívaní bol preukázaný aj u pacientov, ktorí nedosiahli úplnú/čiastočnú odpoveď na liečbu azacitidínom. Hematologické zlepšenie (veľké alebo malé) stanovené IRC sa dosiahlo u 49 %
pacientov dostávajúcich azacitidínv porovnaní s 29 % pacientov v kombinácii skupín CCR
(p < 0,0001).
U pacientov s jednou alebo viacerými cytogenetickými abnormalitami na začiatku liečby bolopercento pacientov s veľkou cytogenetickou odpoveďou podobné v skupine s azacitidínom a v kombinácii skupín CCR. Malá cytogenetická odpoveď bola štatisticky významne (p = 0,0015)vyššia v
skupine s azacitidínom (34 %) v porovnaní s kombináciou skupín CCR (10 %).
Dospelá populácia vo veku 65 rokov alebo staršia s AML s > 30 % blastov v kostnej dreni Nižšie uvedené výsledky reprezentujú populáciu všetkých randomizovaných pacientov (ITT) študovanú v AZA-AML-001 (pozri časť 4.1 pre schválené indikácie).
Účinnosť a bezpečnosť azacitidínu boli sledované v medzinárodnej, multicentrickej, kontrolovanej, otvorenej štúdii fázy 3 s paralelnými skupinami u pacientov vo veku 65 rokov
a starších s novodiagnostikovanou AML alebo sekundárnou AML s > 30 % blastov v kostnej dreni podľa klasifikácie WHO, ktorí neboli spôsobilí na HSCT. Azacitidín spolu s BSC (n=241) sa porovnával s CCR. CCR pozostával zo samotnej BSC (n = 45), nízkej dávky cytarabínu spolu s BSC
(n = 158) alebo zo štandardnej intenzívnej chemoterapie s cytarabínom a antracyklínom spolu s BSC (n = 44). Pred randomizáciou lekár vybral pacientom 1 z 3 režimov CCR. Ak pacienti neboli
randomizovaní naliečbu azacitidínom, boli liečení vopred vybraným režimom. Ako súčasť kritérií pre zaradenie museli pacienti dosiahnuť výkonnostný stav podľa ECOG na úrovni 0-2 a vykazovať stredne alebo málo rizikové cytogenetické abnormality. Primárnym koncovým ukazovateľom štúdie
bolo celkovéprežívanie.
Azacitidín sa podával subkutánne v dávke 75 mg/m2/deň po dobu 7 dní, po ktorých nasledovala 21-
dňová prestávka (28-dňový liečebný cyklus), pričom medián počtu cyklov bol 6 (rozsah: 1 až
28), u pacientov iba s BSC bol medián počtu cyklov 3 (rozsah: 1 až 20), u pacientov s nízkou dávkou cytarabínu bol medián počtu cyklov 4 (rozsah: 1 až 25) a u pacientov soštandardnou intenzívnou
chemoterapiou bol medián počtu cyklov 2 (rozsah 1 až 3, indukčný cyklus plus 1 alebo 2 konsolidačné
cykly).
Jednotlivé východiskové parametre boli porovnateľné medzi skupinami azacitidínu a CCR. Medián veku pacientov bol 75,0 rokov (rozsah: 64 až 91 rokov), 75,2 % bolo bielej rasy a 59,0 % boli muži. Na začiatku bolo 60,7 % pacientov klasifikovaných ako AML inak nešpecifikovaná, 32,4 % ako AML
terapiou a 2,9 % pacientov ako AML s rekurentnými genetickými abnormalitami podľa klasifikácie
WHO.
V rámci ITT analýzy 488 pacientov (241 na azacitidíne a 247 na CCR) bola liečba azacitidínom spojená s mediánom prežívania 10,4 mesiacov verzus 6,5 mesiacov u pacientov liečených CCR, čo je rozdiel 3,8 mesiacov, so stratifikovanou log-rank p-hodnotou 0,1009 (dvojstranná). Miera rizika pre liečebný účinok bola 0,85 (95 % CI=0,69; 1,03). Ročné miery prežívania boli 46,5 % u pacientov liečených azacitidínom verzus 34,3 % u pacientov na CCR.
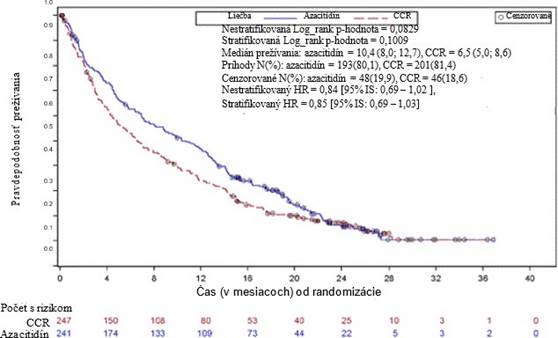
Coxov model proporcionálneho rizika upravený pre vopred špecifikované východiskové prognostické
faktory definovaný ako HR azacitidínu oproti CCR 0,80 (95 % IS= 0,66; 0,99; p = 0,0355).
Navyše, hoci cieľom štúdie nebolo preukázanie štatisticky významného rozdielu pri porovnaní azacitidínu a vopred vybraných CCR terapeutických skupín, pri liečbe pacientov azacitidínom bola dĺžka prežívania dlhšia v porovnaní s možnosťami liečby CCR - samostatnou BSC a nízkymi dávkami cytarabínu sBSC a bola podobná v porovnaní so štandardnou intenzívnou chemoterapiou s BSC.
Vo všetkých vopred definovaných podskupinách veku (˂ 75 rokov a ≥ 75 rokov), pohlavia, rasy, výkonnostného stavu ECOG (0 alebo 1 a 2), východiskového cytogenetického rizika (stredné a malé), geografického regiónu, WHO klasifikácie AML (vrátane AML so zmenami súvisiacimi s myelodyspláziou), východiskového počtu WBC (≤ 5 x 109/l a > 5 x 109/l), východiskového počtu blastov v kostnej dreni (≤ 50 % a > 50 %) a predchádzajúcej anamnézy MDS, bol trend prínosu OS
v prospech azacitidínu. V niektorých vopred definovaných podskupinách bola OS HR štatistického významu, vrátane pacientov s malým cytogenetickým rizikom, pacientov s AML so zmenami
súvisiacimi s myelodyspláziou, pacientov < 75 rokov, žien a pacientov bielej rasy.
Hematologické a cytogenetické odpovede boli vyhodnotené skúšajúcim a IRC s podobnými výsledkami. Celková miera odpovede (úplná remisia [CR] + úplná remisia s neúplným obnovením krvného obrazu [incomplete blood count recovery, CRi]), ktorú stanovila IRC, bola 27,8 % v skupine liečenej azacitidínom a 25,1 % v kombinácii skupín CCR (p = 0,5384). U pacientov, ktorí dosiahli CR alebo CRi, bola stredná doba trvania remisie u pacientov liečených azacitidínom 10,4 mesiacov (95 % CI = 7,2; 15,2) a 12,3 mesiacov (95 % CI = 9,0; 17,0) u pacientov liečených CCR. Prínos v prežívaní bol taktiež preukázaný u pacientov, ktorí nedosiahli kompletnú odpoveď pri liečbe
azacitidínom v porovnaní s CCR.
Liečba azacitidínom zlepšila periférny krvný obraz a viedla k zníženiu potreby transfúzií RBC
a trombocytov. Pacient bol považovaný za závislého na transfúzii RBC alebo trombocytov na začiatku liečby, ak mal jednu alebo viac transfúzií RBC alebo trombocytov počas 56 dní (8 týždňov) pri alebo pred randomizáciou. Pacient bol považovaný za nezávislého natransfúzii RBC alebo trombocytov počas obdobia liečby, ak nemal žiadnu transfúziu RBC alebo trombocytov počas ktorýchkoľvek 56 po sebe idúcich dní počas sledovaného obdobia.
Z pacientov v skupine s azacitidínom, ktorí boli na začiatku liečby závislí na transfúzii RBC, sa počas obdobia liečby stalo 38,5 % (95 % CI = 31,1; 46,2) nezávislých na transfúzii RBC, v porovnaní
s 27,6 % (95 % CI = 20,9; 35,1) pacientov v kombinácii skupín CCR. U pacientov, ktorí boli závislí na
transfúzii RBC na začiatku liečby a počas liečby dosiahli nezávislosť na transfúzii, bola stredná doba trvania nezávislosti na transfúzii RBC v skupine s azacitidínom 13,9 mesiacov a v skupine CCR sa nezávislosť nedosiahla.
Z pacientov v skupine s azacitidínom, ktorí boli na začiatku liečby závislí na transfúzii trombocytov,sa
počas obdobia liečby stalo 40,6 % (95 % CI = 30,9; 50,8) nezávislých na transfúzii
trombocytov, v porovnaní s 29,3 % (95 % CI = 19,7; 40,4) pacientov v kombinácii skupín CCR. U
pacientov, ktorí boli závislí na transfúzii trombocytov na začiatku liečby a počas liečby dosiahli
nezávislosť na transfúzii, bola stredná doba trvania nezávislosti na transfúzii trombocytov v skupine s
azacitidínom10,8 mesiacov a 19,2 mesiacov v skupine s CCR.
Kvalita života súvisiaca so zdravím (Health-Related Quality of Life, HRQoL) sa hodnotila pomocou dotazníka kvality života Európskej organizácie pre výskum a liečbu rakoviny (European Organization for Research and Treatment of Cancer Core Quality of Life Questionnaire, EORTC QLQ-C30). HRQoL údaje sa mohli analyzovať v podskupine celej populácie klinickej štúdie. Napriek tomu, žev analýze existujú obmedzenia, dostupné údaje naznačujú, že pacienti počas liečby azacitidínom nepociťujú významné zhoršenie kvality života.'
Pediatrická populácia
Klinická štúdia AZA-JMML-001 bola medzinárodná, multicentrická, nezaslepená klinická štúdia fázy
2 na vyhodnotenie farmakokinetiky, farmakodynamiky, bezpečnosti a aktivity azacitidínu pred HSCT
u pediatrických pacientov s novodiagnostikovanými pokročilými MDS alebo JMML. Primárnym cieľom klinickej štúdie bolo vyhodnotiť účinok azacitidínu na mieru odpovede v 28. deň 3. cyklu.
Pacienti (MDS, n = 10; JMML, n = 18; 3 mesiace až 15 rokov; 71 % muži) boli liečení intravenóznym
azacitidínom 75 mg/m² podávaným denne v 1. až 7. deň 28-dňového cyklu počas minimálne 3 cyklov
a maximálne 6 cyklov.
Zaraďovanie do ramena v rámci štúdie s MDS bolo zastavené po zaradení 10 pacientov s MDS pre nedostatočnú účinnosť: u týchto 10 pacientov neboli zaznamenané žiadne potvrdené odpovede.
Do ramena v rámci štúdie s JMML bolo zaradených 18 pacientov (13 so somatickou mutáciou génu PTPN11, 3 so somatickou mutáciou génu NRAS, 1 so somatickou mutáciou génu KRAS a 1 s klinickou diagnózou neurofibromatózy typu 1 [NF1]). Šestnásť pacientov dokončilo 3 cykly liečby a 5 z nich dokončilo 6 cyklov. Celkovo 11 pacientov s JMML preukázalo klinickú odpoveď v 28. deň 3. cyklu, pričom z týchto 11 účastníkov 9 účastníkov (50 %) preukázalo potvrdenú klinickú odpoveď (3 účastníci s cCR a 6 účastníkov s cPR). V rámci kohorty pacientov s JMML liečených azacitidínom 7 (43,8 %) pacientov malo pretrvávajúcu odpoveď týkajúcu sa krvných doštičiek (počet ≥ 100 x 109/l) a u 7 (43,8 %) pacientov sa vyžadovala transfúzia pri HSCT. 17/18 pacientov podstúpilo HSCT.
Vzhľadom na dizajn skúšania (malý počet pacientov a rôzne mätúce faktory) na základe tejto klinickej štúdie nemožno dospieť k záveru, či azacitidín pred HSCT zlepšuje výsledok prežívania u
pacientov s JMML.
Štúdia AZA-AML-004 bola multicentrická, otvorená štúdia fázy 2 na vyhodnotenie bezpečnosti, farmakodynamiky a účinnosti azacitidínu porovnávajúca režim bez protinádorovej liečby u
detí a mladých dospelých pacientov s AML pri molekulárnom relapse po CR1.
Sedem pacientov (medián veku 6,7 rokov [rozsah 2 až 12 rokov]; 71,4 % muži) sa liečilo azacitidínom intravenózne v dávke 100 mg/m² podávaným denne 1. až 7. deň 28-dňového cyklu počas maximálne
3 cyklov.
Päť pacientov malo na 84. deň hodnotenia minimálne reziduálne ochorenie (MRD, minimal residual disease), pričom 4 pacienti dosiahli molekulárnu stabilizáciu (n = 3) alebo molekulárne zlepšenie (n =
1) a u 1 pacienta došlo ku klinickému relapsu. Šiesti zo 7 pacientov (90 % [95 % CI = 0,4; 1,0])
liečených azacitidínom podstúpilo HSCT.
Vzhľadom na malú veľkosť vzorky nemožno stanoviť účinnosť azacitidínu pri pediatrickej AML. Informácie o bezpečnosti, pozri časť 4.8.
5.2 Farmakokinetické vlastnosti
Absorpcia
Po subkutánnom podaní jednorazovej dávky 75 mg/m2, sa azacitidín rýchlo absorboval s
maximálnymi plazmatickými koncentráciami 750 ± 403 ng/ml vyskytujúcimi sa po 0,5 h od podania dávky (prvý bod odberu). Absolútna biologická dostupnosť azacitidínu po subkutánnom
podaní v porovnaní s intravenóznym podaním (jednorazové dávky 75 mg/m2) bola na základe plochy
pod krivkou (AUC) približne 89 %.
Plocha pod krivkou a maximálna plazmatická koncentrácia (Cmax) subkutánneho podania azacitidínu
boli približne priamo úmerné v medziach dávky 25 až 100 mg/m2.
Distribúcia
Po intravenóznom podaní bol priemerný distribučný objem 76 ± 26 l a systémový klírens bol 147 ±
47 l/h.
Biotransformácia
Na základe údajov in vitro sa metabolizmus azacitidínu nezdá byť sprostredkovaný izoenzýmami cytochrómu P450 (CYP), UDP-glukuronozyltransferázami (UGT), sulfotransferázami (SULT) ani
glutatióntransferázami (GST).
Azacitidín podlieha spontánnej hydrolýze a deaminácii sprostredkovanej cytidín-deaminázou. V S9 frakciách z ľudskej pečene bolo vytváranie metabolitov nezávislé od NADPH, čo naznačuje, že metabolizmus azacitidínu nebol sprostredkovaný izoenzýmami cytochrómu P450. In vitro štúdia azacitidínu s kultivovanými ľudskými hepatocytmi naznačuje, že pri koncentráciách od 1,0 μmol/l až
100 μmol/l (t. j. až do 30-násobku hodnôt klinicky dosiahnuteľných koncentrácií) azacitidín
neindukuje CYP 1A2, 2C19, 3A4 ani 3A5. V štúdiách zameraných na vyhodnotenie inhibície série izoenzýmovP450 (CYP 1A2, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 a 3A4) azacitidín v koncentrácii až do
100 μmol/l nespôsoboval inhibíciu. Preto je indukcia alebo inhibícia CYP enzýmov azacitidínom pri klinicky dosiahnuteľných plazmatických koncentráciách nepravdepodobná.
Eliminácia
Azacitidín sa rýchlo vylučuje z plazmy s priemerným polčasom eliminácie (t½) 41 ± 8 minút po subkutánnom podaní. Po subkutánnom podaní 75 mg/m2 azacitidínu jedenkrát denne počas 7 dní nedochádza k jeho akumulácii. Vylučovanie močom je primárnou cestou eliminácie azacitidínu a/alebo jeho metabolitov. Po intravenóznom a subkutánnom podaní 14C-azacitidínu sa 85 a 50 % podanej rádioaktivity vylúčilo močom v uvedenom poradí, a < 1 % sa vylúčilo stolicou.
Osobitnépopulácie
Vplyv poruchy funkcie pečene (pozri časť 4.2), pohlavia, veku alebo rasy na farmakokinetické
vlastnosti azacitidínu sa oficiálne neskúmali.
Pediatrická populácia
V klinickej štúdii AZA-JMML-001 farmakokinetická analýza vychádzala z údajov u 10 pediatrických pacientov s MDS a 18 pediatrických pacientov s JMML v 7. deň 1. cyklu (pozri časť 5.1). Medián veku (rozmedzie) pacientov s MDS bol 13,3 (1,9 – 15) rokov a 2,1 (0,2 – 6,9) rokov u
pacientov s JMML.
Po intravenóznom podaní dávky 75 mg/m2 azacitidínu sa rýchlo dosiahla Cmax do 0,083
hodín u populácie s MDS aj u populácie s JMML. U pacientov s MDS bol geometrický priemer Cmax
1797,5 ng/ml a geometrický priemer AUC0-∞ bol 606,9 ng.h/ml. U pacientov s JMML bol
geometrický priemer Cmax 1066,3 ng/ml a geometrický priemer AUC0-∞ bol
240,2 ng∙h/ml. U pacientov s MDS bol geometrický priemer distribučného objemu 103,9 l a u pacientov s JMML bol geometrický priemer distribučného objemu 61,1 l. Ukázalo sa, že celková plazmatická expozícia azacitidínu bola vyššia u pacientov s MDS, avšak pri AUC aj pri Cmax bola zaznamenaná stredná až vysoká variabilita medzi pacientmi.
U pacientov s MDS bol geometrický priemer t½ 0,4 hodín a geometrický priemer klírensu bol
166,4 l/h. U pacientov s JMML bol geometrický priemer t½ 0,3 hodiny a geometrický priemer klírensu bol 148,3 l/h.
Farmakokinetické údaje zo štúdie AZA-JMML-001 sa zozbierali a porovnali s farmakokinetickými údajmi od 6 dospelých účastníkov s MDS, ktorým bol azacitidín podávaný intravenózne v dávke
75 mg/m2 v štúdii AZA 2002-BA-002. Priemerné hodnoty Cmax a AUC0-t azacitidínu boli u dospelých a pediatrických pacientov podobné po intravenóznom podaní (2 750 ng/ml oproti 2 841 ng/ml
a 1 025 ng∙h/ml oproti 882,1 ng∙h/ml v príslušnom poradí).
V štúdii AZA-AML-004 bola farmakokinetická analýza stanovená u 6 zo 7 pediatrických pacientov, ktorí mali minimálne jednu merateľnú farmakokinetickú koncentráciu po podaní dávky (pozri časť
5.1). Medián veku (rozsah) pacientov s AML bol 6,7 (2 – 12) rokov.
Po opakovaných dávkach 100 mg/m2 boli geometrické priemerné hodnoty Cmax a AUC0-tau na 7. deň 1. cyklu 1557 ng/ml a 899,6 ng∙h/ml v uvedenom poradí, s pozorovanou vysokou variabilitou medzi jednotlivými jedincami (CV % 201,6 % a 87,8 %, v uvedenom poradí). Azacitidín rýchlo dosiahol Cmax, pričom medián času bol 0,090 hodín po intravenóznom podaní a klesal, pričom geometrický priemer t½ bol 0,380 hodín. Geometrické priemery klírensu a distribučného objemu boli
127,2 l/h a 70,2 l, v uvedenom poradí.
Farmakokinetická expozícia (azacitidínu) pozorovaná u detí s AML pri molekulárnom relapse po CR1 bola porovnateľná s expozíciou zo súhrnných údajov10 detí s MDS a 18 detí s JMML a bola porovnateľná aj s expozíciou azacitidínu u dospelých s MDS.
Porucha funkcie obličiek
Porucha funkcie obličiek nemá významný vplyv na farmakokinetickú expozíciu azacitidínu po
jednorazovom a mnohonásobnom subkutánnom podaní. Po subkutánnom podaní jednorazovej dávky
75 mg/m2, sa priemerné hodnoty expozície (AUC a Cmax) u pacientov s miernou, stredne ťažkou alebo ťažkou poruchou funkcie obličiek zvýšili o 11 - 21 %, 15 - 27 %, a 41 – 66 %, v porovnaní s pacientmi
s normálnou funkciou obličiek. Avšak, expozícia bola v rámci rovnakého všeobecného rozmedzia expozícií pozorovaná u pacientov s normálnou funkciou obličiek. Azacitidín môže byť podávaný pacientom s poruchou funkcie obličiek bez úpravy úvodnej dávky za predpokladu, že títo pacienti sú sledovaní na toxicitu, pretože azacitidín a/alebo jeho metabolity sa primárne vylučujú obličkami.
Farmakogenomika
Účinok známeho polymorfizmu cytidín-deaminázy na metabolizmus azacitidínu sa oficiálne
neskúmal.
5.3 Predklinické údaje o bezpečnosti
Azacitidín indukuje génové mutácie aj chromozómové aberácie v bunkových systémoch baktériía
vyvolával nádory hematopoetického systému u samíc myší pri intraperitoneálnom podávaní 3-krát týždenne po dobu 52 týždňov. Zvýšený výskyt nádorov v lymforetikulárnom systéme, pľúcach, mliečnych žľazách a koži bol pozorovaný u myší, ktorým bol podávaný azacitidín intraperitoneálne po dobu 50 týždňov. Štúdia tumorigenicity u potkanov odhalila zvýšený výskyt testikulárnych nádorov.
Štúdie zamerané na skorú embryotoxicitu u myší odhalili 44 % výskyt vnútromaternicových embryonálnych úmrtí (zvýšená resorpcia) po podaní jednorazovej intraperitoneálnej injekcie azacitidínu počas organogenézy. U myší, ktorým sa podával azacitidín v čase uzatvorenia tvrdého podnebia alebo pred ním, boli zistené vývojové abnormality mozgu. U potkanov azacitidín nespôsobil žiadne nežiaduce reakcie pri podávaní pred uhniezdením oplodneného vajíčka, bol však jednoznačne embryotoxický pri podávaní počas organogenézy. Abnormality plodu počas organogenézy u potkanov zahŕňajú anomálie centrálneho nervového systému (exencefália/encefalokéla), anomálie končatín (mikromélia, vbočená noha, syndaktýlia, oligodaktýlia) a iné (mikroftalmia, mikrognatia,gastroschíza, edém a abnormality rebier).
Podávanie azacitidínu samcom myší pred párením s neliečenými samicami myší viedlo k zníženiu plodnosti a strate potomstva počas následného embryonálneho a postnatálneho vývoja. Liečba samcov potkanov viedla k zníženiu hmotnosti semenníkov a nadsemenníkov, zníženiu počtu spermií, zníženiu frekvencie gravidity, zvýšeniu počtu abnormálnych embryí a k zvýšeným stratám
embryí u oplodnených samíc (pozri časť 4.4).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol (E421)
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Neotvorenáinjekčnáliekovka s práškom:
36 mesiacov
Po rekonštitúcii:
Keď sa Azacitidine Glenmark rekonštituuje pomocou vody na injekcie, ktorá sa
neuchovávala v chladničke, chemická a fyzikálna stabilita rekonštituovaného lieku počas používania
bola preukázaná pri teplote 25 °C po dobu 45 minút a pri teplote 2 °C až 8 °C po dobu 8 hodín.
Čas použiteľnosti rekonštituovaného lieku sa môže predĺžiť rekonštitúciou pomocou chladenej (2 °C
až 8 °C) vody na injekcie. Keď sa Azacitidine Glenmark rekonštituuje pomocou chladenej (2 °C až
8 °C) vody na injekcie, chemická a fyzikálna stabilita rekonštituovaného lieku počas používania bola preukázanápri teplote 2 °C až 8 °C po dobu 32 hodín.
Z mikrobiologického hľadiska sa má rekonštituovaný liek použiť okamžite. Ak sa nepoužije okamžite,
za čas a podmienky uchovávania pred použitím zodpovedá používateľ, avšak nesmie byť dlhší ako
8 hodín pri teplote 2 °C až 8 °C, keď sa rekonštituoval pomocou vody na injekcie, ktorá sa
neuchovávala v chladničke a nie dlhší ako 32 hodín, keď sa rekonštituoval chladenou (2 °C až 8 °C)
vodou na injekcie.
6.4 Špeciálne upozornenia na uchovávanie
Neotvorenéinjekčnéliekovky
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
R
ekonštituovaná
suspenzia
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaBezfarebná sklenená injekčná liekovka uzatvorená sivou zátkou z butylovej gumy s hliníkovým tesnením (bielym pre 100 mg a oranžovým pre 150 mg balenie).
Veľkosti balenia:
1 injekčná liekovka obsahujúca 100 mg
1 injekčná liekovka obsahujúca 150 mg
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomOdporúčanianabezpečnézaobchádzanie s liekomAzacitidine Glenmark je cytotoxický liek a rovnako ako v prípade iných potenciálne toxických zlúčenín sa počas zaobchádzania a prípravy suspenzie azacitidínu musí postupovať opatrne. Je potrebné dodržiavať postupy na bezpečné zaobchádzanie a likvidáciu protinádorových liekov. Ak dôjde ku kontaktu rekonštituovaného azacitidínu s kožou, zasiahnuté miesto okamžite a dôkladne umyte mydlom a vodou. Ak sa dostane do kontaktu so sliznicami, zasiahnuté miesto dôkladne opláchnite vodou.
Tehotný personál nesmie zaobchádzať s týmto liekom.
Postup rekonštitúcieAzacitidine Glenmark sa má rekonštituovať vodou na injekcie. Čas použiteľnosti rekonštituovaného
lieku sa môže predĺžiť rekonštitúciou pomocou chladenej (2 °C až 8 °C) vody na injekcie. Podrobnosti o uchovávaní rekonštituovaného lieku sú uvedené v časti 6.3.
1. Pripravte si nasledovné pomôcky:
Injekčnú liekovku (injekčné liekovky) s azacitidínom; injekčnú liekovku (injekčné
liekovky) s vodou na injekcie; nesterilné chirurgické rukavice; alkoholové tampóny; injekčnú striekačku (injekčné striekačky) s ihlou (ihlami).
2. Odoberte príslušný objem vody na injekcie do injekčnej striekačky (pozri tabuľku
nižšie) a dbajte na vytlačenie všetkého vzduchu zo striekačky.
Injekčná striekačka obsahuje
| Objem vody na injekcie
| Konečná koncentrácia
|
100 mg
| 4 ml
| 25 mg/ml
|
150 mg
| 6 ml
| 25 mg/ml
|
3. Zasuňte ihlu injekčnej striekačky obsahujúcej vodu na injekcie cez gumené tesnenie do
injekčnej liekovky s azacitidínom a vstreknite vodu na injekcie do injekčnej liekovky.
4. Vytiahnite injekčnú striekačku a ihlu a silno pretrepte injekčnú liekovku, až kým sa nevytvorí homogénna zakalená suspenzia. Po rekonštitúcii obsahuje každý ml suspenzie 25 mg azacitidínu (100 mg/4 ml alebo 150 mg/6 ml). Rekonštituovaný liek je homogénna, zakalená suspenzia, bez aglomerátov.
Aksuspenziaobsahujeveľkéčasticealeboaglomeráty,trebajuzlikvidovať.Porekonštitúciisuspenziunefiltrujte,mohlobysatýmodstrániťliečivo.Musísazohľadniť,žefiltresanachádzajúvniektorýchadaptéroch,ihláchauzatvorenýchsystémoch;pretonapodanieliekuporekonštitúciisatakétosystémynemajúpoužívať.5. Očistite gumené tesnenie a zasuňte novú injekčnú striekačku s ihlou do injekčnej liekovky.
Prevráťte injekčnú liekovku hore dnom, pričom dbajte na to, aby bol hrot ihly pod hladinou
tekutiny. Potiahnutím piesta dozadu natiahnite množstvo lieku požadované pre správnu
dávku a dbajte na vytlačenie všetkého vzduchu zo striekačky. Vytiahnite injekčnú striekačku s
ihlou z injekčnej liekovky a ihlu zlikvidujte.
nemá plniť pred injekčnou aplikáciou, aby sa znížil výskyt lokálnych reakcií v mieste vpichu.
7. Pre 150 mg = 6 ml dávku, sa má použiť 150 mg injekčná liekovka. V dôsledku
retencie v injekčnej liekovke a ihle nemusí byť možné natiahnuť všetku suspenziu z injekčnej
liekovky.
8. Obsah dávkovacej injekčnej striekačky sa musí premiešať tesne pred podaním. Injekčná striekačka naplnená rekonštituovanou suspenziou sa má pred podaním nechať po dobu do 30 minút dosiahnuť teplotu približne 20 °C - 25 °C. Ak uplynie viac než 30 minút, suspenzia sa musí príslušným spôsobom zlikvidovať a musí sa pripraviť nová dávka. Na premiešanie rýchlo rolujte injekčnú striekačku medzi dlaňami dovtedy, kým sa nevytvorí homogénna, zakalená suspenzia.
Aksuspenziaobsahujeveľkéčasticealeboaglomeráty,trebajuzlikvidovať.VýpočetindividuálnejdávkyCelkovú dávku podľa plochy povrchu tela (body surface area, BSA) možno vypočítať nasledovne: Celková dávka (mg) = dávka (mg/m2) x BSA (m2)
Nasledujúca tabuľka je uvedená iba ako príklad výpočtu individuálnych dávok azacitidínu na základe
priemernej hodnoty BSA na úrovni 1,8 m2.
Dávka mg/m2
(% odporúčanej začiatočnej dávky)
| Celková dávka
na základe
hodnoty BSA
1,8 m2
| Požadovaný počet injekčných
liekoviek
| Celkový potrebný
objem
rekonštituovanej
suspenzie
|
100 mg
injekčná
liekovka
| 150 mg
injekčná
liekovka
|
75 mg/m2
(100 %)
| 135 mg
| 2 injekčné
liekovky
| 1 injekčná
liekovka
| 5,4 ml
|
37,5 mg/m2
(50 %)
| 67,5 mg
| 1 injekčná
liekovka
| 1 injekčná
liekovka
| 2,7 ml
|
25 mg/m2
(33 %)
| 45 mg
| 1 injekčná
liekovka
| 1 injekčná
liekovka
| 1,8 ml
|
SpôsobpodávaniaRekonštituovaný Azacitidine Glenmark sa má podávať subkutánnou injekciou (ihlu zaveďte pod
uhlom 45 – 90°) do ramena, stehna alebo brucha použitím injekčnej ihly s kalibrom 25.
Dávky väčšie než 4 ml sa majú injekčne aplikovať do dvoch rôznych miest vpichu.Miesta injekčnej aplikácie sa majú meniť. Nové injekcie sa majú aplikovať najmenej 2,5 cm od
predchádzajúceho miesta vpichu a nikdy nie do oblastí, v ktorých je miesto vpichu
bolestivé, s podliatinami, začervenané alebo stvrdnuté.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIGlenmark Pharmaceuticals s.r.o., Hvězdova 1716/2b, 140 78 Praha 4, Česká republika
8. REGISTRAČNÉ ČÍSLO44/0280/21-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU
11/2021