vyššie je riziko gravidity.
· 8.-14. deň
Používateľka musí užiť poslednú vynechanú tabletu hneď ako si spomenie, aj keby to znamenalo užitie dvoch tabliet súčasne. Potom pokračuje v užívaní tabliet vo zvyčajnom čase. Ak žena užívala tablety počas siedmich dní pred prvou vynechanou tabletou správne, ďalšie antikoncepčné opatrenia nie sú potrebné. Ak však vynechala viac ako jednu tabletu, musí sa jej odporučiť použitie ďalšieho opatrenia počas siedmich dní.
· 15.-24. deň
Vzhľadom na nastávajúcu fázu užívania placebo tabliet je bezprostredné nebezpečenstvo zníženia spoľahlivosti antikoncepcie. Aj tak však možno upravením schémy užívania tabliet predísť zníženiu antikoncepčnej ochrany. Pri dodržaní niektorého z dvoch nasledovných možných postupov, nie je potrebné používať ďalšie antikoncepčné opatrenia za predpokladu, že počas siedmich dní pred vynechaním prvej tablety používateľka užila všetky tablety správne. Ak to tak nie je, musí používateľka zvoliť prvú z nasledovných dvoch možností a použiť navyše ďalšie opatrenia počas nasledujúcich siedmych dní.
1. Používateľka musí užiť poslednú vynechanú tabletu hneď, ako si spomenie, aj keby to znamenalo užitie dvoch tabliet súčasne.
Potom pokračuje v užívaní tabliet vo zvyčajnom čase, až kým nedoužíva aktívne tablety. Štyri placebo tablety z posledného radu sa musia odstrániť. Okamžite sa musí začať užívanie z nasledujúceho blistrového balenia. Krvácanie z vysadenia sa pravdepodobne nedostaví pred doužívaním všetkých aktívnych tabliet z druhého blistra, ale počas užívania tabliet môže nastať špinenie alebo medzimenštruačné krvácanie.
2. Používateľke možno tiež poradiť, aby prerušila užívanie aktívnych tabliet zo súčasne používaného blistrového balenia. Potom musí užívať placebo tablety z posledného radu počas 4 dní vrátane dní, kedy tablety vynechala a následne pokračuje v užívaní z ďalšieho blistrového balenia.
Ak používateľka zabudne užiť tablety a následne sa nedostaví krvácanie z vysadenia vo fáze užívania placebo tabliet, musí sa zvážiť možnosť gravidity.
Postup v prípade gastrointestinálnych ťažkostíV prípade závažných gastrointestinálnych ťažkostí (napr. vracania alebo hnačky) nemusí byť vstrebávanie úplné a musia sa použiť ďalšie antikoncepčné opatrenia. Ak počas 3-4 hodín po užití aktívnej tablety dôjde k vracaniu, musí sa čo najskôr užiť nová (náhradná) tableta. Ak je to možné, nová tableta sa má užiť do 24 hodín od zvyčajného času užívania tablety. V prípade, že uplynulo viac ako 24 hodín, ohľadom vynechaných tabliet sa postupuje podľa pokynov, uvedených v časti 4.2 „Postup pri vynechaní tabliet“. Ak používateľka nechce meniť zvyčajnú schému užívania tabliet, musí užiť naviac tabletu (tablety) z ďalšieho blistrového balenia.
Ako posunúť krvácanie z vysadeniaAk si používateľka praje oddialiť menštruáciu, musí pokračovať v užívaní tabliet z ďalšieho blistrového balenia lieku Xanthadu bez užívania placebo tabliet zo súčasne používaného blistra. Odďaľovať menštruáciu možno až do doužívania aktívnych tabliet z druhého blisra. Počas tohto času sa u používateľky môže objaviť medzimenštruačné krvácanie alebo špinenie. Po fáze užívania placebo tabliet sa potom obnoví pravidelné užívanie lieku Xanthadu.
Ak si používateľka praje presunúť menštruáciu na iný deň v týždni, než na aký je zvyknutá v doterajšej schéme užívania, možno jej odporučiť, aby skrátila nasledujúcu fázu užívania placebo tabliet o toľko dní, o koľko si praje. Čím kratší bude interval, tým väčšie je riziko, že nedôjde ku krvácaniu z vysadenia a že počas užívania z nasledujúceho blistra sa vyskytne medzimenštruačné krvácanie a špinenie (podobne ako pri oddialení menštruácie).
4.3 KontraindikácieKombinované hormonálne kontraceptíva (CHC) nemožno užívať v prípade výskytu niektorého z nižšie uvedených stavov. Ak sa niektorý z týchto stavov objaví prvýkrát v priebehu užívania CHC, užívanie sa musí okamžite prerušiť.
• Prítomnosť alebo riziko vzniku venóznej tromboembólie (VTE)
○ Venózna tromboembólia - prítomná VTE (liečená antikoagulanciami) alebo v anamnéze (napr. trombóza hĺbkových žíl [DVT] alebo pľúcna embólia [PE]).
○ Známa dedičná alebo získaná predispozícia na vznik venóznej tromboembólie, ako napríklad rezistencia voči APC (vrátane faktora V Leiden), deficiencia antitrombínu-III, deficiencia proteínu C, deficiencia proteínu S.
○ Závažný chirurgický zákrok s dlhodobou imobilizáciou (pozri časť 4.4).
○ Vysoké riziko vzniku venóznej tromboembólie z dôvodu prítomnosti viacerých rizikových faktorov (pozri časť 4.4).
• Prítomnosť alebo riziko vzniku arteriálnej tromboembólie (ATE)
○ Arteriálna tromboembólia - prítomná arteriálna tromboembólia, arteriálna tromboembólia v anamnéze (napríklad infarkt myokardu) alebo stav, ktorý je jej skorým príznakom (napríklad
angina pectoris).
○ Cievne mozgové ochorenie - prítomná cievna mozgová príhoda, cievna mozgová príhoda v anamnéze alebo stav, ktorý je jej skorým príznakom (napríklad prechodný ischemický záchvat, TIA).
○ Známa vrodená alebo získaná predispozícia na vznik arteriálnej tromboembólie, ako napríklad hyperhomocysteinémia a antifosfolipidové protilátky (antikardiolipínové protilátky, lupusové antikoagulancium).
○ Migréna s ložiskovými neurologickými symptómami v anamnéze.
○ Vysoké riziko vzniku arteriálnej tromboembólie z dôvodu viacerých rizikových faktorov (pozri časť 4.4) alebo prítomnosti jedného závažného rizikového faktora, ako napríklad:
• diabetes mellitus s cievnymi symptómami,
• závažná hypertenzia,
• závažná dyslipoproteinémia.
· Závažné ochorenie pečene, prítomné alebo v anamnéze, až do návratu pečeňových funkcií na referenčné hodnoty
· Závažná obličková nedostatočnosť alebo akútne zlyhanie obličiek
· Existujúce nádory pečene (benígne alebo malígne) alebo ich výskyt v anamnéze
· Diagnostikované malignity závislé od pohlavných steroidov alebo podozrenie na ne (napr. pohlavných orgánov alebo prsníka)
· Vaginálne krvácanie s nediagnostikovanou príčinou
· Precitlivenosť na liečivá alebo na niektorú z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníUpozorneniaAk je prítomný ktorýkoľvek zo stavov alebo rizikových faktorov uvedených nižšie, vhodnosť užívania lieku Xanthadu sa má s danou ženou prekonzultovať. Ženu treba upozorniť, že ak dôjde k zhoršeniu alebo prvému prejavu ktoréhokoľvek z týchto stavov alebo rizikových faktorov, má sa obrátiť na svojho lekára, ktorý určí, či má ukončiť užívanie lieku Xanthadu.
V prípade suspektnej alebo potvrdenej VTE alebo ATE, užívanie kombinovanej perorálnej antikoncepcie sa má ukončiť. Ak sa začne s antikoagulačnou liečbou, má sa začať s adekvátnou alternatívnou antikoncepciou kvôli teratogenite antikoagulačnej liečby (kumaríny).
Poruchy cirkulácieRiziko vzniku venóznej tromboembólie (VTE)Používanie ktorejkoľvek kombinovanej hormonálnej antikoncepcie zvyšuje riziko vzniku venóznej tromboembólie (VTE) v porovnaní s jej nepoužívaním.
Lieky, ktoré obsahujú levonorgestrel, norgestimát alebo noretisterón, sú spojené s najnižším rizikom vzniku VTE. Iné lieky, ako je Xanthadu, môžu mať toto riziko až dvojnásobne vyššie. Rozhodnutie používať ktorýkoľvek iný liek, ako liek s najnižším rizikom vzniku VTE, sa má urobiť len po konzultácii s danou ženou, aby sa zaručilo, že rozumie riziku vzniku VTE pri užívaní lieku Xanthadu, ako jeho aktuálne rizikové faktory ovplyvňujú toto riziko, a že riziko vzniku VTE je najvyššie v prvom roku jej užívania. Sú taktiež aj určité dôkazy o tom, že sa toto riziko zvyšuje pri opätovnom začatí užívania kombinovanej hormonálnej antikoncepcie po prerušení používania trvajúcom 4 týždne alebo dlhšie.U približne 2 z 10 000 žien, ktoré nepoužívajú kombinovanú hormonálnu antikoncepciu a nie sú gravidné, vznikne VTE v priebehu jedného roka. Avšak u každej jednej ženy môže byť toto riziko oveľa vyššie v závislosti od prítomných rizikových faktorov (pozri nižšie).
Odhaduje sa
1, že VTE sa vyskytne v priebehu jedného roka u 9 až 12 žien z 10 000 žien, ktoré používajú kombinovanú hormonálnu antikoncepciu obsahujúcu drospirenón, v porovnaní s približne 6
2 ženami, ktoré užívajú kombinovanú hormonálnu antikoncepciu obsahujúcu levonorgestrel.
V oboch prípadoch je počet výskytov VTE za rok nižší ako počet očakávaný u žien počas gravidity alebo v období po pôrode.
VTE sa môže v 1 až 2 % prípadov skončiť smrťou.
_____________________________
1 Tieto incidencie boli odhadnuté zo všetkých dát z epidemiologických štúdií, použitím relatívnych rizík pre rôzne lieky v porovnaní s kombinovanou hormonálnou antikoncepciou obsahujúcou levonorgestrel.
2 Stredný bod rozpätia 5-7 (prípadov) na 10 000 ženských rokov (ŽR), založený na relatívnom riziku kombinovanej hormonálnej antikoncepcie obsahujúcej levonorgestrel oproti 2,3 až 3,6 u nepoužívateliek.
Počet prípadov VTE na 10 000 žien v priebehu jedného roka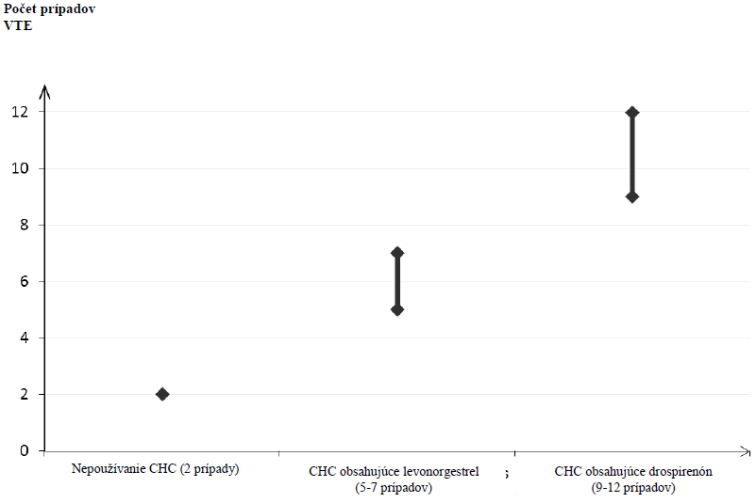
_________________
U používateliek kombinovanej hormonálnej antikoncepcie bol mimoriadne zriedkavo hlásený výskyt trombózy v iných krvných cievach, napr. v pečeňových, mezenterických, obličkových alebo sietnicových žilách a tepnách.
Rizikové faktory vzniku VTE Riziko vzniku venóznych tromboembolických komplikácií u používateliek kombinovanej hormonálnej antikoncepcie sa môže značne zvýšiť v prípade ženy s ďalšími rizikovými faktormi, najmä ak má viacero rizikových faktorov (pozri tabuľku).
Xanthadu je kontraindikovaný, ak má žena viacero rizikových faktorov, ktoré ju vystavujú vysokému riziku vzniku venóznej trombózy (pozri časť 4.3). Ak má žena viac ako jeden rizikový faktor, zvýšenie rizika môže byť väčšie než súčet jednotlivých faktorov - v takomto prípade sa má zvážiť jej celkové riziko výskytu VTE. Ak sa pomer prínosov a rizík považuje za negatívny, kombinovaná hormonálna antikoncepcia sa nemá predpisovať (pozri časť 4.3).
Tabuľka: Rizikové faktory pre vznik VTERizikový faktor
| Komentár
|
Obezita (index telesnej hmotnosti nad 30 kg/m²)
| Riziko sa výrazne zvyšuje so zvyšovaním BMI.
Obzvlášť dôležité je to zvážiť, ak sú prítomné aj ďalšie rizikové faktory.
|
Dlhodobá imobilizácia, závažný chirurgický zákrok, akýkoľvek chirurgický zákrok na nohách alebo panve, neurochirurgický zákrok alebo závažný úraz.
Poznámka: dočasná imobilizácia vrátane cestovania leteckou dopravou trvajúcou >4 hodiny môže byť tiež rizikovým faktorom pre vznik VTE, najmä u žien s ďalšími rizikovými faktormi.
| V týchto prípadoch sa odporúča prerušiť používanie náplasti/tablety/krúžku (v prípade plánovaného chirurgického zákroku najmenej štyri týždne pred zákrokom) a pokračovať v ňom najskôr dva týždne po
úplnom obnovení pohyblivosti. Má sa používať iný spôsob antikoncepcie, aby sa zabránilo neželanej gravidite.
Ak sa užívanie lieku Xanthadu nepreruší včas, má sa zvážiť antitrombotická liečba.
|
Pozitívna rodinná anamnéza (akýkoľvek výskyt venóznej tromboembólie u súrodenca alebo rodiča, najmä v relatívne skorom veku, napr. do 50 rokov).
| Ak existuje podozrenie na dedičnú predispozíciu, žena sa má pred rozhodnutím o používaní ktorejkoľvek kombinovanej hormonálnej antikoncepcie poradiť s odborným lekárom.
|
Iné zdravotné stavy spojené s VTE
| Rakovina, systémový lupus erythematosus, hemolyticko-uremický syndróm, chronické zápalové ochorenie čriev (Crohnova choroba alebo ulcerózna kolitída) a kosáčikovitá anémia
|
Zvyšujúci sa vek
| Najmä nad 35 rokov
|
Neexistuje žiadna zhoda ohľadom možnej úlohy kŕčových žíl a povrchovej tromboflebitídy pri vzniku alebo progresii venóznej trombózy.
Musí sa zvážiť zvýšené riziko vzniku tromboembólie počas gravidity a najmä počas 6-týždňového obdobia šestonedelia (informácie o „Fertilite, gravidite a laktácii“, pozri časť 4.6).
Príznaky VTE (trombóza hĺbkových žíl a pľúcna embólia) Žená má byť poučená, aby v prípade príznakov vyhľadala okamžitú lekársku pomoc a informovala zdravotníckeho pracovníka, že užíva kombinovanú hormonálnu antikoncepciu.
Príznaky trombózy hĺbkových žíl (DVT) môžu zahŕňať:
– jednostranný opuch nohy a/alebo chodidla alebo pozdĺž žily v nohe,
– bolesť alebo citlivosť v nohe, ktorú možno pociťovať iba v stoji alebo pri chôdzi,
– zvýšené teplo v postihnutej nohe, sčervenanie alebo zmena sfarbenia pokožky na nohe.
Príznaky pľúcnej embólie (PE) môžu zahŕňať:
– náhly nástup nevysvetliteľnej dýchavičnosti alebo rýchleho dýchania,
– náhly kašeľ, ktorý môže súvisieť s hemoptýzou,
– ostrú bolesť v hrudníku,
– závažný pocit točenia hlavy alebo závrat,
– rýchly alebo nepravidelný srdcový rytmus.
Niektoré z týchto príznakov (napríklad „dýchavičnosť“, „kašeľ“) sú nešpecifické a môžu byť nesprávne interpretované ako častejšie alebo menej závažné udalosti (napríklad infekcie dýchacích ciest).
Medzi ďalšie prejavy vaskulárnej oklúzie môžu patriť: náhla bolesť, opuch a mierne zmodranie niektorej končatiny.
Ak dôjde k oklúzii v oku, medzi symptómy môžu patriť bezbolestné rozmazané videnie, ktoré môže postupne prechádzať až do straty zraku. Niekedy môže dôjsť k strate zraku takmer okamžite.
Riziko vzniku arteriálnej tromboembólie (ATE) Epidemiologické štúdie spájajú používanie kombinovanej hormonálnej antikoncepcie so zvýšeným rizikom vzniku arteriálnej tromboembólie (infarkt myokardu) alebo cievnej mozgovej udalosti (napr. prechodný ischemický záchvat, cievna mozgová príhoda). Arteriálne tromboembolické udalosti sa môžu končiť smrťou.
Rizikové faktory pre vznik ATE Riziko vzniku arteriálnych tromboembolických komplikácií alebo cerebrovaskulárnej udalosti u používateliek kombinovanej hormonálnej antikoncepcie sa zvyšuje u žien s rizikovými faktormi (pozri tabuľku). Xanthadu je kontraindikovaný, ak má žena jeden závažný alebo viacero rizikových faktorov vzniku ATE, ktoré ju vystavujú vysokému riziku vzniku arteriálnej trombózy (pozri časť 4.3). Ak má žena viac než jeden rizikový faktor, zvýšenie rizika môže byť väčšie než súčet jednotlivých faktorov - v takomto prípade sa má zvážiť jej celkové riziko. Ak sa pomer prínosov a rizík považuje za negatívny, kombinovaná hormonálna antikoncepcia sa nemá predpisovať (pozri časť 4.3).
Tabuľka: Rizikové faktory vzniku ATERizikový faktor
| Komentár
|
Zvyšujúci sa vek
| Najmä nad 35 rokov
|
Fajčenie
| Ženám sa má odporučiť, aby nefajčili, ak chcú používať kombinovanú hormonálnu antikoncepciu. Ženám vo veku nad 35 rokov, ktoré pokračujú vo fajčení, sa má dôrazne odporučiť, aby používali iný spôsob antikoncepcie.
|
Hypertenzia
|
|
Obezita (index telesnej hmotnosti nad 30 kg/m²).
| Riziko sa výrazne zvyšuje so zvyšovaním BMI.
To je dôležité najmä u žien s ďalšími rizikovými faktormi.
|
Pozitívna rodinná anamnéza (akýkoľvek výskyt arteriálnej tromboembólie u súrodenca alebo rodiča, najmä v relatívne mladom veku, napr. do 50 rokov).
| Ak existuje podozrenie na dedičnú predispozíciu, ženu musí pred rozhodnutím o používaní ľubovoľnej kombinovanej hormonálnej antikoncepcie vyšetriť odborný lekár.
|
Migréna
| Zvýšenie frekvencie alebo závažnosti migrény v priebehu používania kombinovanej hormonálnej antikoncepcie (čo môžu byť skoré príznaky cievnej mozgovej príhody) môže byť dôvodom na okamžité prerušenie používania lieku.
|
Ďalšie zdravotné stavy spojené s nežiaducimi vaskulárnymi udalosťami.
| Diabetes mellitus, hyperhomocysteinémia, ochorenie srdcových chlopní a atriálna fibrilácia, dyslipoproteinémia a systémový lupus erythematosus.
|
Príznaky ATE V prípade príznakov sa má žene odporučiť, aby bezodkladne vyhľadala lekársku pomoc a informovala zdravotníckeho pracovníka, že používa kombinovanú hormonálnu antikoncepciu.
Príznaky cievnej mozgovej príhody môžu zahŕňať:
– náhla strata citlivosti alebo slabosť tváre, ruky alebo nohy, najmä na jednej strane tela,
– náhle problémy s chôdzou, závrat, strata rovnováhy alebo koordinácie,
– náhla zmätenosť, problémy s rečou alebo jej porozumením,
– náhle problémy so zrakom u jedného alebo oboch očí,
– náhla, závažná alebo dlhodobá bolesť hlavy bez známej príčiny,
– strata vedomia alebo mdloba so záchvatom alebo bez neho.
Dočasné príznaky naznačujú, že udalosťou je prechodný ischemický záchvat (TIA).
Príznaky infarktu myokardu (MI) môžu zahŕňať:
– bolesť, nepohodlie, tlak, ťažoba, pocit stláčania alebo plnosti v hrudi, ruke alebo pod hrudnou kosťou,
– nepohodlie vyžarujúce do chrbta, čeľuste, hrdla, ruky, žalúdka,
– pocit plnosti, zažívacích problémov alebo dusenia sa,
– potenie, nevoľnosť, vracanie alebo závrat,
– extrémna slabosť, úzkosť alebo dýchavičnosť,
– rýchly alebo nepravidelný srdcový rytmus.
NádoryV niektorých epidemiologických štúdiách sa hlásilo zvýšené riziko rakoviny krčka maternice u dlhodobých používateliek COC (> 5 rokov), pretrváva však rozdielnosť názorov na to, do akej miery sa dajú tieto nálezy pripísať následkom sexuálneho správania a iným faktorom, ako je ľudský papiloma vírus (HPV).
Metaanalýza 54 epidemiologických štúdií uvádza, že sa mierne zvýšilo relatívne riziko (RR = 1,24) rakoviny prsníka diagnostikovanej u žien počas užívania COC. Zvýšené riziko postupne klesá v priebehu 10 rokov po ukončení užívania COC. Pretože výskyt rakoviny prsníka je u žien do 40 rokov zriedkavý, zvýšený počet prípadov diagnostikovanej rakoviny prsníka u žien, ktoré užívajú alebo užívali COC je v pomere k celkovému riziku rakoviny prsníka malý. Kauzalitu tieto štúdie nedokazujú. Pozorované zvýšenie rizika môže byť zapríčinené skoršou diagnózou rakoviny prsníka u používateliek COC, biologickými účinkami COC alebo ich kombináciou. Rakovina prsníka diagnostikovaná u žien, ktoré niekedy COC užívali, býva klinicky menej rozvinutá ako u žien, ktoré COC neužívali nikdy.
V zriedkavých prípadoch sa u žien užívajúcich COC hlásili benígne nádory pečene a ešte zriedkavejšie malígne nádory pečene. V ojedinelých prípadoch viedli tieto nádory k život ohrozujúcemu intraabdominálnemu krvácaniu. V prípade výskytu silných bolestí v hornej časti abdominálnej oblasti, zväčšenia pečene alebo prejavov intraabdominálneho krvácania u žien užívajúcich COC sa v diferenciálnej diagnóze musí uvažovať o nádore pečene.
Pri použití vyššie dávkovaných COC (50 µg etinylestradiolu) sa znižuje riziko rakoviny endometria a vaječníkov. Zostáva potvrdiť, či sa to vzťahuje aj na nižšie dávkované COC.
Ostatné stavy Gestagénová zložka lieku Xanthadu je antagonista aldosterónu s kálium šetriacimi vlastnosťami. Vo väčšine prípadov sa nepredpokladá zvýšenie koncentrácií draslíka. V klinickej štúdii sa však v priebehu užívania drospirenónu u niektorých pacientok s miernym alebo stredne závažným poškodením obličiek a súbežne užívajúcich lieky šetriace draslík koncentrácie draslíka v sére mierne, ale nevýznamne zvýšili. U pacientok s obličkovou nedostatočnosťou a k hornej hranici sa blížiacimi hodnotami draslíka v sére pred liečbou, a najmä pri súbežnom podávaní liekov šetriacich draslík, sa preto počas prvého liečebného cyklu odporúča sledovať sérové hodnoty draslíka. Pozri tiež časť 4.5.
U žien s hypertriglyceridémiou, alebo ktoré majú toto ochorenie v rodinnej anamnéze, sa v priebehu užívania COC môže zvýšiť riziko pankreatitídy.
Aj keď sa u mnohých žien užívajúcich COC zaznamenalo malé zvýšenie krvného tlaku, klinicky významný vzostup je zriedkavý. Iba v týchto zriedkavých prípadoch je opodstatnené okamžité vysadenie COC. Ak existujúca hypertenzia, konštantne zvýšené hodnoty krvného tlaku alebo signifikantne zvýšený krvný tlak neodpovedajú adekvátne v priebehu užívania COC na antihypertenznú liečbu, COC sa musí vysadiť. Ak sa uzná za vhodné, užívanie COC je možné obnoviť po dosiahnutí normotenzných hodnôt krvného tlaku antihypertenznou liečbou.
V súvislosti s graviditou a v súvislosti s užívaním COC sa vyskytli alebo zhoršili nasledovné stavy, ale potvrdenie súvislosti s COC nie je preukázané: žltačka a/alebo svrbenie súvisiace s cholestázou, žlčové kamene, porfýria, systémový lupus erythematosus, hemolyticko-uremický syndróm, Sydenhamova chorea, herpes gestationis, strata sluchu spôsobená otosklerózou.
U žien s hereditárnym angioedémom môže podávanie estrogénov vyvolať alebo zhoršiť jeho symptómy.
Prerušenie užívania COC môže byť nevyhnutné pri akútnych a chronických poruchách pečeňovej funkcie až do času, kým sa markery pečeňovej funkcie vrátia na referenčné hodnoty. Recidíva cholestatickej žltačky a/alebo s cholestázou spojeného pruritu, ktoré sa predtým objavili v gravidite alebo počas predchádzajúceho užívania pohlavných steroidov, vyžadujú prerušenie užívania COC.
Napriek tomu, že COC môžu mať vplyv na periférnu inzulínovú rezistenciu a na glukózovú toleranciu, neexistuje dôkaz potreby meniť terapeutický režim u diabetičiek, užívajúcich nízkodávkové COC (s obsahom etinylestradiolu < 0,05 mg). Diabetičky musia však byť starostlivo sledované, najmä na začiatku užívania COC.
Počas užívania COC sa hlásilo zhoršenie endogénnej depresie, epilepsie, Crohnovej choroby a ulceróznej kolitídy.
Niekedy sa môže objaviť chloazma, najmä u žien, ktoré majú v anamnéze chloasma gravidarum. Používateľky so sklonom ku chloazme sa majú počas užívania COC vyhýbať expozícii slnečnému alebo ultrafialovému žiareniu.
Každá ružová tableta tohto lieku obsahuje 44 mg monohydrátu laktózy, každá biela tableta obsahuje 89,5 mg bezvodej laktózy. Pacientky so zriedkavými dedičnými problémami intolerancie galaktózy, laponskej deficiencie laktázy alebo glukózo-galaktózovou malabsorpciou, ktoré majú diétu bez laktózy, musia toto množstvo zohľadniť.
Lekárske vyšetrenia/konzultáciePred začatím používania alebo opätovným nasadením lieku Xanthadu sa má vyšetriť kompletná zdravotná anamnéza (vrátane rodinnej anamnézy) a musí sa vylúčiť gravidita. Má sa zmerať krvný tlak a vykonať zdravotná prehliadka na základe kontraindikácií (pozri časť 4.3) a upozornení (pozri časť 4.4). Je dôležité ženu upozorniť na informácie o venóznej a arteriálnej trombóze vrátane rizika užívania lieku Xanthadu v porovnaní s inými kombinovanými hormonálnymi kontraceptívami, o príznakoch VTE a ATE, o známych rizikových faktoroch a o tom, čo robiť v prípade podozrenia na trombózu.
Žena má byť poučená, aby si pozorne prečítala písomnú informáciu pre používateľku a dodržiavala odporúčania uvedené v nej.
Frekvencia a druh vyšetrení sa majú robiť na základe stanovených postupov a majú sa prispôsobiť individuálnym potrebám ženy.
Ženy majú byť upozornené, že hormonálna antikoncepcia nechráni pred infekciami vírusom HIV (AIDS) ani inými ochoreniami prenášanými pohlavným stykom.
Znížená účinnosťÚčinnosť COC sa môže znížiť napr. ak sa vynechajú aktívne tablety (pozri časť 4.2), v prípade gastrointestinálnych ťažkostí počas užívania aktívnych tabliet (pozri časť 4.2) alebo ak sa súbežne užívajú ďalšie lieky (pozri časť 4.5).
Znížená kontrola cykluPri užívaní ktoréhokoľvek COC sa môže objaviť nepravidelné krvácanie (špinenie alebo medzimenštruačné krvácanie), predovšetkým počas prvých mesiacov užívania. Z tohto dôvodu má posúdenie nepravidelného krvácania zmysel až po adaptačnom intervale približne troch cyklov.
Ak nepravidelné krvácanie pokračuje alebo sa objaví po období pravidelných cyklov, musí sa zvážiť možnosť nehormonálnej príčiny a indikované sú zodpovedajúce diagnostické kroky na vylúčenie malignity alebo gravidity. Môžu zahŕňať aj kyretáž.
U niektorých žien nemusí dôjsť počas fázy užívania placebo tabliet ku krvácaniu z vysadenia. Ak sa COC užíva podľa pokynov popísaných v časti 4.2, je nepravdepodobné, že je používateľka gravidná. Ak sa však COC neužívalo pred prvým vynechaným krvácaním podľa týchto pokynov alebo ak nedošlo ku krvácaniu z vysadenia dvakrát, musí sa pred ďalším užívaním COC vylúčiť gravidita.
4.5 Liekové a iné interakciePoznámka: Na identifikovanie potenciálnych interakcií, sa musia zohľadniť odborné informácie o súbežne užívaných liekoch.
· Vplyv ďalších liekov na užívanie lieku Xanthadu
Interakcie medzi perorálnymi kontraceptívami a inými liekmi môžu viesť k medzimenštruačnému krvácaniu a/alebo zlyhaniu antikoncepcie. V literatúre boli popísané nasledovné interakcie.
Pečeňový metabolizmus
S liekmi, ktoré indukujú pečeňové enzýmy (napr. fenytoín, barbituráty, primidón, karbamazepín, rifampicín, bosentan a lieky na HIV (napr. ritonavir, nevirapín) a možno taktiež oxkarbazepín, topiramát, felbamát, grizeofulvín a rastlinný prípravok ľubovník bodkovaný (
Hypericum perforatum)) sa môžu vyskytnúť interakcie, ktoré môžu mať za následok zvýšený klírens pohlavných hormónov. Maximálna enzýmová indukcia sa zvyčajne prejaví v priebehu 10 dní, ale potom môže pretrvávať minimálne 4 týždne po ukončení liečby.
Interferencia s enterohepatálnou cirkuláciou
Kontraceptívne zlyhanie sa hlásilo aj pri antibiotikách, ako sú penicilíny a tetracyklíny. Mechanizmus tohto účinku nebol objasnený.
Manažment liečby
Používateľky krátkodobo liečené niektorým liekom z vyššie uvedených skupín liečiv, alebo jednotlivými liečivami (lieky indukujúce pečeňové enzýmy) okrem rifampicínu, musia dočasne t.j. v priebehu súbežného podávania lieku a nasledujúcich 7 dní po ukončení podávania, navyše k COC používať bariérovú metódu.
Používateľky liečené rifampicínom musia počas podávania rifampicínu a 28 dní po jeho vysadení používať k COC naviac bariérovú metódu.
Používateľkám, dlhodobo liečeným liečivami indukujúcimi hepatálne enzýmy sa odporúča iná, spoľahlivá nehormonálna metóda antikoncepcie.
Používateľky, liečené antibiotikami (okrem rifampicínu, pozri vyššie) musia nasledujúcich 7 dní po ukončení podávania používať bariérovú metódu.
Ak súbežné podávanie lieku trvá aj po doužívaní aktívnych tabliet z blistrového balenia COC, placebo tablety sa musia odstrániť a okamžite sa musí začať užívanie z ďalšieho balenia COC.
Hlavné metabolity drospirenónu sa v ľudskej plazme vytvárajú bez účasti systému cytochrómu P450. Inhibítory tohto enzýmového systému preto pravdepodobne nemajú vplyv na metabolizmus drospirenónu.
· Vplyv lieku Xanthadu na užívanie iných liekov
Perorálne kontraceptíva môžu ovplyvňovať metabolizmus niektorých iných liečiv. Teda môžu ich koncentrácie v plazme a tkanivách buď zvyšovať (napr. cyklosporín) alebo znižovať (napr. lamotrigín).
Vychádzajúc z
in vitro inhibičných štúdií a štúdií
in vivo interakcií s dobrovoľníčkami, užívajúcimi omeprazol, simvastatín a midazolam ako označené substráty, interakcia drospirenónu v 3 mg dávkach s metabolizmom iných liečiv nie je pravdepodobná.
· Iné interakcie
U pacientok, ktoré nemajú obličkovú nedostatočnosť, súbežné užívanie drospirenónu a inhibítorov ACE alebo nesteroidných antiflogistík (NSAID) nepreukázalo signifikantný vplyv na hladinu draslíka v sére. Súbežné užívanie lieku Xanthadu a antagonistov aldosterónu alebo kálium šetriacich diuretík sa však neštudovalo. V tomto prípade sa musí koncentrácia draslíka v sére stanoviť počas prvého liečebného cyklu. Pozri tiež časť 4.4.
· Laboratórne vyšetrenia
Užívanie kontraceptívnych steroidov môže ovplyvniť výsledky niektorých laboratórnych testov, vrátane biochemických parametrov pečeňových, tyreoidálnych, adrenálnych a renálnych funkcií, plazmatických koncentrácií (transportných) proteínov napr. globulínu viažuceho kortikosteroidy a lipid/lipoproteínových frakcií, parametrov metabolizmu sacharidov a parametrov koagulácie a fibrinolýzy. Zmeny však zvyčajne zostávajú v rozmedzí referenčných laboratórnych hodnôt. Svojím miernym antimineralokortikoidným pôsobením drospirenón zapríčiňuje zvýšenie aktivity renínu v plazme a aldosterónu v plazme.
4.6 Fertilita, gravidita a laktáciaGraviditaXanthadu nie je indikovaný počas gravidity.
Ak v priebehu užívania lieku Xanthadu dôjde ku gravidite, liek sa musí okamžite vysadiť. Rozsiahle epidemiologické štúdie neodhalili zvýšené riziko vrodených chýb u detí narodených ženám, ktoré užívali COC pred otehotnením, ani teratogénny vplyv COC, nedopatrením užívaných počas gravidity.
Štúdie na zvieratách preukázali nežiaduce účinky počas gravidity a laktácie (pozri časť 5.3). Nežiaduce účinky v dôsledku hormonálneho účinku liečiv sa na základe výsledkov týchto štúdií na zvieratách nedajú vylúčiť. Celkové skúsenosti s použitím COC počas gravidity však neposkytujú dôkazy o konkrétnom nežiaducom pôsobení na ľudí.
Dostupné údaje ohľadom použitia lieku Xanthadu počas gravidity sú príliš obmedzené na vyvodenie záverov, týkajúcich sa negatívneho pôsobenia lieku Xanthadu na graviditu, na zdravie plodu alebo novorodenca. V súčasnosti nie sú dostupné žiadne významné epidemiologické údaje.
Pri opätovnom začatí užívania lieku Xanthadu treba vziať do úvahy zvýšené riziko VTE v období po pôrode. (pozri časti 4.2 a 4.4).
LaktáciaCOC môžu ovplyvniť laktáciu, pretože môžu znižovať množstvo a meniť zloženie materského mlieka. Z tohto dôvodu sa užívanie COC vo všeobecnosti neodporúča, až kým matka úplne neprestane dieťa dojčiť. V priebehu užívania COC sa do materského mlieka môžu vylučovať malé množstvá kontraceptívnych steroidov a/alebo ich metabolitov. Tieto množstvá môžu mať vplyv na dieťa.
FertilitaXanthadu je indikovaný na zabránenie otehotnenia. Ďalšie informácie na obnovenie plodnosti, pozri časť 5.1.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. U žien užívajúcich COC sa nepozorovali žiadne vplyvy na schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinkyV priebehu užívania lieku Xanthadu sa hlásili nasledovné nežiaduce reakcie:
V nižšie uvedenej tabuľke sú hlásené nežiaduce reakcie zoradené podľa MedDRA triedy orgánových systémov (MedDRA SOCs). Frekvencie výskytu vychádzajú z údajov z klinických skúšaní. Na popis určitej reakcie a jej synonyma a súvisiacich stavov je uvedený najvhodnejší pojem podľa terminológie MedDRA.
Nežiaduce reakcie, ktoré súviseli s užívaním lieku Xanthadu ako perorálnej antikoncepcie alebo na liečbu stredne závažných acne vulgaris podľa MedDRA triedy orgánových systémov a terminológie MedDRA Trieda orgánového systému
(MedDRA verzia 9.1)
| časté
(³1/100 až <1/10)
| menej časté
(³1/1 000 až <1/100)
| zriedkavé
(³1/10 000 až <1/1 000)
| neznáme (z dostupných údajov)
|
Infekcie a nákazy
|
|
| kandidóza
|
|
Poruchy krvi a lymfatického systému
|
|
| anémia
trombocytémia
|
|
Poruchy imunitného systému
|
|
| alergické reakcie
| precitlivenosť
|
Poruchy endokrinného systému
|
|
| poruchy endokrinného systému
|
|
Poruchy metabolizmu a výživy
|
|
| zvýšená chuť do jedla
anorexia
hyperkaliémia
hyponatriémia
|
|
Psychické poruchy
| emocionálna labilita
| depresia
nervozita
somnolencia
| anorgazmia
insomnia
|
|
Poruchy nervového systému
| bolesť hlavy
| závrat'
parestézia
| vertigo
tremor
|
|
Poruchy oka
|
|
| konjunktivitída
suché oči
poruchy videnia
|
|
Poruchy srdca a srdcovej činnosti
|
|
| tachykardia
|
|
Poruchy ciev
|
| migréna
kŕčové žily
hypertenzia
| venózna tromboembólia (VTE) arteriálna tromboembólia (ATE) flebitída
cievne poruchy
epistaxia
synkopa
|
|
Poruchy gastrointestinálneho traktu
| nauzea
| bolesť brucha
vracanie
dyspepsia
flatulencia
gastritída
hnačka
| zväčšené brucho
gastrointestinálna porucha
pocit plnosti žalúdka a čriev
hiátová hernia
orálna kandidóza
zápcha
sucho v ústach
|
|
Poruchy pečene a žlčových ciest
|
|
| bolesť žlčníka a žlčovodov
cholecystitída
|
|
Poruchy kože a podkožného tkaniva
|
| akné
pruritus
vyrážka
| chloazma
ekzém
alopécia
akneiformná dermatitída
suchá koža
erythema nodosum hypertrichóza
poruchy kože
kožné strie
kontaktná dermatidída
fotosenzitívna dermatitída
kožné uzlíky
| erythema multiforme
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
| bolesť chrbta
bolesť končatín
svalové kŕče
|
|
|
Poruchy reprodukčného systému a prsníkov
| bolesť prsníkov
metrorágia*
amenorea
| vaginálna kandidóza
bolesť v panve
zväčšenie prsníkov
fibrocystové prsníky
krvácanie z maternice/pošvy*
výtok z pohlavných orgánov
návaly horúčavy
vaginitída
menštruačné poruchy
dysmenorea
hypomenorea
menorágia
suchosť v pošve
podozrivý nález pri Papovom teste
znížené libido
| dyspareunia
vulvovaginitída
krvácanie po pohlavnom styku
krvácanie z vysadenia
cysty v prsníkoch
hyperplázia prsníkov
neoplazmy prsníkov
polypy v krčku maternice
atrofia endometria
ovariálne cysty
zväčšenie maternice
|
|
Celkové poruchy a reakcie v mieste podania
|
| asténia
zvýšené potenie
edém
(generalizovaný edém,
periférny edém,
edém tváre)
| nevoľnosť
|
|
Laboratórne a funkčné vyšetrenia
|
| prírastok telesnej hmotnosti
| úbytok telesnej hmotnosti
|
|
* nepravidelnosti krvácania zvyčajne vymiznú pokračovaním liečby
Popis vybraných nežiaducich reakcií
U žien používajúcich kombinovanú hormonálnu antikoncepciu sa pozorovalo zvýšené riziko vzniku arteriálnych a venóznych trombotických a tromboembolických udalostí vrátane infarktu myokardu, cievnej mozgovej príhody, prechodných ischemických záchvatov, venóznej trombózy a pľúcnej embólie, ktoré sú podrobnejšie uvedené v časti 4.4.
Nasledovné závažné nežiaduce udalosti, ktoré sa hlásili u žien užívajúcich COC, sú analyzované v časti 4.4:
- hypertenzia;
- nádory pečene;
- výskyt alebo zhoršenie stavov, u ktorých súvislosť s užívaním COC nie je presvedčivá:
Crohnova choroba, ulcerózna kolitída, epilepsia, maternicové myómy, porfýria, systémový lupus
erythematosus, herpes gestationis, Sydenhamova chorea, hemolyticko-uremický syndróm,
cholestatická žltačka;
- chloazma;
- akútne alebo chronické poruchy funkcie pečene si môžu vyžadovať prerušenie užívania COC, až
kým sa markery funkcie pečene nevrátia na referenčné hodnoty,
- u žien s hereditárnym angioedémom môže podávanie exogénnych estrogénov vyvolať alebo
zhoršiť jeho symptómy.
U používateliek perorálnych kontraceptív je veľmi mierne zvýšená frekvencia diagnózy rakoviny prsníka. Pretože výskyt rakoviny prsníka je u žien do 40 rokov zriedkavý, zvýšený počet diagnostikovanej rakoviny prsníka je v pomere k celkovému riziku rakoviny prsníka malý. Kauzalita s užívaním COC nie je známa. Ďalšie informácie pozri v častiach 4.3 a 4.4.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.
4.9 PredávkovanieS predávkovaním lieku Xanthadu ešte nie sú skúsenosti. Na základe celkových skúseností s kombinovanými perorálnymi kontraceptívami, sa môžu v prípade predávkovania aktívnymi tabletami vyskytnúť tieto príznaky: nauzea, vracanie a u mladých dievčat slabé vaginálne krvácanie. Antidotá neexistujú a ďalšia liečba má byť symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Hormonálne kontraceptíva na systémové použitie; Gestagény a estrogény, fixná kombinácia, ATC kód: G03AA12
Pearlov index zlyhania metódy: 0,41 (95% obojstranný interval spoľahlivosti, horná medza: 0,85)
Celkový Pearlov index (zlyhanie metódy + zlyhanie pacienta): 0,80 (95% obojstranný interval spoľahlivosti, horná medza: 1,30).
Antikoncepčný účinok lieku Xanthadu je založený na spolupôsobení rôznych faktorov. Najdôležitejšie z nich sú inhibícia ovulácie a zmeny endometria.
Počas štúdie trvajúcej tri cykly, a ktorá sledovala inhibíciu ovulácie a porovnávajúcu podávanie drospirenónu 3 mg/etinylestradiolu 0,020 mg v 24 dennom dávkovacom režime oproti 21 dennému dávkovaciemu režimu, vykázal 24 denný režim väčšie potlačenie vývoja folikulov. Po zámerne vyvolaných chybách dávkovania počas tretieho cyklu liečby sa u viac žien s 21 denným režimom preukázala ovariálna aktivita, vrátane zvýšeného rizika ovulácie v porovnaní s používateľkami s 24 denným režimom. Ovariálna aktivita sa počas cyklu ukončenia liečby vrátila na úroveň pred začatím liečby u 91,8 % používateliek na 24 dennom režime.
Xanthadu je kombinované perorálne kontraceptívum obsahujúce etinylestradiol a gestagén drospirenón. V terapeutickom dávkovaní má drospirenón tiež antiandrogénne a mierne antimineralokortikoidné vlastnosti. Nemá estrogénny, glukokortikoidný ani antiglukokortikoidný účinok. Na základe toho je farmakologický profil drospirenónu veľmi podobný prirodzenému hormónu progesterónu.
Z klinických štúdií vyplýva, že mierne antimineralokortikoidné vlastnosti lieku Xanthadu vedú k miernemu antimineralokortikoidnému pôsobeniu.
Na posúdenie účinnosti a bezpečnosti lieku Xanthadu u žien so stredne ťažkým acne vulgaris sa vykonali dve multicentrické, dvojito zaslepené, randomizované, placebom kontrolované štúdie.
Po šiestich mesiacoch liečby liekom Xanthadu v porovnaní s placebom preukázal štatisticky významne väčšie 15,6 %-né (49,3 % verzus 33,7 %) zníženie u zápalových lézií, 18,5 %-né (40,6% verzus 22,1 %) u nezápalových lézií a 16,5 %-né (44,6 % verzus 28,1 %) u celkového počtu lézií. Okrem toho vyššie percento jedincov 11,8 % (18,6 % verzus 6,8 %) malo hodnotenie pleti „čistá“ alebo „takmer čistá“ podľa škály ISGA (Investigator’s Static Global Assessment).
5.2 Farmakokinetické vlastnostiDrospirenón AbsorpciaDrospirenón sa po perorálnom podaní rýchlo a takmer úplne absorbuje. Maximálne koncentrácie liečiva v sére okolo 38 ng/ml sa dosiahnu asi za 1 – 2 hodiny po jednorazovom podaní. Biologická dostupnosť je medzi 76 a 85%. Súbežné podanie potravy nemá na biologickú dostupnosť drospirenónu žiadny vplyv.
DistribúciaPo perorálnom podaní sérové koncentrácie drospirenónu klesajú s terminálnym polčasom 31 h.
Drospirenón sa viaže na sérový albumín a neviaže sa na globulín viažuci pohlavné hormóny (SHBG) ani na globulín viažuci kortikoidy (CBG). Len 3-5% z celkovej sérovej koncentrácie liečiva je vo forme voľného steroidu. Zvýšenie SHBG indukované etinylestradiolom neovplyvňuje väzbu drospirenónu na sérové proteíny. Priemerný zdanlivý distribučný objem drospirenónu je 3,7 ± 1,2 l/kg.
BiotransformáciaDrospirenón sa po perorálnom podaní rozsiahlo metabolizuje. Hlavnými metabolitmi v plazme sú kyslá forma drospirenónu, ktorá vzniká otvorením laktónového kruhu a 4,5-dihydrodrospirenón-3-sulfát, ktoré obidva vznikajú bez účasti systému P450. Drospirenón sa v malom rozsahu metabolizuje cytochrómom P450 3A4 a
in vitro prejavil schopnosť inhibovať tento enzým a cytochróm P450 1A1, cytochróm P450 2C9 a cytochróm P450 2C19.
ElimináciaMetabolický klírens drospirenónu v sére je 1,5 ± 0,2 ml/min/kg. Drospirenón sa vylučuje v nezmenenej forme len v stopových množstvách. Metabolity drospirenónu sa vylučujú stolicou a močom s vylučovacím koeficientom približne 1,2 až 1,4. Polčas vylúčenia metabolitov močom a stolicou je asi 40 h.
Rovnovážny stavV priebehu liečebného cyklu sa maximálna rovnovážna koncentrácia drospirenónu v sére asi 70 ng/ml dosiahne po asi 8 dňoch liečby. V dôsledku pomeru terminálneho polčasu a dávkovacieho intervalu sa koncentrácie drospirenónu v sére zvýšia približne trojnásobne.
Špeciálne skupiny pacientokVplyv poškodených obličiekU žien s miernym poškodením obličiek (klírens kreatinínu CLcr 50-80 ml/min) boli sérové koncentrácie drospirenónu v rovnovážnom stave porovnateľné s koncentráciami u žien s normálnou funkciou obličiek. Koncentrácie drospirenónu v sére boli v priemere o 37% vyššie u žien so stredne závažným poškodením obličiek (CLcr 30-50 ml/min) v porovnaní s hladinami u žien s normálnou funkciou obličiek. Liečba drospirenónom bola dobre tolerovaná aj u žien s miernym až stredne závažným poškodením obličiek. Liečba drospirenónom nepreukázala žiadny klinicky významný vplyv na koncentráciu draslíka v sére.
Vplyv poškodenej pečeneU dobrovoľníčok so stredne závažným poškodením pečene bol v štúdii s jednorazovým podaním pozorovaný približne 50%-ný pokles v perorálnom klírense (CL/F) v porovnaní s dobrovoľníčkami s normálnou funkciou pečene. Pozorované zníženie klírensu drospirenónu u dobrovoľníčok so stredne závažným poškodením pečene nevyústilo do žiadnych zjavných rozdielov koncentrácií sérového draslíka. Zvýšenie koncentrácií sérového draslíka nad hornú hranicu normy normálneho rozpätia nebolo pozorované dokonca ani u diabetičiek a pri súbežnej liečbe spironolaktónom (dva predispozičné faktory hyperkaliémie). To vedie k záveru, že drospirenón je u pacientok s miernym alebo stredne závažným poškodením pečene (Child-Pugh B) dobre tolerovaný.
Etnické skupinyNeboli pozorované klinicky významné rozdiely vo farmakokinetike drospirenónu a etinylestradiolu medzi Japonkami a používateľkami bielej rasy.
Etinylestradiol AbsorpciaPerorálne podaný etinylestradiol sa absorbuje rýchlo a úplne. Vrchol plazmatickej koncentrácie, približne 33 pg/ml, sa dosiahne za 1-2 hodiny po jednorazovom perorálnom podaní. Absolútna biologická dostupnosť je v dôsledku presystémovej konjugácie a first-pass metabolizmu približne 60%. Súbežné prijímanie potravy znížilo biologickú dostupnosť etinylestradiolu u asi 25% skúmaných jedincov, zatiaľ čo u ostatných sa nepozorovala žiadna zmena.
DistribúciaSérové koncentrácie etinylestradiolu klesajú v dvoch fázach, terminálna distribučná fáza je charakterizovaná polčasom približne 24 hodín. Etinylestradiol sa vysoko, ale nešpecificky viaže na albumín v sére (približne 98,5%) a indukuje zvýšenie plazmatických koncentrácií SHBG a globulínu viažuceho kortikoidy (CBG). Zdanlivý distribučný objem je asi 5 l/kg.
BiotransformáciaEtinylestradiol podlieha presystémovej konjugácii v sliznici tenkého čreva a v pečeni. Etinylestradiol sa primárne metabolizuje formou aromatickej hydroxylácie, pričom vzniká široká škála hydroxylovaných a metylovaných metabolitov, ktoré sa vyskytujú vo forme voľných metabolitov ako aj glukuronidových a sulfátových konjugátov. Metabolický klírens etinylestradiolu je približne 5 ml/min/kg.
ElimináciaEtinylestradiol sa v nezmenenej forme nevylučuje vo významnom množstve. Metabolity etinylestradiolu sa vylučujú močom a žlčou v pomere 4:6. Polčas vylučovania metabolitov je asi 1 deň.
Rovnovážny stavRovnovážny stav sa dosiahne v druhej polovici liečebného cyklu a sérové koncentrácie etinylestradiolu sa zvýšia 2,0 až 2,3-násobne.
5.3 Predklinické údaje o bezpečnostiNa laboratórnych zvieratách sa účinky drospirenónu a etinylestradiolu obmedzili na tie, ktoré sa spájajú so známym farmakologických pôsobením. Najmä štúdie reprodukčnej toxicity odhalili na zvieratách embryotoxické a fetotoxické účinky, ktoré sú považované za druhovo špecifické. Pri podaní dávok prekračujúcich dávky pri užívaní lieku Xanthadu sa pozorovalo pôsobenie na pohlavné diferencovanie na plodoch potkanov, ale nie u opíc.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látok
Aktívne filmom obalené tablety (ružové):·
Jadro tablety:- monohydrát laktózy
- predželatínovaný škrob (kukuričný)
- povidón K-30 (E 1201)
- sodná soľ kroskarmelózy
- polysorbát 80 (E 433)
- magnéziumstearát (E 470b)
·
Filmový obal tablety:- polyvinylalkohol
- oxid titaničitý (E 171)
- makrogol 3350
- mastenec (E 553b)
- žltý oxid železitý (E 172)
- červený oxid železitý (E 172)
- čierny oxid železitý (E 172)
Placebo filmom obalené tablety (biele) - Jadro tablety:
- bezvodá laktóza
- povidón K-30 (E 1201)
- magnéziumstearát (E 470b)
- Filmový obal tablety:
- polyvinylalkohol
- oxid titaničitý (E 171)
- makrogol 3350
- mastenec (E 553b)
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti3 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 30 °C.
6.5 Druh obalu a obsah baleniaPriehľadný až mierne nepriehľadný transparentný PVC/PVdC-Alu blister.
Veľkosti balenia:
1 x 28 filmom obalených tabliet (24 aktívnych tabliet plus 4 placebo tablety)
3 x 28 filmom obalených tabliet (24 aktívnych tabliet plus 4 placebo tablety)
6 x 28 filmom obalených tabliet (24 aktívnych tabliet plus 4 placebo tablety)
13 x 28 filmom obalených tabliet (24 aktívnych tabliet plus 4 placebo tablety)
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomNepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIILaboratorios Liconsa, S.A.
Gran Vía Carlos III, 98, 7th floor
08028 – Barcelona
Španielsko
8. REGISTRAČNÉ ČÍSLOReg. č.: 17/0202/15-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUJún 2015