
zri časť 4.5).
4.4 Osobitné upozornenia a opatrenia pri používaní
Pred začatím liečby liekom Aristissa sa majú zhodnotiť ďalšie príčiny častého močenia (zlyhávanie srdca alebo ochorenie obličiek). V prípade výskytu infekcie močovej sústavy sa má začať príslušná antibakteriálna liečba.
Liek Aristissa sa má podávať opatrne u pacientov s :
- klinicky významnou obštrukciou vývodu z močového mechúra s možným rizikom retencie moču,
- gastrointestinálnou obštrukčnou poruchou,
- rizikom zníženej gastrointestinálnej motility,
- závažnou poruchou funkcie obličiek (klírens kreatinínu ≤ 30 ml/min; pozri časti 4.2 a 5.2), u týchto pacientov dávka nemá presiahnuť 5 mg,
- stredne závažnou poruchou funkcie pečene (Childovo-Pughovo skóre 7 až 9; pozri časti 4.2 a 5.2), u týchto pacientov dávka nemá presiahnuť 5 mg,
- súčasným užívaním silného inhibítora CYP3A4, napr. ketokonazolu (pozri časti 4.2 a 4.5),
- hiátovou prietržou/gastroezofageálnym refluxom a/alebo u pacientov, ktorí súčasne užívajú lieky
(napr. bisfosfonáty), ktoré môžu spôsobiť alebo zhoršiť ezofagitídu,
- autonómnou neuropatiou.
U pacientov s rizikovými faktormi, ako je syndróm dlhého intervalu QT a hypokaliémia v anamnéze, bolo pozorované predĺženie QT intervalu a torsade de pointes.
U pacientov s neurogénnou príčinou hyperaktivity detruzora sa bezpečnosť a účinnosť tohto lieku zatiaľ nestanovila.
Angioedém s obštrukciou dýchacích ciest bol hlásený u niektorých pacientov užívajúcich
a má byť podaná vhodná liečba a/alebo prijaté vhodné opatrenia.
Anafylaktické reakcie boli hlásené u niektorých pacientov liečených solifenacínium-sukcinátom.
U pacientov, u ktorých sa vyskytnú anafylaktické reakcie, sa má ukončiť užívanie solifenacínium-
sukcinátu a má sa začať s náležitou liečbou a/alebo sa majú prijať vhodné opatrenia.
Maximálny účinok lieku Aristissa je možné stanoviť najskôr po uplynutí 4 týždňov od začiatku jeho
užívania.
Aristissa obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami intolerancie galaktózy, galaktozémie alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Far makol ogi cké i nt erakci e
Súčasná liečba inými liekmi s anticholinergickými vlastnosťami môže vyústiť do výraznejších terapeutických účinkov a nežiaducich účinkov. Medzi ukončením liečby liekom Aristissa a začiatkom liečby iným anticholinergickým liekom má uplynúť približne jeden týždeň. Liečebný účinok solifenacínu sa môže znížiť pri súčasnom podávaní agonistov cholinergných receptorov.
Solifenacín môže znížiť účinok liekov, ktoré stimulujú motilitu gastrointestinálneho traktu, akými sú napríklad metoklopramid a cisaprid.
Far mako ki net ické i nterakcie
Štúdie in vitro dokázali, že solifenacín pri terapeutických koncentráciách neinhibuje CYP1A1/2, 2C9,
2C19, 2D6 alebo 3A4 odvodené z mikrozómov ľudskej pečene. Preto je nepravdepodobné, že by solifenacín menil klírens liekov metabolizovaných pomocou týchto CYP enzýmov.
Úči nok i ných li ekov na f arma ko ki neti cké vl as t nosti sol if enací nu
Solifenacín sa metabolizuje pomocou CYP3A4. Súčasné podanie ketokonazolu (200 mg/deň), silného
inhibítora CYP3A4, viedlo k dvojnásobnému zvýšeniu AUC solifenacínu, zatiaľ čo podanie ketokonazolu v dávke 400 mg/deň viedlo k trojnásobnému zvýšeniu AUC solifenacínu. Preto má byť
maximálna dávka lieku Aristissa obmedzená na 5 mg v prípade, ak je pacient súčasne liečený
ketokonazolom alebo terapeutickými dávkami iných silných inhibítorov CYP3A4 (napr. ritonavir,
nelfinavir, itrakonazol) (pozri časť 4.2).
Súčasná liečba solifenacínom a silným inhibítorom CYP3A4 je kontraindikovaná u pacientov so závažnou poruchou funkcie obličiek alebo stredne závažnou poruchou funkcie pečene.
Vplyv enzýmovej indukcie na farmakokinetické vlastnosti solifenacínu a jeho metabolitov nebol
predmetom štúdie, rovnako ako ani vplyv substrátov s vyššou afinitou k CYP3A4 na expozíciu solifenacínu. Keďže solifenacín sa metabolizuje prostredníctvom CYP3A4, sú možné farmakokinetické interakcie s inými substrátmi CYP3A4 s vyššou afinitou k CYP3A4 (napr. verapamil, diltiazem) a induktormi CYP3A4 (napr. rifampicín, fenytoín, karbamazepín) .
Vplyv sol if enací nu na f ar makoki net i cké vl ast nost i i ných l iekov
Perorálne kontraceptíva
Užívanie lieku Aristissa nepreukázalo žiadnu farmakokinetickú interakciu solifenacínu
s kombinovanými perorálnymi kontraceptívami (etinylestradiol/levonorgestrel).
Warfarín
Užívanie lieku Aristissa nezmenilo farmakokinetické vlastnosti R-warfarínu ani S-warfarínu, ani ich
účinok na protrombínový čas.
Digoxín
Užívanie lieku Aristissa nevykázalo žiaden vplyv na farmakokinetické vlastnosti digoxínu.
4.6 Fertilita, gravidita a laktácia
G
r
avidita
Nie sú k dispozícii žiadne klinické údaje o ženách, ktoré otehotneli počas užívania solifenacínu. Štúdie
na zvieratách nepreukázali priame škodlivé účinky na plodnosť, embryonálny/fetálny vývoj alebo pôrod (pozri časť 5.3). Potenciálne riziko u ľudí nie je známe. Pri predpisovaní lieku gravidným ženám je potrebná opatrnosť.
Lakt ác i a Údaje o vylučovaní solifenacínu do ľudského mlieka nie sú k dispozícii. U myší sa solifenacín a/alebo jeho metabolity vylučovali do mlieka, čo spôsobilo od dávky závislé nedostatočné prospievanie novorodenej myši (pozri časť 5.3). Preto by sa počas obdobia dojčenia malo vyhnúť užívaniu lieku Aristissa.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeKeďže solifenacín, tak ako aj iné anticholinergiká, môže spôsobovať rozmazané videnie a menej často ospalosť a únavu (pozri časť 4.8. Nežiaduce účinky), môže mať negatívny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky Súhrn bezpeč nost ného profiluVzhľadom na farmakologické účinky solifenacínu môže liek Aristissa spôsobiť anticholinergické nežiaduce účinky (obvykle) miernej alebo strednej závažnosti. Frekvencia anticholinergických nežiaducich účinkov je závislá od dávky.
Najčastejšie hlásená nežiaduca reakcia pri užívaní lieku Aristissa bola sucho v ústach. K tejto reakcii
došlo u 11 % pacientov, ktorí užívali dávku 5 mg jedenkrát denne, u 22 % pacientov, ktorí užívali dávku 10 mg jedenkrát denne a u 4 % pacientov, ktorí užívali placebo. Závažnosť sucha v ústach bola
obvykle mierna a len občas viedla k prerušeniu liečby.
Compliance lieku bola vo všeobecnosti veľmi
vysoká (približne 99 %) a približne 90 % pacientov liečených liekom Aristissa ukončilo celú štúdiu
v trvaní 12 týždňov.
Zo znam neži aduc i ch úči nkov v t abuľko vo m f or mát e
Trieda orgánových systémov podľa databázy MedDRA
|
Veľmi časté
≥ 1/10
|
Časté
≥ 1/100 až
< 1/10
|
Menej časté
≥ 1/1 000 až
< 1/100
|
Zriedkavé
≥ 1/10 000
až < 1/1 000
|
Veľmi zriedkavé
< 1/10 000
| Neznáme (častosť sa nedá odhadnúť
z dostupných údajov)
|
Infekcie
a nákazy
|
|
| infekcia
močových ciest, cystitída
|
|
|
|
Poruchy
imunitného systému
|
|
|
|
|
| anafylaktické
reakcie
|
Poruchy
metabolizmu a
výživy
|
|
|
|
|
| znížená chuť
do jedla,
hyperkaliémia
|
Psychické
poruchy
|
|
|
|
| halucinácie
stavy
zmätenosti
| delírium
|
Poruchy
nervového systému
|
|
| somnolencia,
poruchy
vnímania
| závrat,
bolesť hlavy
|
|
|
T
rieda orgánových systémov podľa databázy MedDRA
|
V
eľmi časté
≥ 1/10
|
Č
asté
≥ 1/100 až
< 1/10
|
Menej časté
≥ 1/1 000 až
< 1/100
|
Z
riedkavé
≥ 1/10 000
až < 1/1 000
|
V
eľmi zriedkavé
< 1/10 000
|
N
eznáme
(
častosť sa nedá odhadnúť
z dostupných údajov)
|
|
|
|
chuti
|
|
|
|
Poruchy oka
|
|
rozmazané
videnie
|
suché oči
|
|
|
glaukóm
|
Poruchy srdca
a srdcovej
činnosti
|
|
|
|
|
|
torsade de
pointes, predĺženie QT intervalu
na elektro- kardiograme
atriálna fibrilácia,
palpitácia,
tachykardia
|
Poruchy
dýchacej sústavy, hrudníka
a mediastína
|
|
|
sucho
v nose
|
|
|
dysfónia
|
Poruchy
gastrointestinál- neho traktu
|
sucho
v ústach
|
zápcha,
nauzea, dyspepsia,
bolesť
brucha
|
gastro-
ezofageálny
reflux, sucho
v hrdle
|
obštrukcia
hrubého čreva,
porucha
vyprázdňov ania hrubého čreva, vracanie
|
|
ileus,
tráviace ťažkosti
|
Poruchy pečene
a žlčových ciest
|
|
|
|
|
|
porucha
funkcie
pečene, neprimerané výsledky testov pečeňových funkcií;
|
Poruchy kože
a podkožného
tkaniva
|
|
|
suchá
pokožka
|
pruritus,
vyrážka,
|
multiformný
erytém, urtikária, angioedém
|
exfoliatívna
dermatitída
|
Poruchy
kostrovej
a svalovej
sústavy
a spojeného
tkaniva
|
|
|
|
|
|
svalová
slabosť
|
Poruchy
obličiek
a močových
ciest
|
|
|
problémy
pri močení
|
retencia
moču
|
|
porucha
funkcie
obličiek
|
T
rieda orgánových systémov podľa databázy MedDRA
|
V
eľmi časté
≥ 1/10
|
Č
asté
≥ 1/100 až
< 1/10
|
Menej časté
≥ 1/1 000 až
< 1/100
|
Z
riedkavé
≥ 1/10 000
až < 1/1 000
|
V
eľmi zriedkavé
< 1/10 000
|
N
eznáme
(
častosť sa nedá odhadnúť
z dostupných údajov)
|
Celkové
poruchy
a reakcie v mieste
podania
|
|
|
únava periférny edém
|
|
|
|
 Hl ás eni e podozr ení na nežiaduc e r ea kcie
Hl ás eni e podozr ení na nežiaduc e r ea kcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 Predávkovanie Sympt ó my Predávkovanie solifenacínium-sukcinátom môže viesť k ťažkým anticholinergickým účinkom.
Najvyššia dávka solifenacínium-sukcinátu náhodne podaná jednému pacientovi bola 280 mg počas
5 hodín a mala za následok zmeny duševného stavu, ktoré nevyžadovali hospitalizáciu.
Lie čba V prípade predávkovania solifenacínium-sukcinátom sa má pacient liečiť adsorpčným uhlím. Výplach žalúdka pomôže, ak sa vykoná do 1 hodiny, ale nemá sa vyvolávať vracanie.
Tak ako pri ostatných anticholinergikách, príznaky sa môžu liečiť nasledovne:
- Závažné centrálne anticholinergické účinky, ako napr. halucinácie alebo výrazná excitácia: liečba
fyzostigmínom alebo karbacholom.
- Kŕče alebo výrazná excitácia: liečba benzodiazepínmi.
- Respiračná nedostatočnosť: liečba umelým dýchaním.
- Tachykardia: liečba beta-blokátormi.
- Retencia moču: liečba katetrizáciou.
- Mydriáza: liečba pilokarpínovými očnými kvapkami a/alebo umiestnenie pacienta do tmavej
miestnosti.
Tak ako pri ostatných antimuskarinikách sa má v prípade predávkovania venovať zvláštna pozornosť pacientom so známym rizikom predĺženia QT - intervalu (t.j. pri hypokaliémii, bradykardii
a pri súčasnom užívaní liekov, u ktorých je známe, že predlžujú QT-interval) a pacientom s už
existujúcim ochorením srdca (t.j. s ischémiou myokardu, arytmiou, kongestívnym zlyhávaním srdca).
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Liečivá na časté močenie a inkontinenciu
ATC kód: G04BD08.
Mechanizmus úči nku Solifenacín je kompetitívny špecifický antagonista cholinergných receptorov.
Močový mechúr je inervovaný parasympatickými cholinergnými nervami. Acetylcholín kontrahuje hladký sval detruzora prostredníctvom muskarínových receptorov, predovšetkým podtypom M3.
Farmakologické štúdie
in vitro a in vivo naznačujú, že solifenacín je kompetitívny inhibítor muskarínového receptora podtypu M3. Ukázalo sa, že solifenacín je navyše špecifickým antagonistom muskarínových receptorov - vykazuje nízku alebo žiadnu afinitu vo vzťahu k rôznym iným testovaným receptorom a testovaným iónovým kanálom.
Far makod ynami cké úč i nky Liečba solifenacínium-sukcinátom v dávkach 5 mg a 10 mg denne bola predmetom niekoľkých dvojito zaslepených, randomizovaných, kontrolovaných klinických štúdií, ktorých sa zúčastnili muži a ženy s hyperaktívnym močovým mechúrom.
Podľa nižšie uvedenej tabuľky obe dávky 5 mg a 10 mg solifenacínium-sukcinátu spôsobili štatisticky významné zlepšenia primárnych a sekundárnych ukazovateľov v porovnaní s placebom. Účinnosť
lieku sa prejavila do jedného týždňa od začatia liečby a stabilizuje sa v priebehu 12 týždňov. Dlhodobá otvorená štúdia dokázala, že účinnosť pretrvávala najmenej počas 12 mesiacov. Po 12 týždňoch liečby u približne 50 % pacientov, ktorí pred liečbou trpeli inkontinenciou, došlo k vymiznutiu inkontinencie
a navyše 35 % pacientov dosiahlo zníženie frekvencie močenia na menej než 8-krát za deň. Liečenie príznakov hyperaktívneho močového mechúra malo prínos i s ohľadom na hodnotenie kvality života,
napríklad na celkové vnímanie zdravia, vnímanie inkontinencie, funkčné obmedzenia, fyzické obmedzenia, spoločenské obmedzenia, emócie, závažnosť symptómov, úroveň závažnosti
a spánok/vitalitu.
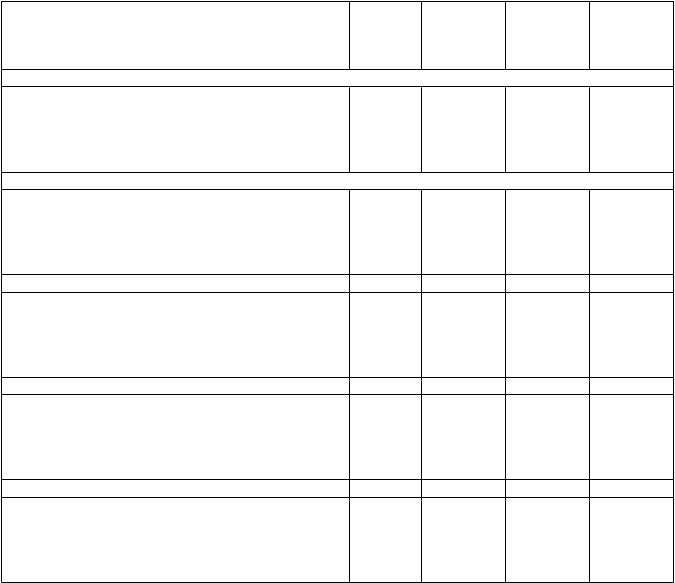
Výsledky (súhrn údajov) štyroch kontrolovaných štúdií fázy 3 s dĺžkou trvania liečby 12 týždňov
| Placebo
| Solifenacin
5 mg jedenkrát denne
| Solifenacin
10 mg jedenkrát denne
| Tolterodín
2 mg dvakrát denne
|
Počet močení/24 hod.
|
|
|
|
|
Priemerná hodnota pri úvodnom vyšetrení
Priemerné zníženie v porovnaní s úvodným vyšetrením
% zmena v porovnaní s úvodným vyšetrením počet
p-hodnota*
| 11,9
1,4
(12 %)
1 138
| 12,1
2,3
(19 %)
552
< 0,001
| 11,9
2,7
(23 %)
1 158
< 0,001
| 12,1
1,9
(16 %)
250
0,004
|
Počet epizód urgencie/24 hod.
|
|
| '
|
|
Priemerná hodnota pri úvodnom vyšetrení
Priemerné zníženie v porovnaní s úvodným vyšetrením
% zmena v porovnaní s úvodným vyšetrením počet
p-hodnota*
| 6,3
2,0
(32 %)
1 124
| 5,9
2,9
(49 %)
548
< 0,001
| 6,2
3,4
(55 %)
1 151
< 0,001
| 5,4
2,1
(39 %)
250
0,031
|
Počet epizód inkontinencie/24 hod.
|
|
|
|
|
Priemerná hodnota pri úvodnom vyšetrení
Priemerné zníženie v porovnaní s úvodným vyšetrením
% zmena v porovnaní s úvodným vyšetrením počet
p-hodnota*
| 2,9
1,1
(38 %)
781
| 2,6
1,5
(58 %)
314
< 0,001
| 2,9
1,8
(62 %)
778
< 0,001
| 2,3
1,1
(48 %)
157
0,009
|
Počet epizód nočného močenia (noktúrie)/24 hod.
|
|
|
|
|
Priemerná hodnota pri úvodnom vyšetrení
Priemerné zníženie v porovnaní s úvodným vyšetrením
% zmena v porovnaní s úvodným vyšetrením počet
p-hodnota*
| 1,8
0,4
(22 %)
1 005
| 2,0
0,6
(30 %)
494
0,025
| 1,8
0,6
(33 %)
1 035
< 0,001
| 1,9
0,5
(26 %)
232
0,199
|
Objem vylúčeného moču/močenie
|
|
|
|
|
Priemerná hodnota pri úvodnom vyšetrení
Priemerné zvýšenie v porovnaní s úvodným vyšetrením
% zmena v porovnaní s úvodným vyšetrením počet
p-hodnota*
| 166 ml
9 ml
(5 %)
1 135
| 146 ml
32 ml
(21 %)
552
< 0,001
| 163 ml
43 ml
(26 %)
1 156
< 0,001
| 147 ml
24 ml
(16 %)
250
< 0,001
|
|
Placebo
|
Solifenacin
5 mg jedenkrát denne
|
Solifenacin
10 mg jedenkrát denne
|
T
olterodín
2 mg dvakrát denne
|
P
očet vložiek/24 hod.
|
|
|
|
|
Priemerná hodnota pri úvodnom vyšetrení
Priemerné zníženie v porovnaní s úvodným vyšetrením
% zmena v porovnaní s úvodným vyšetrením počet
p-hodnota*
|
3,0
0,8
(27 %)
238
|
2,8
1,3
(46 %)
236
< 0,001
|
2,7
1,3
(48 %)
242
< 0,001
|
2,7
1,0
(37 %)
250
0,010
|
Poznámka: V 4 pivotných štúdiách bol použitý liek Solifenacin 10 mg a placebo. V 2 zo 4 štúdií sa
použil taktiež liek Solifenacin 5 mg a v jednej štúdii bol použitý tolterodín 2 mg dvakrát denne. V každej jednotlivej štúdii neboli hodnotené všetky parametre a liečené skupiny. Preto sa uvedený počet pacientov môže v závislosti od parametrov a od liečených skupín líšiť.
* p-hodnota znamená párové porovnanie s placebom.
5.2 Farmakokinetické vlastnostiAbsorpciaPo užití tabliet solifenacínu dosiahne solifenacín maximálnu koncentráciu v plazme (Cmax) po 3 až 8
hodinách. tmax nezávisí od dávky. Cmax a plocha pod krivkou (AUC) rastie proporcionálne s dávkou v rozmedzí 5 až 40 mg. Absolútna biologická dostupnosť je približne 90 %.
Príjem potravy neovplyvňuje Cmax ani AUC solifenacínu.
Di str i búcia Zdanlivý distribučný objem solifenacínu po intravenóznom podaní dosahuje približnú hodnotu 600 l. Solifenacín sa značne (približne z 98 %) viaže na plazmatické bielkoviny, najmä na α1-kyslý glykoproteín.
Bi otr ansf or mác iaSolifenacín sa vo veľkej miere metabolizuje v pečeni, primárne prostredníctvom cytochrómu P450
3A4 (CYP3A4). Okrem toho existujú aj alternatívne cesty metabolizácie, ktoré môžu prispieť
k metabolizmu solifenacínu. Systémový klírens solifenacínu je približne 9,5 l/h a terminálny polčas solifenacínu je 45 – 68 hodín. Po perorálnom užití bol okrem solifenacínu v plazme identifikovaný jeden farmakologicky aktívny (4R-hydroxysolifenacín) a tri inaktívne metabolity (N-glukuronid, N- oxid a 4R-hydroxy-N-oxid solifenacínu).
Eli mi náci a Po jednorazovom podaní 10 mg [14C-označeného]-solifenacínu sa zistilo približne 70 % rádioaktivity v moči a 23 % v stolici počas 26 dní. V moči sa približne 11 % izotopom značenej látky vyskytovalo
vo forme nezmenenej aktívnej látky; približne 18 % vo forme N-oxid –metabolitu, 9 % vo forme 4R- hydroxy-N-oxid - metabolitu a 8 % vo forme 4R-hydroxy - metabolitu (aktívny metabolit).
Linearita/nelinearitaFarmakokinetika je v rozsahu terapeutických dávok lineárna.
Osobit né s kupiny pac i entovStaršie osobyNie je potrebná úprava dávkovania v závislosti od veku pacientov. Štúdie u starších pacientov dokázali, že pôsobenie solifenacínu, vyjadrené vo forme AUC, po podaní solifenacínium-sukcinátu
(5 mg a 10 mg jedenkrát denne) bolo podobné u zdravých starších jedincov (vo veku 65 až 80 rokov)
a u zdravých mladých jedincov (vo veku do 55 rokov). Stredná hodnota rýchlosti absorpcie vyjadrená
ako tmax bola u starších jedincov mierne pomalšia a terminálny polčas bol u starších jedincov približne
o 20 % dlhší. Tieto mierne odchýlky sa nepovažujú za klinicky významné.
U detí a dospievajúcich sa farmakokinetické vlastnosti solifenacínu nestanovili.
Pohlavie
Pohlavie nemá vplyv na farmakokinetické vlastnosti solifenacínu.
Rasa
Rasa nemá vplyv na farmakokinetické vlastnosti solifenacínu.
Porucha funkcie obličiek
AUC a Cmax solifenacínu nemali u pacientov s miernou a stredne závažnou poruchou funkcie obličiek významne odlišné hodnoty v porovnaní so zdravými dobrovoľníkmi. U pacientov so závažnou poruchou funkcie obličiek (klírens kreatinínu ≤ 30 ml/min) bola expozícia solifenacínu významne vyššia než u kontrolnej skupiny, pričom došlo k nárastu Cmax o približne 30 %, AUC o viac než 100 % a t1/2 o viac než 60 %. Štatisticky významný vzťah bol zistený medzi klírensom kreatinínu a klírensom solifenacínu.
Farmakokinetické vlastnosti u hemodialyzovaných pacientov neboli predmetom štúdie.
Porucha funkcie pečene
U pacientov so stredne závažnou poruchou funkcie pečene (Childovo-Pughovo skóre 7 až 9) nebola
hodnota Cmax ovplyvnená, avšak hodnota AUC sa zvýšila o 60 % a hodnota t1/2 sa zdvojnásobila. Farmakokinetické vlastnosti solifenacínu u pacientov so závažnou poruchou funkcie pečene neboli predmetom štúdie.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom podaní, fertility, vývinu embrya a plodu, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí. Štúdia pre- a postnatálneho vývoja u myší odhalila, že podávanie solifenacínu matke počas laktácie spôsobilo klinicky významné od dávky závislé zníženie miery prežitia po narodení, nižšiu hmotnosť mláďat a pomalší fyzický rozvoj mláďat. Bez predchádzajúcich klinických prejavov sa vyskytla zvýšená mortalita v závislosti od dávky u mláďat myší, ktorých liečba začala
od 10. alebo 21. dňa po narodení dávkami, ktoré dosiahli farmakologický účinok a u obidvoch skupín
bola vyššia mortalita v porovnaní s dospelými jedincami.
U mláďat myší, u ktorých začala liečba 10. deň po pôrode, bola expozícia v plazme vyššia než
u dospelých myší, pri liečbe po 21. dni po pôrode bola systémová expozícia porovnateľná s expozíciou
u dospelých myší. Klinický dopad zvýšenej mortality u mláďat myší nie je známy.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety:
Predželatinovaný kukuričný škrob
Bezvodá laktóza
Hypromelóza
Stearát horečnatý
Oxid kremičitý, koloidný, bezvodý
Filmový obal:
Makrogol 8000
Mastenec
Hypromelóza
Oxid titaničitý (E 171)
Červený oxid železitý ( E 172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
4 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Tablety sú balené v PVC/hliníkových blistroch.
Veľkosť balenia Aristissa 5 mg filmom obalené tablety
10, 30, 50, 90 alebo 100 tabliet.
Veľkosť balenia Aristissa 10 mg filmom obalené tablety
20, 30, 50, 90 alebo 100 tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Aristo Pharma GmbH
Wallenroder Straße 8–10
13435 Berlín
Nemecko
8. REGISTRAČNÉ ČÍSLA
Aristissa 5 mg: 73/0072/22-S Aristissa 10 mg: 73/0073/22-S
9. DÁTUM REGISTRÁCIE/DÁTUM PREDĹŽENIA REGISTRÁCIE
Aristissa 5 mg
Dátum prvej registrácie: 29. marca 2022
Aristissa 10 mg
Dátum prvej registrácie: 29. marca 2022
10. DÁTUM REVÍZIE TEXTU
12/2022