
ajlepšia možná kvalita snímok.
Odporúča sa použitie počítačovej tomografie (CT) alebo zobrazovacieho vyšetrenia pomocou magnetickej rezonancie (MRI) na korekciu útlmu.
4.3 Kontraindikácie
Precitlivenosť na liečivo, na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na ktorúkoľvek zo zložiek označeného rádiofarmaka.
4.4 Osobitné upozornenia a opatrenia pri používaní
I
ndividuálne odôvodnenie prínosu/rizika
Expozícia žiareniu u každého pacienta musí byť odôvodnená pravdepodobným prínosom. Podaná
rádioaktivita má byť v každom prípade taká nízka, aká sa dá racionálne dosiahnuť pri získaní
požadovaných diagnostických informácií.
Doteraz neexistujú žiadne údaje o výledkoch, ktoré by informovali o následnom manažmente pacientov s vysoko rizikovým ochorením, keď sa PSMA PET/CT používa na primárne určenie štádia ochorenia.
Skúsenosti s PET s použitím gálium (68Ga) gozetotidu na výber pacientov na liečbu cielenú na PSMA sú obmedzené na pacientov s progresívnym metastatickým kastračne rezistentným karcinómom prostaty (mCRPC– metastatic castrate resistant prostate cancer), ktorí boli liečení inhibíciou dráhy androgénneho receptora (AR) a chemoterapiou na báze taxánu, a na výber pacientov na liečbu lutéciom (177Lu) vipivotid tetraxetánom. Pomer prínosu a rizika nemusí byť možné zovšeobecniť na iné typy terapie cielenej na PSMA a pacientov s mCRPC s rôznymi predchadzajúcimi liečbami.
Riziko žiarenia
Gálium (68Ga) gozetotid prispieva k celkovej dlhodobej kumulatívnej expozícii pacienta žiareniu, čo je
spojené so zvýšeným rizikom karcinómu. Je potrebné zaistiť bezpečné postupy pri manipulácii,
rekonštitúcii a označení rádioaktívnou látkou, aby pacienti a zdravotnícki pracovníci boli chránení pred neúmyselnou expozíciou žiareniu (pozri časti 6.6 a 12).
Interpretácia snímok s gálium (68Ga) gozetotidom
Snímky PET s gálium (68Ga) gozetotidom sa majú interpretovať vizuálnym posúdením. Podozrenie na
malígne lézie je založené na absorpcii gálium (68Ga) gozetotidu v porovnaní s tkanivovým pozadím.
Absorpcia gálium (68Ga) gozetotidu nie je špecifická pre karcinóm prostaty a môže sa vyskytovať v normálnych tkanivách (pozri časť 5.2), pri iných typoch karcinómu a nemalígnych procesoch, potenciálne vedúcich k falošným pozitívnym nálezom. Stredná až vysoká fyziologická absorpcia PSMA je zaznamenaná v obličkách, slzných žľazách, pečeni, slinných žľazách a stene močového mechúra. Falošne pozitívne nálezy zahŕňajú, ale nie sú obmedzené na karcinóm obličkových buniek, hepatocelulárny karcinóm, karcinóm prsníka, karcinóm pľúc, benígne ochorenia kostí (napr. Pagetova choroba), pľúcnu sarkoidózu/granulomatózu, gliómy, meningiómy, paragangliómy a neurofibrómy. Gangliá môžu napodobňovať lymfatické uzliny.
Diagnostickú účinnosť gálium (68Ga) gozetotidu môžu ovplyvniť hladiny PSA v sére, liečby zamerané
na androgénové receptory, štádium ochorenia a veľkosť malígnych lymfatických uzlín (pozri
časť 5.1).
Snímky PET s gálium (68Ga) gozetotidom sa majú interpretovať len hodnotiteľmi vyškolenými na interpretáciu snímok PET s (68Ga) gozetotidom. Nálezy na snímkach PET s gálium (68Ga) gozetotidom sa majú vždy interpretovať a potvrdiť v spojení s inými diagnostickými metódami (vrátane histopatológie) pred začatím následnej zmeny v manažmente pacienta.
Príprava pacienta
Pacienti majú byť dostatočne hydratovaní pred podaním gálium (68Ga) gozetotidu a majú byť poučení,
aby sa vymočili bezprostredne pred a často počas prvých hodín po zobrazovacom vyšetrení, aby sa
znížila ich expozícia žiareniu.
O
sobitné upozornenia
O
bsah sodíka
Tento liek obsahuje 28,97 mg sodíka v každej injekcii, čo zodpovedá 1,5 % WHO odporúčaného
maximálneho denného príjmu 2 g sodíka pre dospelú osobu.
Kyslé pH a extravazácia
Nízke pH gálium (68Ga) gozetotidu môže viesť po podaní k reakciám v mieste podania injekcie.
Náhodná extravazácia môže vyvolať lokálne podráždenie spôsobené kyslým pH roztoku. V prípadoch
extravazácie sa má postupovať podľa smerníc zdravotníckeho zariadenia.
4.5 Liekové a iné interakcie
Na základe interakčných štúdií in vitro sa neočakáva akákoľvek klinicky významná interakcia gálium
(68Ga) gozetotidu s inými liekmi (pozri časť 5.2). Nevykonali štúdie interakcií.
4.6 Fertilita, gravidita a laktácia
Gravidita
Locametz nie je indikovaný na použitie u žien. Nie sú žiadne údaje o použití gálium (68Ga) gozetotidu
u žien. Štúdie reprodukčnej toxicity gálium (68Ga) gozetotidu na zvieratách sa nevykonali. Avšak
všetky rádiofarmaká, vrátane gálium (68Ga) gozetotidu, majú potenciál spôsobiť poškodenie plodu.
Dojčenie
Locametz nie je indikovaný na použitie u žien. Nie sú žiadne údaje o účinkoch gálium (68Ga)
gozetotidu na dojčeného novorodenca/dieťa alebo na tvorbu mlieka. Nevykonali sa štúdie laktácie
s gálium (68Ga) gozetotidom na zvieratách.
Fertilita
Nie sú žiadne údaje o účinku gálium (68Ga) gozetotidu na fertilitu ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Gálium (68Ga) gozetotid nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá
a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn profilubezpečnosti
Expozícia ionizujúcemu žiareniu je spojená s indukciou karcinómu a potenciálom pre vznik dedičných
porúch. Keďže účinná dávka je 0,0166 mSv/MBq, pri maximálnej odporúčanej dávke 259 MBq
(4,3 mSv) sa očakáva nízka pravdepodobnosť výskytu týchto nežiaducich reakcií.
U pacientov, ktorí dostali gálium (68Ga) gozetotid, sa vyskytli ľahké až stredne ťažké nežiaduce
reakcie, s výnimkou únavy stupňa 3 (0,1 %).
Najčastejšími nežiaducimi reakciami sú únava (1,2 %), nauzea (0,8 %), zápcha (0,5 %) a vracanie
(0,5 %).
Tabuľkový zoznamnežiaducichreakciíBezpečnostný profil gálium (68Ga) gozetotidu pri strednej dávke na telesnú hmotnosť 1,9 MBq/kg
(rozmedzie: 0,9-3,7 MBq/kg) sa vyhodnotil u 1 003 pacientov s metastatickým kastračne rezistentným karcinómom prostaty, ktorým sa podľa uváženia lekára poskytla najlepšia štandardná liečba (štúdia VISION).
Nežiaduce reakcie (Tabuľka 1) sú uvedené podľa triedy orgánových systémov MedDRA. V každej triede orgánových systémov sú nežiaduce reakcie zoradené podľa frekvencie, s najčastejšími reakciami ako prvými. V každej skupine frekvencií sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti. Okrem toho je zodpovedajúca kategória frekvencie pre každú nežiaducu reakciu založená na nasledujúcej konvencii (CIOMS III): veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až <1/1 000); veľmi zriedkavé (<1/10 000).
Tabuľka 1 Nežiaduce reakcie pozorované s gálium (68Ga) gozetotidomTrieda orgánových systémov
| Kategória frekvencie
| Nežiaduca reakcia
|
Poruchy gastrointestinálneho traktu
| Menej časté
| Nauzea
|
Menej časté
| Zápcha
|
Menej časté
| Vracanie
|
Menej časté
| Hnačka
|
Menej časté
| Suchosť v ústach
|
Celkové poruchy a reakcie v mieste podania
| Časté
| Únava
|
Menej časté
| Reakcie v mieste podania injekcie1
|
Menej časté
| Zimnica
|
1 Reakcie v mieste podania injekcie zahŕňajú: hematóm v mieste podania injekcie, pocit tepla v mieste podania injekcie, pruritus v mieste podania injekcie
|
Hlásenie podozrení na nežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 PredávkovanieV prípade podania príliš vysokej dávky žiarenia s gálium (68Ga) gozetotidom sa má dávka žiarenia absorbovaná pacientom znížiť, pokiaľ je to možné, zvýšením vylučovania rádionuklidu z tela hydratáciou a častým vyprázdňovaním močového mechúra. Môže byť užitočné odhadnúť skutočnú dávku žiarenia, ktorá bola podaná.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Diagnostické rádiofarmaká, iné diagnostické rádiofarmaká na detekciu nádorov, ATC kód: V09IX14
Mechanizmus účinkuGálium (68Ga) gozetotid sa viaže na bunky, ktoré exprimujú PSMA, vrátane malígnych buniek
karcinómu prostaty, ktoré nadmerne exprimujú PSMA. Gálium-68 je rádionuklid s emisným výstupom, ktorý umožňuje zobrazovanie PET. Na základe intenzity signálov snímky PET, získané s gálium (68Ga) gozetotidom, ukazujú prítomnosť proteínu PSMA v tkanivách.
Farmakodynamické účinkyPri chemických koncentráciách používaných pri diagnostických vyšetreniach nemá gálium (68Ga)
gozetotid žiadny farmakodynamický účinok.
Klinická účinnosť a bezpečnosťCitlivosť a špecifickosť gálium (68Ga) gozetotidu sa vyhodnotili v nasledujúcich dvoch
prospektívnych štúdiách:
V publikácii van Kalmthout a kol., 2020 103 dospelých pacientov mužského pohlavia s biopsiou potvrdeným karcinómom prostaty a strednými a vysoko rizikovými znakmi indikovanými rozšírenú disekciu panvových lymfatických uzlín (ePLND -
extended pelvic lymph node dissection) podstúpilo zobrazovacie vyšetrenie PET/CT s gálium (68Ga) gozetotidom. Snímky PET/CT hodnotili dvaja nezávislí zaslepení hodnotitelia a ePLND bol histopatologickým referenčným štandardom pre 96 zo
103 (93 %) pacientov. Citlivosť, špecifickosť, pozitívna a negatívna prediktívna hodnota (PPV a NPV, v uvedenom poradí) založená na pacientovi pri zobrazovacom vyšetrení PET/CT s gálium (68Ga) gozetotidom na detekciu metastáz v lymfatických uzlinách (LNM –
lymph node metastasis) sú zhrnuté v tabuľke 2.
Tabuľka 2 Výsledky účinnosti pri primárnom stagingu u pacientov s biopsiou preukázaným karcinómom prostaty
| Založené na pacientovi
N=961
|
Citlivosť (95% IS)
| 42 % (27,58)
|
Špecifickosť (95% IS)
| 91 % (79,97)
|
PPV
| 77 % (54,91)
|
NPV
| 68 % (56,78)
|
1 Vyhodnotiteľná populácia
|
Zhoda medzi hodnotiteľmi bola κ = 0,67 pre 2 nezávislých zaslepených hodnotiteľov. Zo 67
analyzovaných LNM bolo 26 detegovaných PET/CT s gálium (68Ga) gozetotidom, čo viedlo k 38,8 % uzlinovej citlivosti. Medián priemeru metastatického ložiska v týchto detegovaných LNM bol 7 mm (rozsah: 0,3-35). Hodnotenie PET vynechalo 41 LNM s mediánom metastatického depozitu 3,0 mm (rozsah: 0,5 až 35,0).
V publikácii Fendler a kol., 2019, sa u 635 dospelých pacientov s histopatologicky preukázaným a biochemicky recidivujúcim (BCR) karcinómom prostaty po prostatektómii (N=262), radiačnej liečbe (N=169), alebo oboch (N=204) vykonalo zobrazovacie vyšetrenie PET/CT s gálium (68Ga) gozetotidom alebo PET/MRI. BCR bola definovaná ako PSA v sére ≥0,2 ng/ml viac ako 6 týždňov po prostatektómii alebo ako zvýšenie sérového PSA o najmenej 2 ng/ml nad najnižšiu hodnotu
po definitívnej rádioterapii. Pacienti mali medián hladiny PSA 2,1 ng/ml nad najnižšou hodnotou po radiačnej liečbe (rozmedzie: 0,1-1 154 ng/ml). Kompozitný referenčný štandard, ktorý zahŕňal histopatológiu, sériu hladín PSA v sére a nálezy na snímkach (CT, MRI a/alebo skenovanie kostí), bol dostupný u 223 zo 635 (35,1 %) pacientov, zatiaľ čo samotný histopatologický referenčný štandard bol dostupný u 93 (14,6 %) pacientov. Snímky PET/CT boli posúdené 3 nezávislými hodnotiteľmi,
pre ktorých boli zaslepené klinické informácie okrem typu primárnej liečby a najnovšej hladiny PSA
v sére.
Lézie pozitívne na PSMA sa zistili u 475 zo 635 (75 %) pacientov, ktorí dostali gálium (68Ga) gozetotid, pričom miera detekcie bola významne zvýšená hladinami PSA. Miera detekcie pozitívnych lézií pri PET s gálium (68Ga) gozetotidom sa zvyšovala so zvyšujúcimi sa hladinami sérového PSA (pozri časť 4.4). Citlivosť a pozitívna prediktívna hodnota (
positive predictive value, PPV) zobrazovania PET/CT s gálium (68Ga) gozetotidom sú zhrnuté v Tabuľke 3. Hodnota Fleiss κ
medzi hodnotiteľmi bola pri zobrazovaní PET/CT s gálium (68Ga) gozetotidom v rozmedzí od 0,65 (95% IS: 0,61; 0,70) do 0,78 (95% IS: 0,73; 0,82) naprieč hodnotenými oblasťami (lôžko prostaty, panvové lymfatické uzliny, mimopanvové mäkké tkanivá a kosti).
Tabuľka 3 Výsledky účinnosti u pacientov s histopatologicky preukázaným a BCRkarcinómom prostaty
| Kompozitný referenčný štandard N=2231
| Histopatologický referenčný štandard N=931
|
Citlivosť na pacienta (95% IS)
| NA
| 92 % (84,96)
|
Citlivosť na oblasť (95% IS)
| NA
| 90 % (82,95)
|
PPV na pacienta (95% IS)
| 92 % (88,95)
| 84 % (75,90)
|
PPV na oblasť (95% IS)
| 92 % (88,95)
| 84 % (76,91)
|
1 Vyhodnotiteľná populácia
|
Zobrazovacie vyšetrenie PET/CT s gálium (68Ga) gozetotidom sa použilo na identifikáciu dospelých
pacientov s progresívnym PSMA-pozitívnym mCRPC karcinómom pre randomizovanú, multicentrickú, otvorenú štúdiu fázy III VISION, ktorá testovala účinnosť Pluvicta plus najlepšia
štandardná liečba alebo len samotná najlepšia štandardná liečba. Celkovo 1 003 mužských pacientov, ktorí boli liečení aspoň jedným inhibítorom dráhy androgénneho receptora (AR) a 1 alebo
2 predchádzajúcimi režimami chemoterapie na báze taxánu, bolo vybraných na základe PSMA expresie ich lézií karcinómu prostaty. Pacienti podstúpili zobrazovacie vyšetrenie PET/CT s gálium (68Ga) gozetotidom na vyhodnotenie expresie PSMA v léziách definovaných centrálnymi hodnotiacimi kritériami. Zlepšené celkové prežívanie a prežívanie bez rádiografickej progresie boli hlásené v ramene liečby cielenej na PSMA.
Pediatrická populáciaEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Locametzom
vo všetkých podskupinách pediatrickej populácie pre vizualizáciu PSMA pri karcinóme prostaty
(informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiDistribúciaGálium (68Ga) gozetotid vykazuje v krvi biexponenciálny priebeh, s biologickým polčasom 6,5 minút
pri rýchlej zložke a terminálnym polčasom 4,4 hodiny pri pomalšej zložke. Podľa údajov
in vitro sa gozetotid distribuuje hlavne do plazmy, s priemerným pomerom krvi ku plazme 0,71. Na bielkoviny ľudskej plazmy sa viaže 33 % gozetotidu.
Absorpcia orgánmiNajvyššia dávka absorbovaného žiarenia z gálium (68Ga) gozetotidu sa vyskytla v obličkách, slzných
žľazách, slinných žľazách, stene močového mechúra a pečeni.
Odhadované dávky žiarenia absorbovaného týmito orgánmi pri podanej aktivite 259 MBq sú
62,1 mGy (obličky), 28,5 mGy (slzné žľazy), 23,1 mGy (slinné žľazy), 14,8 mGy (stena močového
mechúra) a 13,7 mGy (pečeň).
B
i
otransformácia
Podľa údajov in vitro je gálium (68Ga) gozetotid len zanedbateľne metabolizovaný v obličkách a
pečeni.
Eliminácia
Gálium (68Ga) gozetotid sa vylučuje predovšetkým obličkami. Približne 14 % podanej dávky gálium
(68Ga) gozetotidu sa vylúči močom po 2 hodinách od podania injekcie.
Polčas
Na základe biologického a terminálneho polčasu gálium (68Ga) gozetotidu 4,4 hodiny a fyzikálneho
polčasu gália-68, ktorý je 68 minút, výsledný efektívny polčas gálium (68Ga) gozetotidu je 54 minút.
Vyhodnotenie potenciálu pre liekové interakcie in vitro
Enzýmy CYP450
Gozetotid nie je substrát, inhibítor ani induktor enzýmov cytochrómu P450 (CYP450). Neočakávajú sa žiadne liekové interakcie gálium (68Ga) gozetotidu so substrátmi, inhibítormi alebo induktormi CYP450.
Transportéry
Gozetotid nie je substrát BCRP, P-gp, MATE1, MATE2-K, OAT1, OAT3 alebo OCT2. Gozetotid nie je inhibítor BCRP, BSEP, P-gp, MATE1, MATE2-K, OAT1, OAT3, OATP1B1, OATP1B3, OCT1 alebo OCT2. Neočakávajú sa žiadne liekové interakcie gálium (68Ga) gozetotidu so substrátmi týchto transportérov.
Osobitné skupiny pacientov
Starší pacienti
V klinickej štúdii VISION bolo 752 z 1 003 (75 %) pacientov vo veku 65 rokov alebo starších.
Nepozorovali sa celkové rozdiely v bezpečnosti a účinnosti medzi týmito pacientmi a mladšími
pacientmi.
Porucha f unkc ie obl i či ek / poruc ha f unkci e peče ne
Neočakáva sa, žeby farmakokinetika a biodistribúcia gálium (68Ga) gozetotidu bola ovplyvnená poruchou funkcie obličiek/pečene v klinicky významnej miere.
5.3 Predklinické údaje o bezpečnosti
Gozetotid sa hodnotil v štúdiách farmakologickej bezpečnosti a toxicity po jednorazovom podaní. Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti a toxicity po jednorazovom podaní neodhalili žiadne osobitné riziko pre ľudí.
Karcinogenita a mutagenita
Štúdie mutagenity a štúdie karcinogenity s gálium (68Ga) gozetotidom sa nevykonali.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
kyselina gentizová trihydrát octanu sodného chlorid sodný
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v častiach 6.6 a 12.
6.3 Čas použiteľnosti
Neotvorená injekčná liekovka: 1 rok.
Po rekonštitúcii a označení rádioaktívnou látkou bola fyzikálna a chemická stabilita preukázaná počas
6 hodín pri teplote 30°C (pozri časť 6.4). Uchovávajte vo zvislej polohe.
Z mikrobiologického hľadiska sa má liek použiť okamžite, pokiaľ spôsob otvorenia, rekonštitúcia, označenie rádioaktívnou látkou alebo riedenie nevylučuje riziko mikrobiálnej kontaminácie.
Ak sa nepoužije okamžite, za čas a podmienky uchovávania pred použitím zodpovedá používateľ.
6.4 Špeciálne upozornenia na uchovávanie
Pred rekonštitúciou uchovávajte pri teplote neprevyšujúcej 25°C.
Podmienky na uchovávanie po rekonštitúcii a označení lieku rádioaktívnou látkou, pozri časť 6.3.
Uchovávanie rádiofarmák má byť v súlade s národnými predpismi pre rádioaktívne materiály.
6.5 Druh obalu a obsah balenia
Locametz sa dodáva ako viacdávkový kit na rádiofarmakum gálium (68Ga) gozetotid injekčný roztok (pozri časti 2 a 3). Locametz obsahuje jednu sklenenú injekčnú liekovku typu I Plus s objemom 10 ml, uzatvorenú gumenou zátkou a utesnenú vyklápacím viečkom.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všeobecné upozornenie
Rádiofarmaká majú preberať, používať a podávať len oprávnené osoby v určených klinických
zariadeniach. Ich prevzatie, uchovávanie, používanie, presun a likvidácia podliehajú predpisom a/alebo príslušným povoleniam kompetentnej oficiálnej organizácie.
Rádiofarmaká sa majú pripravovať spôsobom, ktorý zodpovedá požiadavkám na radiačnú bezpečnosť a kvalitu lieku. Majú sa dodržiavať príslušné aseptické opatrenia.
Obsah injekčnej liekovky je určený len na použitie pri príprave injekčného roztoku gálium (68Ga) gozetotidu a nemá sa podávať pacientovi priamo bez vykonania prípravného postupu (pozri časti 4.2 a 12).
B
ezpečnostné opatrenia,ktoréjepotrebnévykonaťpred manipuláciou s liekom alebo podaním lieku
Obsah Locametzu pred rekonštitúciou nie je rádioaktívny. Po rekonštitúcii a označení rádioaktívnou
látkou sa musí udržiavať účinné tienenie injekčného roztoku gálium (68Ga) gozetotidu (pozri časť 3).
Po rekonštitúcii a označení rádioaktívnou látkou Locametz obsahuje sterilný injekčný roztok gálium (68Ga) gozetotidu s aktivitou do 1 369 MBq. Injekčný roztok gálium (68Ga) gozetotidu obsahuje aj kyselinu chlorovodíkovú, pochádzajúcu z roztoku chloridu galitého-68.
Injekčný roztok gálium (68Ga) gozetotidu je sterilný, číry, bezfarebný roztok na intravenózne podanie, bez viditeľných častíc a s pH od 3,2 do 6,5.
Pri odoberaní a podávaní injekčného roztoku gálium (68Ga) gozetotidu sa majú dodržiavať príslušné
aseptické opatrenia.
Pri podaní lieku sa má postupovať tak, aby sa minimalizovalo riziko kontaminácie lieku a ožiarenia pracovníkov. Povinné je účinné tienenie žiarenia.
Ak sa kedykoľvek počas prípravy tohto lieku poruší celistvosť injekčnej liekovky, liek sa nemá použiť.
Pokyny na rekonštitúciu a označenie lieku rádioaktívnou látkou pred podaním, pozri časť 12.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Írsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
EU/1/22/1692/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
09. december 2022
10. DÁTUM REVÍZIE TEXTU
11. DOZIMETRIA
Gálium-68 sa vyrába pomocou generátora germánium-68/gálium-68 (68Ge/68Ga) a rozpadá sa s polčasom 68 minút na stabilný zinok-68. Gálium-68 sa rozpadá nasledovne:
• 89 % prostredníctvom emisie pozitrónov s priemernou energiou 836 keV, po ktorej nasleduje fotónové anihilačné žiarenie s energiou 511 keV (178 %).
• 10 % prostredníctvom orbitálového zachytenia elektrónov (röntgenové alebo Augerove emisie), a
• 3 % prostredníctvom 13 gama prechodov z 5 excitovaných stavov.
Účinná dávka žiarenia s gálium (68Ga) gozetotidom je 0,022 mSv/MBq, ktorá má za následok
približnú účinnú dávku žiarenia 5,70 mSv pri podanej maximálnej aktivite 259 MBq.
Priemerné dávky žiarenia absorbované orgánmi a tkanivami dospelých pacientov (N=6)
po intravenóznej injekcii gálium (68Ga) gozetotidu vrátane pozorovaných rozsahov boli vypočítané podľa Sandgren a kol., 2019 použitím voxelového fantómu ICRP/ICRU softvérom IDAC-Dose 2.1. Mediány absorbovaných dávok žiarenia gálium (68Ga) gozetotidu sú uvedené v Tabuľke 4.
Tabuľka 4 Odhadovaný medián absorbovanej dávky žiarenia s gálium (68Ga) gozetotidom Absorbovaná dávka radiácie (mGy/MBq)1N=6
Absorbovaná dávka radiácie (mGy/MBq)1N=6Orgán
| Medián (mGy/MBq)
| Rozsah (mGy/MBq)
|
Nadobličky
| 0,048
| 0,0405 – 0,0548
|
Mozog
| 0,008
| 0,0065 – 0,0079
|
Prsia
| 0,008
| 0,0077 – 0,0087
|
Endosteum (povrch kostí)*
| 0,011
| 0,0095 – 0,0110
|
Očné šošovky*
| 0,0051
| 0,0047 – 0,0054
|
Stena žlčníka
| 0,027
| 0,0212 – 0,0343
|
Stena srdca'
| 0,026
| 0,0236 – 0,0317
|
Obličky*
| 0,240
| 0,2000 – 0,2800
|
Slzné žľazy*
| 0,110
| 0,0430 – 0,2000
|
Ľavá stena hrubého čreva**
| 0,014
| 0,0120 – 0,0140
|
Pečeň*
| 0,053
| 0,0380 – 0,0710
|
Pľúca*
| 0,016
| 0,0130 – 0,0170
|
Svaly
| 0,0083
| 0,0073 – 0,0086
|
Ezofágus*
| 0,014
| 0,0110 – 0,0150
|
Pankreas
| 0,019
| 0,0173 – 0,0209
|
Rektálna stena sigmoidného hrubého čreva
| 0,013
| 0,0108 – 0,0149
|
Červená (aktívna) kostná dreň*
| 0,015
| 0,0140 – 0,0150
|
Pravá stena hrubého čreva**
| 0,014
| 0,0120 – 0,0140
|
Slinné žľazy*
| 0,089
| 0,0740 – 0,1500
|
Koža*
| 0,007
| 0,0059 – 0,0069
|
Stena tenkého čreva
| 0,014
| 0,0129 – 0,0149
|
Slezina*
| 0,046
| 0,0300 – 0,1000
|
Stena žalúdka*
| 0,015
| 0,0150 – 0,0170
|
Semenníky*
| 0,009
| 0,0074 – 0,0089
|
Týmus
| 0,0081
| 0,0072 – 0,0085
|
Štítna žľaza*
| 0,010
| 0,0090 – 0,0100
|
Stenamočovéhomechúra* 0,057 0,0280 –0,0840 Účinnádávka (mSv/MBq)*2 0,022 0,0204 –0,0242 * ako uviedli Sandgren a kol., 2019; všetky ostatné orgánové odhady boli odhadnuté na základe časovo integrovaných koeficientov aktivity zdrojových orgánov uverejnených v článku
** uvedené v Sandgren ako jediná hodnota označená “Hrubé črevo”
1 dávky boli vypočítané použitím softvéru IDAC-Dose 2.1.

2 odvodené podľa publikácie ICRP 103
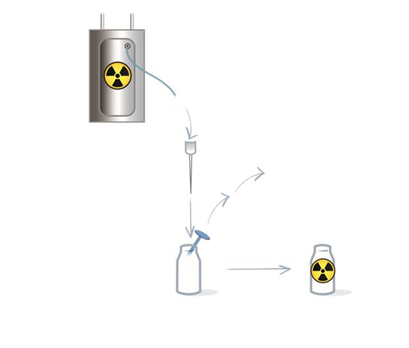
12. POKYNY NA PRÍPRAVU RÁDIOFARMÁK
Met
ó
da prípravy
K
rok 1: Rekonšti t úci a a označe ni e rádi oaktí vnou l át kou
Locametz umožňuje priamu prípravu injekčného roztoku gálium (68Ga) gozetotidu s eluátom
z jedného z nasledujúcich generátorov (osobitné pokyny na použitie každého generátora, pozri nižšie):
• generátor Eckert & Ziegler GalliaPharm germánium-68/gálium-68 (68Ge/68Ga)
• generátor IRE ELiT Galli Ad germánium-68/gálium-68 (68Ge/68Ga)
Tiež je potrebné dodržiavať návod na použitie dodaný výrobcom generátora germánium-68/gálium-68.
Injekčný roztok gálium (68Ga) gozetotidu sa má pripraviť nasledujúcim aseptickým postupom:
a. Odklopte viečko z injekčnej liekovky Locametzu a utrite zátku vhodným dezinfekčným prostriedkom, potom nechajte zátku oschnúť.
b. Prepichnite zátku injekčnej liekovky Locametzu sterilnou ihlou spojenou so sterilným 0,2 μm ventilačným filtrom na udržanie atmosférického tlaku v injekčnej liekovke počas procesu
rekonštitúcie. Umiestnite injekčnú liekovku Locametzu do olovenej tieniacej nádoby.
Postupujte podľa pokynov pre rekonštitúciu a označenie rádioaktívnou látkou špecifických
pre generátor, ako sú uvedené v Tabuľke 5 a na Obrázkoch 1 a 2. Potom prejdite ku Kroku 2.
Tabuľka 5 Rekonštitúcia a označenie rádioaktívnou látkou pomocou generátorov Eckert & Ziegler GalliaPharm a IRE ELiT Galli Ad
 A
k sa použije generátor Eckert & Ziegler
G
alliaPharm
A
k sa použije generátor IRE ELiT Galli Ad
A
k sa použije generátor Eckert & Ziegler
G
alliaPharm
A
k sa použije generátor IRE ELiT Galli Ad
• Spojte samčí konektor Luer výstupnej hadičky generátora so sterilnou elučnou injekčnou
ihlou (veľkosť 21G-23G).
• Pripojte injekčnú liekovku Locametzu priamo na výstupnú hadičku generátora vtlačením elučnej injekčnej ihly cez gumenú zátku.
Elúciu vykonajte ručne alebo pomocou čerpadla podľa návodu na použitie generátora.
| Pripojte injekčnú liekovku Locametzu cez ventilačnú ihlu so sterilným 0,2 μm
ventilačným filtrom na vákuovú injekčnú
liekovku (minimálny objem 25 ml)
prostredníctvom sterilnej injekčnej ihly (veľkosť 21G-23G) alebo na čerpadlo, aby sa začala elúcia.
| Rekonštituujte lyofilizovaný prášok s 5 ml eluátu.
| Rekonštituujte lyofilizovaný prášok s 1,1 ml eluátu.
| Na konci elúcie odpojte injekčnú liekovku
Locametzu od generátora vytiahnutím elučnej ihly a ventilačnej ihly so sterilným 0,2 μm ventilačným filtrom z gumenej zátky. Potom jedenkrát prevráťte injekčnú liekovku Locametzu a uložte ju vo zvislej polohe.
| Na konci elúcie najprv vytiahnite sterilnú ihlu
z vákuovej injekčnej liekovky alebo odpojte vákuové čerpadlo, aby sa v injekčnej liekovke Locametzu obnovil atmosférický tlak, potom odpojte injekčnú liekovku od generátora vytiahnutím elučnej ihly a ventilačnej ihly
so sterilným 0,2 μm ventilačným filtrom
z gumenej zátky.
|
|
|
• Eluujte priamo z generátora do injekčnej liekovky Locametzu.
O
brázok 1 Postup rekonštitúcie a označenia rádioaktívnou látkou pri použití generátora Eckert
& Ziegler GalliaPharm
5 ml HCl
0,1 M
68Ga v HCl
68Ge/68Ga

generátor
20-30°C
vo zvislej polohe
počas 5 min
L
yofilizovaný
prášok
gálium (
68
G
a
)
gozetotid
O
brázok 2 Postup rekonštitúcie a označenia rádioaktívnou látkou pri použití generátora IRE
EL
i
T Galli Ad
1,1 ml HCl
0,1 M
68Ga v HCl
68Ge/68Ga
generátor
Vákuum
20-30°C
vo zvislej polohe
počas 5 min
L
yofilizovaný
prášok
gálium (
68
G
a
)
gozetotid
K
rok 2: Inkubácia
a. Inkubujte injekčnú liekovku Locametzu vo zvislej polohe pri teplote miestnosti (20-30°C) počas
najmenej 5 minút bez pretrepávania alebo miešania.
b. Po 5 minútach zmerajte celkovú koncentráciu rádioaktivity injekčnej liekovky obsahujúcej injekčný roztok gálium (68Ga) gozetotidu pomocou merača dávky a zaznamenajte výsledok.
c. Vykonajte kontrolu kvality odporúčanými postupmi, aby sa overila zhoda so špecifikáciami
(pozri Krok 3).
d. Uchovávajte injekčnú liekovku Locametzu obsahujúcu injekčný roztok gálium (68Ga)
gozetotidu vo zvislej polohe v olovenej tieniacej nádobe pri teplote neprevyšujúcej 30°C až
do použitia.
e. Po pridaní chloridu galitého-68 do injekčnej liekovky Locametzu použite injekčný roztok
gálium (68Ga) gozetotidu do 6 hodín.
Krok 3: Špeci fi kácie a k ontrol a kv al it y Vykonajte kontrolu kvality uvedenú v Tabuľke 6 za tieniacim krytom z olovnatého skla na ochranu pred žiarením.
Tabuľka 6 Špecifikácie injekčného roztoku gálium (68Ga) gozetotiduTest
| Kritériá prijateľnosti
| Metóda
|
Vzhľad
| Číry bezfarebný roztok bez viditeľných častíc
| Vizuálna kontrola
|
pH
| 3,2 – 6,5
| Prúžky s indikátorom pH
|
Účinnosť označenia
| Gálium-68, ktoré nevytvorilo komplexy
≤3 %
| Instantná tenkovrstvová chromatografia (instant thin layer chromatography, ITLC, podrobnosti pozri nižšie)
|
Stanovte účinnosť označenia injekčného roztoku gálium (68Ga) gozetotidu prostredníctvom instantnej
tenkovrstvovej chromatografie (ITLC).
Vykonajte ITLC pomocou prúžkov ITLC SG a s použitím octanu amónneho 1M: metanolu (1:1 V/V)
ako mobilnej fázy.
Metóda ITLCa. Nechajte prúžok na ITLC SG vyvíjať do vzdialenosti 6 cm od miesta nanesenia (t.j. do 7 cm od spodku prúžka na ITLC).
b. Oskenujte prúžok na ITLC SG rádiometrickým skenerom na ITLC.
c. Vyrátajte účinnosť označenia integráciou vrcholov na chromatograme. Nepoužite rekonštituovaný a rádioaktívne označený produkt, ak percentuálny podiel (%) gália-68, ktoré nevytvorilo komplexy, je vyšší ako 3 %.
Špecifikácie retenčného faktora (Rf) sú tieto:
• Gálium, ktoré nevytvorilo komplexy, Rf = 0 až 0,2;
• Gálium (68Ga) gozetotid, Rf = 0,8 až 1
K
rok 4: Podanie
a. Pri odoberaní a podávaní injekčného roztoku gálium (68Ga) gozetotidu sa majú dodržiavať
aseptické postupy a ochrana pred žiarením (pozri časti 4.2 a 6.6).
b. Pred použitím vizuálne skontrolujte pripravený injekčný roztok gálium (68Ga) gozetotidu
za tieniacim krytom z olovnatého skla na ochranu pred žiarením. Majú sa použiť len roztoky, ktoré sú číre, bezfarebné a bez viditeľných častíc (pozri časti 4.2 a 6.6).
c. Po rekonštitúcii a označení rádioaktívnou látkou sa injekčný roztok gálium (68Ga) gozetotidu
môže zriediť vodou na injekcie alebo infúznym roztokom chloridu sodného 9 mg/ml (0,9 %) až
na výsledný objem 10 ml. Pre generátor IRE ELiT Galli Ad sa vyžaduje riedenie na minimálny
objem 4 ml, aby sa znížila osmolalita.
d. Pomocou jednodávkovej injekčnej striekačky so sterilnou ihlou (veľkosť 21G-23G) pred podaním asepticky a s tieniacim krytom odoberte pripravený injekčný roztok gálium (68Ga) gozetotidu (pozri časti 4.2 a 6.6).
e. Celková rádioaktivita v injekčnej striekačke sa má skontrolovať meračom dávky bezprostredne pred a po podaní gálium (68Ga) gozetotidu pacientovi. Merač dávky musí byť kalibrovaný a musí zodpovedať medzinárodným technickým normám (pozri časť 4.2).
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.