
IU. V závislosti od odpovede ovárií možno v deň podania ľudského choriogonadotropínu (hCG) podanie (rec)FSH vynechať. Vo všeobecnosti sa adekvátny folikulárny vývoj dosiahne v priemere do deviateho dňa liečby (rozmedzie 6 až 18 dní).
Hneď ako sa spozorujú tri folikuly ≥ 17 mm, na vyvolanie záverečného dozrievania oocytu sa podá jednorazová injekcia 5 000 až 10 000 IU hCG v ten istý deň alebo o deň neskôr. V prípade nadmernej odpovede ovárií si prečítajte odporúčania uvedené v časti 4.4, aby sa znížilo riziko rozvoja ovariálneho hyperstimulačného syndrómu (OHSS).
Špeciálne skupiny pacientov
Renálnaporucha
U pacientov s renálnou insuficienciou sa neuskutočnili žiadne klinické štúdie. Keďže rýchlosť eliminácie korifolitropínu alfa môže byť u pacientov s renálnou insuficienciou znížená, používanie
Elonvy u týchto žien sa neodporúča (pozri časti 4.4 a 5.2).
Poruchafunkciepečene
Hoci údaje o pacientoch s poruchou funkcie pečene nie sú dostupné, nie je pravdepodobné, že by porucha funkcie pečene ovplyvňovala elimináciu korifolitropínu alfa (pozri časť 5.2).
Pediatrická populácia
Používanie Elonvy sa netýka pediatrickej populácie v rámci schválenej indikácie. Spôsobpodávania
Subkutánnu injekciu Elonvy si môže podať žena sama alebo jej partner pod podmienkou, že jej/jemu
lekár poskytne náležité školenie. Svojpomocne si Elonvu môže podávať len žena, ktorá je dobre motivovaná, náležite vyškolená a má k dispozícii odborné poradenstvo.
4.3 Kontraindikácie
· Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
· Nádory vaječníkov, prsníka, maternice, hypofýzy alebo hypotalamu.
· Abnormálne (iné než menštruačné) gynekologické krvácanie bez známej/diagnostikovanej príčiny.
· Primárne ovariálne zlyhanie.
· Cysty na vaječníkoch alebo zväčšené vaječníky.
· Ovariálny hyperstimulačný syndróm (OHSS) v anamnéze.
· Predchádzajúci COS cyklus, ktorý mal za následok viac ako 30 folikulov ≥ 11 mm merané ultrazvukovým vyšetrením.
· Počet bazálnych antrálnych folikulov > 20.
· Myómy maternice vylučujúce graviditu.
· Malformácie pohlavných orgánov vylučujúce graviditu.
· Syndróm polycystických ovárií (PCOS).
4.4 Osobitné upozornenia a opatrenia pri používaní
Vyšetrenie neplodnostipredzačatímliečby
Pred začatím liečby sa má primerane vyhodnotiť neplodnosť páru. U žien sa má vyšetriť
predovšetkým hypotyreóza, adrenokortikálna insuficiencia, hyperprolaktinémia a nádory hypofýzy alebo hypotalamu a podať príslušná špecifická liečba. Pred začatím liečby Elonvou sa
majú tiež zhodnotiť zdravotné stavy, ktoré kontraindikujú graviditu.
Dávkovanie počasstimulačnéhocyklu
Elonva je určená len na jednorazové subkutánne podanie. Počas toho istého liečebného cyklu sa
nesmú podať ďalšie injekcie Elonvy (pozri tiež časť 4.2).
Po podaní Elonvy sa nesmie podať žiadny ďalší liek obsahujúci FSH pred 8. dňom stimulácie
(pozri tiež časť 4.2).
Renálna insuficiencia
U pacientok s miernou, stredne závažnou alebo závažnou renálnou insuficienciou môže byť
rýchlosť eliminácie korifolitropínu alfa znížená (pozri časti 4.2 a 5.2). U týchto žien sa preto použitie Elonvy neodporúča.
Neodporúčanie používaniasprotokolomagonistuGnRH
O použití Elonvy v kombinácii s agonistom GnRH sú obmedzené údaje. Výsledky malej
nekontrolovanej štúdie poukazujú na vyššiu odpoveď ovárií, než v kombinácii s antagonistom
GnRH. Preto sa používanie Elonvy v kombinácii s agonistom GnRH neodporúča (pozri tiež časť 4.2).
Ovariálny hyperstimulačnýsyndróm(OHSS)
OHSS je medicínsky stav odlišný od nekomplikovaného zväčšenia ovárií. Klinické prejavy
a príznaky mierneho až stredne závažného OHSS sú bolesť brucha, nauzea, hnačka, mierne až stredne závažné zväčšenie vaječníkov a cysty na vaječníkoch. Závažný OHSS môže byť život ohrozujúci. Klinické prejavy a príznaky závažného OHSS sú veľké cysty na vaječníkoch, akútna bolesť brucha, ascites, pleurálny výpotok, hydrotorax, dyspnoe, oligúria, hematologické abnormality a prírastok telesnej hmotnosti. V zriedkavých prípadoch sa v súvislosti s OHSS môže vyskytnúť venózna alebo arteriálna trombembólia. V súvislosti s OHSS sa hlásili
prechodné abnormality pečeňových funkčných testov svedčiace o hepatálnej dysfunkcii, ktoré môžu byť pri pečeňovej biopsii sprevádzané morfologickými zmenami alebo bez nich.
OHSS môže byť spôsobený podaním hCG a graviditou (endogénny hCG). K ranému OHSS obvykle dochádza počas 10 dní po podaní hCG a môže súvisieť s nadmernou odpoveďou ovárií na stimuláciu gonadotropínom. Neskorý OHSS sa vyskytuje po viac ako 10 dňoch od podania hCG, a to v dôsledku hormonálnych zmien súvisiacich s graviditou. Pacientky musia byť kvôli riziku rozvoja OHSS sledované minimálne dva týždne po podaní hCG.
Ženy so známymi rizikovými faktormi vysokej odpovede ovárií môžu byť osobitne náchylné na rozvoj OHSS v dôsledku liečby Elonvou. U žien, ktoré majú prvý cyklus ovariálnej stimulácie a u ktorých sú rizikové faktory známe len čiastočne, sa odporúča dôkladné sledovanie skorých prejavov a príznakov OHSS.
Pred liečbou a v pravidelných intervaloch počas liečby sa majú kvôli zníženiu rizika OHSS vykonať ultrazvukové vyšetrenia vývoja folikulov. Užitočné môže byť aj súbežné stanovenie hladiny estradiolu v sére. V prípade ART je zvýšené riziko OHSS s 18 a viacerými folikulmi s priemerom 11 mm a viac. V prípade, že je celkovo 30 alebo viac folikulov, odporúča sa pozastaviť podávanie hCG.
Na zníženie rizika OHSS sa v závislosti od odpovede ovárií odporúča zvážiť nasledovné opatrenia:
- pozastavenie ďalšej stimulácie gonadotropínom maximálne na 3 dni (dobiehanie);
- pozastavenie podávania hCG a ukončenie liečebného cyklu;
- podanie dávky nižšej než 10 000 IU hCG na spustenie záverečného dozrievania oocytov, napr. 5 000 IU hCG alebo 250 mikrogramov rec-hCG (čo je ekvivalentné približne
6 500 IU);
- zrušenie transferu čerstvého embrya a kryokonzervácia embryí;
- vyhnúť sa podaniu hCG na podporu luteálnej fázy.
Dodržiavanie odporúčanej dávky Elonvy a liečebného cyklu, i starostlivé sledovanie odpovede ovárií je dôležité na zníženie rizika OHSS. V prípade rozvoja OHSS je treba zaviesť
a dodržiavať štandardný a vhodný manažment OHSS.
Torzia ovária
Po liečbe gonadotropínmi, vrátane lieku Elonva, sa hlásila torzia ovária. Torzia ovária môže
súvisieť s ďalšími stavmi, ako je napríklad OHSS, gravidita, operácia brucha v anamnéze, torzia ovária v anamnéze a ovariálne cysty v prítomnosti alebo v anamnéze. Poškodeniu ovária
v dôsledku zníženého prívodu krvi sa dá predísť včasnou diagnostikou a okamžitou detorziou.
Viacpočetná gravidita
Pri každej liečbe gonadotropínom, vrátane liečby Elonvou, sa hlásili viacpočetné gravidity
a pôrody. Pacientku i jej partnera má lekár pred začatím liečby informovať o možných rizikách pre matku (komplikácie spojené s graviditou a pôrodom) a pre novorodenca (nízka pôrodná
hmotnosť). U žien, ktoré podstupujú metódy ART, je riziko viacpočetnej gravidity spojené
najmä s počtom prenesených embryí.
Ektopická gravidita
Neplodné ženy, ktoré podstupujú ART majú zvýšený výskyt ektopickej gravidity. Preto je
dôležité, aby sa ultrazvukom včas potvrdilo, že je gravidita intrauterinná a vylúčila sa možnosť extrauterinnej gravidity.
Kongenitálne malformácie
Výskyt kongenitálnych malformácií po ART môže byť mierne zvýšený, než po spontánnych
oplodneniach. Toto môže byť v dôsledku rozdielov charakteristiky rodičov (napr. vek matky, charakteristika spermií) a vyššiemu výskytu viacpočetných gravidít.
Nádory vaječníkovaďalšíchreprodukčnýchorgánov
U žien, ktoré podstúpili viacnásobnú liečbu neplodnosti, sa hlásili prípady benígnych aj
malígnych nádorov vaječníkov a ďalších reprodukčných orgánov.
Nie je dokázané, či liečba gonadotropínmi zvyšuje alebo nezvyšuje riziko týchto nádorov u neplodných žien.
Vaskulárne komplikácie
Po liečbe gonadotropínmi, vrátane liečby Elonvou, boli hlásené tromboembolické príhody či už
v spojení s OHSS alebo bez neho. Intravaskulárna trombóza, ktorá môže vzniknúť vo venóznych alebo arteriálnych cievach, môže viesť k zníženému prietoku krvi do životne
dôležitých orgánov alebo končatín. U žien so všeobecnými zistenými rizikovými faktormi pre trombembolické príhody, akými sú osobná alebo rodinná anamnéza, závažná obezita alebo
trombofília, môže liečba gonadotropínmi spôsobiť ďalšie zvýšenie rizika. U týchto žien musí prínos podávania gonadotropínu prevážiť riziká. Musí sa však poukázať na to, že gravidita sama tiež prináša zvýšené riziko trombózy.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne štúdie interakcií s Elonvou a inými liekmi. Keďže korifolitropín alfa nie je substrátom enzýmov cytochrómu P450, nepredpokladajú sa jeho metabolické interakcie s inými liekmi.
Elonva môže spôsobiť falošne pozitívny hCG tehotenský test, pokiaľ sa test vykoná v čase ovariálnej stimulácie ART cyklu. Môže to byť spôsobené skríženou reaktivitou niektorých hCG tehotenských testov s peptidom karboxylového konca β-podjednotky Elonvy.
4.6 Fertilita, gravidita a laktácia
Gravidita
V prípade neúmyselného vystavenia účinku Elonvy počas gravidity, klinické údaje nie sú dostatočné
na vylúčenie nežiaduceho dopadu na graviditu. V rámci štúdií na zvieratách sa pozorovala reprodukčná toxicita (pozri predklinické údaje o bezpečnosti v časti 5.3). Elonva nie je indikovaná na
použitie počas gravidity.
Dojčenie
Elonva nie je indikovaná na použitie počas dojčenia.
Fertilita
Elonva je indikovaná na použitie pri neplodnosti (pozri časť 4.1).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje.
Elonva môže vyvolať závrat. Je potrebné upozorniť ženy, aby, ak cítia závraty, neviedli vozidlá ani neobsluhovali stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
V klinických skúšaniach (N=2 397) sa počas liečby Elonvou najčastejšie hlásili nežiaduce reakcie
diskomfort v oblasti panvy (6,0 %), OHSS (4,3 %, pozri tiež časť 4.4), bolesť hlavy (4,0 %), bolesť v panve (2,9 %), nauzea (2,3 %), únava (1,5 %) a citlivosť prsníkov (1,3 %).
Tabuľkový zoznamnežiaducichreakcií
Nižšie uvedená tabuľka uvádza najdôležitejšie nežiaduce reakcie u žien liečených Elonvou
v klinických skúšaniach a počas sledovania po uvedení lieku na trh podľa tried orgánových systémov a frekvencie; veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100),
zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000) a neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
Trieda orgánového systému Frekvencia Nežiaduca reakcia
Poruchy imunitného systému Neznáme Reakcie z precitlivenosti, lokálne aj celkové, vrátane vyrážky*
Psychické poruchy Menej časté Zmeny nálady
Poruchy nervového systému Časté Bolesť hlavy
Menej časté Závrat
Poruchy ciev Menej časté Návaly horúčavy
Poruchy gastrointestinálneho traktu
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva Stavy v gravidite, v šestonedelí a perinatálnom období Poruchy reprodukčného systému a prsníkov
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Úraz
y, otravy a komplikácie liečebného postupu
Časté Nevoľnosť
Menej časté Distenzia brucha, vracanie, hnačka, zápcha
Menej časté Bolesť chrbta
Menej časté Spontánny potrat
Časté OHSS, bolesť v panve, diskomfort v oblasti panvy, citlivosť prsníkov
Menej časté Torzia ovária, bolesť maternicových príveskov, predčasná ovulácia, bolesť prsníkov
Časté Únava
Menej časté Hematóm v mieste vpichu injekcie, bolesť v mieste vpichu injekcie, podráždenosť
Menej časté Zvýšená
alanínaminotransferáza, zvýšená aspartátaminotransferáza
Menej časté Bolesť pri liečebnom postupe
Popis vybranýchnežiaducichreakciíOkrem toho sa hlásila ektopická gravidita a viacpočetné tehotenstvá. Predpokladá sa ich súvislosť
s ART alebo s následnou graviditou.
Tak ako aj pri iných gonadotropínoch, sa s liečbou Elonvou v zriedkavých prípadoch spájala tromboembólia.
Hlásenie podozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePodanie viac než jednej injekcie Elonvy počas jedného liečebného cyklu alebo podanie príliš vysokej dávky Elonvy a/alebo (rec)FSH môže zvýšiť riziko OHSS. Pre opatrenia na zníženie rizika OHSS, pozri časť 4.4.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: pohlavné hormóny a modulátory genitálneho systému, gonadotropíny
ATC kód: G03GA09
Mechanizmus účinkuKorifolitropín alfa bol vytvorený ako podporný stimulant folikulov s rovnakým farmakodynamickým
profilom ako (rec)FSH, no s výrazne predĺženým časom trvania aktivity FSH. Kvôli svojej schopnosti iniciovať a podporovať rast viacpočetných folikulov počas celého týždňa, možno v liečebnom cykle
riadenej ovariálnej stimulácie (COS) nahradiť prvých sedem injekcií ktoréhokoľvek denne
aplikovaného lieku (rec)FSH jednorazovou subkutánnou injekciou odporúčanej dávky Elonvy. Dlhodobé trvanie aktivity FSH sa dosiahlo pridaním peptidu karboxylového konca β-podjednotky
humánneho choriogonadotropínu (hCG) k β-reťazcu humánneho FSH. Korifolitropín alfa nevykazuje
žiadnu vnútornú LH/hCG aktivitu.
Klinická účinnosťabezpečnosťV troch randomizovaných, dvojito zaslepených klinických skúšaniach sa liečba jednorazovou
subkutánnou injekciou Elonvy, 100 mikrogramov (štúdia ENSURE) alebo 150 mikrogramov (štúdia ENGAGE a PURSUE), počas prvých siedmich dní riadenej ovariálnej stimulácie (COS) porovnávala s liečbou s dennou dávkou 150, 200 alebo 300 IU recFSH, v tomto poradí. Potlačenie hypofýzy antagonistom GnRH (denná dávka 0,25 mg injekcie ganirelix acetátu) sa použilo v každom z troch klinických skúšaní.
V štúdii ENSURE sa liečilo počas jedného cyklu s dávkou Elonvy 100 mikrogramov a potlačením hypofýzy antagonistom GnRH ako súčasť programu ART 396 zdravých žien s normálnou ovuláciou, vo veku od 18 do 36 rokov s telesnou hmotnosťou menej alebo rovných 60 kg. Primárnym ukazovateľom účinnosti bol počet získaných oocytov. Medián celkového trvania stimulácie bol 9 dní pre obe skupiny, čo naznačuje, že na ukončenie ovariálnej stimulácie boli potrebné dva dni podávania recFSH následne od 8. dňa stimulácie (pre túto štúdiu sa recFSH podal v deň hCG).
V štúdii ENGAGE sa liečilo počas jedného cyklu s dávkou Elonvy 150 mikrogramov a potlačením hypofýzy antagonistom GnRH ako súčasť programu ART 1 506 zdravých žien s normálnou ovuláciou,
vo veku od 18 do 36 rokov s telesnou hmotnosťou viac ako 60 kg a menej alebo rovných 90 kg. Spoločnými primárnymi ukazovateľmi účinnosti boli miera prebiehajúcich gravidít a počet získaných oocytov. Medián celkového trvania stimulácie bol 9 dní pre obe skupiny, čo naznačuje, že na
ukončenie ovariálnej stimulácie boli potrebné dva dni podávania recFSH následne od 8. dňa stimulácie
(pre túto štúdiu sa recFSH podal v deň hCG).
V štúdii PURSUE sa liečilo počas jedného cyklu s dávkou Elonvy 150 mikrogramov a potlačením hypofýzy antagonistom GnRH ako súčasť programu ART 1 390 zdravých žien s normálnou ovuláciou, vo veku od 35 do 42 rokov s telesnou hmotnosťou viac alebo rovných 50 kg. Primárnym
ukazovateľom účinnosti bola miera vitálnych gravidít. Počet získaných oocytov bol kľúčovým sekundárnym ukazovateľom účinnosti. Medián celkového trvania stimulácie bol 9 dní pre obe
skupiny, čo naznačuje, že na ukončenie ovariálnej stimulácie bol potrebný jeden deň podávania
recFSH následne od 8. dňa stimulácie (pre túto štúdiu sa nepodal recFSH v deň hCG).
Počet získaných oocytov
Vo všetkých troch štúdiách liečba jednorazovou injekciou Elonvy, 100 alebo 150 mikrogramov, počas prvých siedmich dní riadenej ovariálnej stimulácie (COS) viedla k vyššiemu počtu získaných oocytov v porovnaní s dennou dávkou recFSH. Rozdiely však boli v rámci vopred definovaných hraníc ekvivalencie (ENGAGE a ENSURE) alebo non-inferiority (PURSUE). Pozri Tabuľku 1 nižšie.
Tabuľka 1: Priemerný počet oocytov získaných v ENSURE, ENGAGE a PURSUE Populácia podľa liečebného zámeru (ITT)
Para
m
eter
ENSURE
(vek 18-36 rokov)
(telesná hmotnosť menej alebo rovných 60 kg)
ENGAGE
(vek 18-36 rokov)
(telesná hmotnosť viac ako
60 kg a menej alebo rovných
90 kg)
PURSUE
(vek 35-42 rokov)
(telesná hmotnosť viac alebo rovných 50 kg)
Elonva
10
0 µg
recFSH
15
0 IU
Elonva
15
0 µg
recFSH
20
0 IU
Elonva
15
0 µg
recFSH
30
0 IU
Priemerný počet oocytov Rozdiel
N=268 N=128 N=756 N=750 N=694 N=696
13,3 10,6 13,8 12,6 10,7 10,3

[95 % IS] 2,5 [1,2; 3,9] 1,2 [0,5; 1,9] 0,5 [-0,2; 1,2]
Gravidita z čerstvých cyklov ENGAGE a PURSUEV štúdii ENGAGE bola non-inferiorita preukázaná v mierach prebiehajúcich gravidít medzi Elonvou a recFSH, s mierou prebiehajúcich gravidít definovanou ako prítomnosť aspoň jedného plodu so srdcovou činnosťou vyhodnotenou najmenej 10 týždňov po prenose embrya.
V štúdii PURSUE bola non-inferiorita preukázaná v miere vitálnych gravidít medzi Elonvou
a recFSH, s mierou vitálnych gravidít definovanou ako percento osôb s aspoň jedným plodom so srdcovou činnosťou vyhodnotenou 5 až 6 týždňov po prenose embrya.
Výsledky gravidít z čerstvých cyklov ENGAGE a PURSUE sú zhrnuté v Tabuľke 2 nižšie.
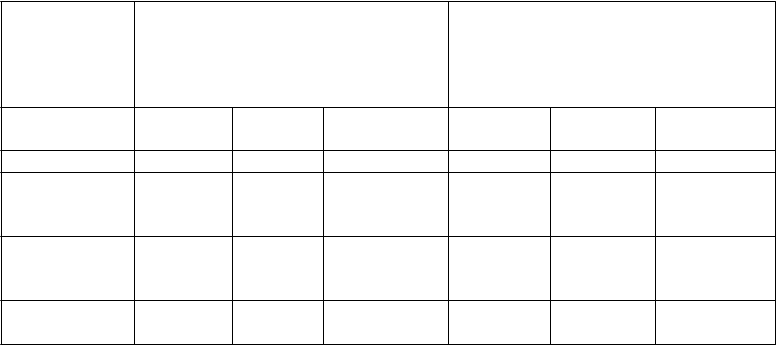
Tabuľka 2: Výsledky gravidít z čerstvých cyklov ENGAGE a PURSUE Populácia podľa liečebného zámeru (ITT)
Parameter
Čerstvé cykly ENGAGE†
(vek 18-36 rokov)
(telesná hmotnosť viac ako 60 kg a menej alebo rovných 90 kg)
Čerstvé cykly PURSUE‡
(vek 35-42 rokov)
(telesná hmotnosť viac alebo rovných
50 kg)
Elonva
150 µg
recFSH
200 IU
Rozdiel
[95 % IS]
'
Elonva
150 µg
recFSH
300 IU
Rozdiel
[95 % IS]
Miera vitálnych gravidít Miera
prebiehajúcich
gravidít Miera živorodenosti*
†
N=756 N=750 N=694 N=696
39,9 % 39,1 % 1,1 [-3,8; 5,9] 23,9 % 26,9 % -3,0 [-7,3;
1,4]
39,0 % 38,1 % 1,1 [-3.8; 5,9] 22,2 % 24,0 % -1,9 [-6,1;
2,3]
35,6 % 34,4 % 1,3 [-3,5; 6,1] 21,3 % 23,4 % -2,3 [-6,5;
1,9]
Primárnym ukazovateľom účinnosti v štúdii ENGAGE bola prebiehajúca gravidita (vyhodnotená najmenej
10 týždňov po prenose embrya).
‡Primárnym ukazovateľom účinnosti v štúdii PURSUE bola miera vitálnych gravidít definovaná ako percento osôb s aspoň jedným plodom so srdcovou činnosťou vyhodnotenou najmenej 5 až 6 týždňov po prenose embrya.
*Miera živorodenosti bola sekundárnym ukazovateľom účinnosti v ENGAGE a PURSUE.
V týchto klinických skúšaniach bol bezpečnostný profil jednorazovej injekcie Elonvy porovnateľný s každodennými injekciami recFSH.
Gravidita z cyklov prenosu mrazeného-rozmrazeného embrya (Frozen-Thawed Embryo Transfer, FTET) ENGAGE a PURSUE
Následné sledovanie FTET pre ENGAGE zahŕňalo ženy, ktoré mali rozmrazené najmenej jedno embryo na použitie až do najmenej jedného roka po kryokonzervácii. Priemerný počet embryí prenesených v cykloch FTET štúdie ENGAGE bol 1,7 v oboch liečených skupinách.
Následné sledovanie FTET pre PURSUE zahŕňalo ženy, ktoré mali rozmrazené najmenej jedno embryo na použitie v priebehu dvoch rokov od dátumu poslednej kryokonzervácie pre toto skúšanie. Priemerný počet embryí prenesených v cykloch FTET štúdie ENGAGE bol 2,4 v oboch liečených skupinách. Toto skúšanie taktiež poskytlo údaje o bezpečnosti u dojčiat narodených
z kryokonzervovaných embryí.
Maximálny počet cyklov FTET bol 5 a 4 pre následné sledovanie FTET pre ENGAGE a PURSUE, v tomto poradí. Výsledky gravidít z prvých dvoch cyklov FTET štúdií ENGAGE a PURSUE sú zhrnuté v Tabuľke 3 nižšie.
Tabuľka 3: Výsledky gravidít z cyklov FTET štúdií ENGAGE a PURSUE Populácia podľa liečebného zámeru (ITT)
Cykly FTET štúdie ENGAGE
(vek 18-36 rokov)
(telesná hmotnosť viac ako 60 kg a menej alebo rovných 90 kg)
Cykly FTET štúdie PURSUE
(vek 35-42 rokov)
(telesná hmotnosť viac alebo rovných
50 kg)
Elonva
150 µg
recFSH
200 IU
Elonva
150 µg
recFSH
300 IU
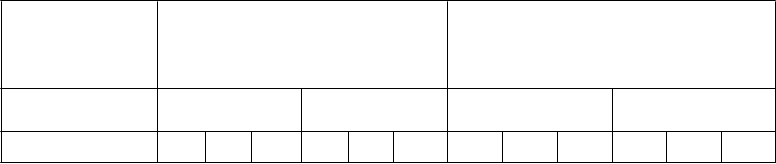
 n N % n N % n N % n N %
n N % n N % n N % n N %
cyklus 1
a
FTET
Cykly FTET štúdie ENGAGE (vek 18-36 rokov)
(telesná hmotnosť viac ako 60 kg a menej alebo rovných 90 kg)
Cykly FTET štúdie PURSUE (vek 35-42 rokov)
(telesná hmotnosť viac alebo rovných
50 kg)
Prebiehajúce gravidity
55 148 37,2 45 147 30,6 43 152 28,3 42 145 29,0
Živorodenosť - - - - - - 43 152 28,3 41 145 28,3
cyklus 2a FTET
Prebiehajúce gravidity
9 38 23,7 9 31 29,0 8 23 34,8 6 14 42,9

Živorodenosť - - - - - - 8 23 34,8 6 14 42,9
n = počet osôb s udalosťou; N = celkový počet osôb
a na prenos embrya
Kongenitálne malformácie hlásené u dojčiat narodených po cykle prenosu mrazeného-rozmrazenéhoembrya (FTET)Po podaní Elonvy sa narodilo 61 dojčiat po cykle FTET a 630 dojčiat po čerstvých cykloch ART. Miery kongenitálnych malformácií (kombinované hlavné a vedľajšie) hlásené u dojčiat narodených po cykle FTET (16,4 %) boli podobné ako u dojčiat narodených po čerstvých cykloch ART (19,5 %).
ImunogenitaZ 2 511 žien liečených Elonvou, u ktorých sa hodnotila tvorba protilátok po liečbe, u štyroch (0,16 %) sa našiel dôkaz tvorby protilátok, vrátane troch, ktorým bola podaná Elonva jedenkrát a jednej, ktorej bola podaná Elonva dvakrát. V každom prípade boli tieto protilátky non-neutralizačné
a neovplyvňovali odpoveď na stimuláciu alebo normálne fyziologické odpovede osi hypotalamus- hypofýza-ováriá (HPO). Dve z týchto štyroch žien otehotneli počas rovnakého liečebného cyklu,
v ktorom sa zistili protilátky, čo naznačuje, že prítomnosť non-neutralizačných protilátok po stimulácii
Elonvou nie je klinicky relevantná.
Pediatrická populáciaEurópska lieková agentúra udelila odklad z povinnosti predložiť výsledky štúdií pre Elonvu s
ohľadom na všetky vekové podskupiny detí a dospievajúcich s hypogonádotropným hypogonádizmom
(pozri časť 4.2 pre informáciu o pediatrickom použití).
5.2 Farmakokinetické vlastnostiFarmakokinetické parametre korifolitropínu alfa sa hodnotili po subkutánnom podaní u žien podstupujúcich liečebný cyklus riadnej ovariálnej stimulácie (COS).
Vzhľadom na dlhý eliminačný polčas sú sérové koncentrácie korifolitropínu alfa po podaní odporúčanej dávky postačujúce na udržanie rastu viacpočetných folikulov počas celého týždňa. Vďaka tomu možno nahradiť denné podávanie (rec)FSH formou prvých siedmich injekcií podaním jednorazovej subkutánnej injekcie Elonvy v riadenej ovariálnej stimulácii (COS) na vývoj viacpočetných folikulov a graviditu v programe ART (pozri časť 4.2).
Determinantom expozície korifolitropínu alfa je telesná hmotnosť. Expozícia korifolitropínu alfa je po jednorazovej subkutánnej injekcii 665 hodín*ng/ml (AUC, 426-1 037 hodín*ng/ml1) a je podobná expozícii po podaní 100 mikrogramov korifolitropínu alfa ženám s telesnou hmotnosťou menej alebo

rovných 60 kilogramov, a expozícii po podaní 150 mikrogramov korifolitropínu alfa ženám s telesnou hmotnosťou viac ako 60 kilogramov.
1 Predpovedané rozpätie pre 90 % osôb
Absorpcia
Po jednorazovej subkutánnej injekcii Elonvy je maximálna sérová koncentrácia korifolitropínu alfa
4,24 ng/ml (2,49-7,21 ng/ml1) a dosiahne sa 44 hodín (35-57 hodín1) po podaní dávky. Absolútna biologická dostupnosť je 58 % (48-70 %1).
Distribúcia
Distribúcia, metabolizmus a eliminácia korifolitropínu alfa sú veľmi podobné s inými gonadotropínmi
ako sú FSH, hCG a LH. Po absorbcii do krvi sa korifolitropín alfa distribuuje predovšetkým do ovárií
a obličiek. Distribučný objem v rovnovážnom stave je 9,2 l (6,5-13,1 l1). Expozícia korifolitropínu alfa sa zvyšuje úmerne s dávkou v rozsahu od 60 mikrogramov do 240 mikrogramov.
Eliminácia
Eliminačný polčas korifolitropínu alfa je 70 hodín (59-82 hodín1) a klírens je 0,13 l/h (0,10-0,18 l/h1). Eliminácia korifolitropínu alfa sa prednostne uskutočňuje obličkami a rýchlosť eliminácie môže byť znížená u pacientok s renálnou insuficienciou (pozri časti 4.2 a 4.4). Hepatálny metabolizmus prispieva k eliminácii korifolitropínu alfa v nepatrnej miere.
Osobitné skupinypacientov
Porucha funkcie pečene
Hoci nie sú dostupné údaje od pacientok s poruchou funkcie pečene, porucha funkcie pečene pravdepodobne neovplyvní farmakokinetický profil korifolitropínu alfa.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií toxicity po jednorazovom a opakovanom podávaní a farmakologickej bezpečnosti neodhalili žiadne osobitné riziko pre ľudí.
Štúdie reprodukčnej toxicity na potkanoch a králikoch preukázali, že korifolitropín alfa neovplyvňuje nepriaznivo fertilitu. Podanie korifolitropínu alfa potkanom a králikom pred a bezprostredne po párení sa viedlo počas ranej gravidity k embryotoxicite. U králikov, ktorým sa podával pred párením, sa pozorovala teratogenita. Embryotoxicita aj teratogenita, sa považujú za dôsledok superovulačného stavu u zvieraťa, ktoré nie je schopné podporiť počet embryí nad fyziologickú hornú hranicu. Tieto zistenia majú pre klinické použitie Elonvy obmedzený význam.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Citronan sodný Sacharóza Polysorbát 20
Metionín
Hydroxid sodný (na úpravu pH)
Kyselina chlorovodíková (na úpravu pH) Voda na injekciu
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Na uľahčenie môže pacientka liek uchovávať pri alebo do 25 °C počas obdobia nie dlhšieho ako
1 mesiac.
Injekčnú striekačku uchovávajte vo vonkajšej škatuli na ochranu pred svetlom.
6.5 Druh obalu a obsah baleniaElonva sa dodáva v naplnených injekčných striekačkách typu Luer Lock s objemom 1 ml (hydrolytické sklo typu I), uzavreté piestom z brómbutylového elastoméru a s krytom na hrote. Injekčná striekačka je kvôli bezpečnosti vybavená automatickým bezpečnostným systémom, aby sa zabránilo poraneniu pri nežiaducom vpichu po použití a je balená spolu so sterilnou injekčnou ihlou. Každá naplnená injekčná striekačka obsahuje 0,5 ml injekčného roztoku.
Elonva je dostupná s veľkosťou balenia 1 naplnená injekčná striekačka.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomNepoužívajte Elonvu, ak roztok nie je číry.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMerck Sharp & Dohme Limited
Hertford Road
Hoddesdon
Hertfordshire EN11 9BU Veľká Británia
8. REGISTRAČNÉ ČÍSLOEU/1/09/609/001
EU/1/09/609/002
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 25. január 2010
Dátum predĺženia registrácie: 22. august 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.